卒中是由于脑部血管突发破裂(出血性脑卒中)或者脑血管突发阻塞(缺血性脑卒中)导致的脑部血液供应中断或受损,其发病率逐年上升,已成为全球范围内的重大健康问题[1]。我国平均每10 s就有1人初发或复发脑卒中,每28 s就有1人因脑卒中离世。而幸存者中,约有74%存在后遗症,40%重度残疾[2]。研究表明,高达55%~75%的脑卒中幸存者存在不同程度的上肢功能运动障碍[3],其中约有一半的患者表现为肌肉无力或瘫痪,导致患者在握持、抓取、举起等上肢运动动作中存在困难。上肢功能的障碍严重影响了患者的日常生活活动能力和社会参与能力,给其家庭和社会带来了沉重的负担[4]。因此,脑卒中患者需要经过长期的物理治疗、康复训练及生活方式的调整,以最大限度地恢复或保持肢体运动功能的正常水平。
功能性电刺激 (functional electric stimulation, FES) 是一种重要的脑卒中致残患者康复治疗手段,旨在改善或恢复被刺激肌肉或肌群的功能[5]。FES原理是利用电极传递电流,诱发神经动作电位,进而引发肌肉收缩,模拟自然神经信号使受刺激的肌肉产生运动或模拟正常的自主运动[6]。通过重复训练促进神经重塑,能够帮助患者恢复基本的运动能力,如行走和抓握等。FES在恢复脑卒中患者上肢运动功能方面发挥着关键作用,通过直接刺激肌肉,可以促进上肢肌肉收缩并恢复肌肉力量,从而改善上肢的运动控制和协调能力[7]。
目前,商用的FES系统多采用单对表面电极(刺激电极和参考电极)来传递电流,但这种电极方式有两个明显缺陷:一是灵活性差,定位和精确刺激特定神经或肌肉群方面受限,因而治疗效果受到电极贴附位置和贴附面积的限制,难以刺激深层肌肉[8];二是控制精度不佳,容易受到电极位置和受刺激肌肉状态变化的影响,使得刺激效果不稳定,在实现复杂运动模式和协调动作方面存在困难,并且持续刺激同一位置时容易导致单一肌肉群的过度刺激和疲劳[9]。已有研究表明,电极放置在皮肤的神经或肌肉的“运动点”处更容易被激活,“运动点”是指在最低刺激水平下肌肉产生最强烈的刺激部位,接近肌肉运动点的刺激可以增加每单位刺激强度的肌肉力量输出,同时减少患者的不适感,从而产生更有效和舒适的肢体运动[10]。然而,在电刺激作用下肌肉产生的非等距收缩的动态运动中,运动点相对于皮肤的位置可能会随肌肉几何形状的变化而变化,这种变化可能会降低初始优化电极放置的效果[11]。因此,传统的单对表面电极无法适应肌肉长度和形状的变化,从而无法解决电极相对于肢体动态运动过程中运动点位置的变化问题,导致刺激效果受限。因此,识别肌肉的运动点以优化电极的放置位置,并在肌肉收缩过程中跟踪运动点的移动可以提高FES在临床康复中的应用效果[12]。
在上肢康复中应用FES一直是康复和神经修复领域的研究热点,目前临床应用中的FES系统大多采用开环控制方式,由康复医师使用无患者反馈的预编程模式激活肌肉,开环FES最早由Moe等[13]引入,后来由Kralj等[14]改进用于治疗偏瘫患者。开环控制在实现基本肢体功能恢复方面有一定的成效,但缺乏实时反馈机制,难以应对患者在康复训练中出现的各种干扰,例如肌肉疲劳、姿势变化及不确定的外部扰动等,系统的适应性和稳定性较差。为解决上述问题,Peckham等[15]提出 FES 闭环控制策略,以肌电信号作为反馈信息实现PID对神经肌肉的闭环控制。近年来,关于FES的闭环控制方法得到进一步发展。Allen等[16]提出积分并发学习(integral concurrent learning, ICL)控制器,使用自适应前馈项来增强FES控制器,减少所需的控制输入,改善了跟踪性能和鲁棒性。Camilo等[17]提出了基于手部肌电信号的闭环控制策略,该策略结合了有限状态机、运动分类器、比例映射及生物反馈,通过实时监测和反馈肌电信号,动态调整刺激参数,实现对神经肌肉系统的精确控制。Zhang等[18]设计了一种基于自适应神经模糊推理系统(adaptive neuro-fuzzy inference system, ANFIS)和迭代学习控制(iterative learning control, ILC)的FES系统,使用自适应模糊神经推理系统建立了关节肌肉模型,并采用PID类型的迭代学习控制器实现对FES参数的调整,提高了轨迹跟踪精度并补偿了外部干扰。Arrofiqi等[19]提出了一种实用的FES控制器,该控制器使用线性模型预测控制(model predictive control,MPC)与非线性变换级联,检验了所提控制器在控制单自由度腕关节运动中的跟踪控制能力和参数估计。然而,由于上肢肌骨系统多自由度、多肌群协同运动的非线性、多变量特性,其模型建立和参数调整过程烦琐,且很难精确描述上肢的动力学行为。因此,上述闭环控制方法在实际临床应用中容易受到内外扰动的影响。
综上所述,现有的FES系统在实际康复需求中主要受限于传统表面电极和闭环控制鲁棒性这两个方面的局限。针对上述问题,本文结合电极阵列和自抗扰控制(active disturbance rejection control, ADRC),提出了基于ADRC的多电极协同上肢康复运动控制方法。本文的创新在于建立了上肢动力学模型并提出电极切换算法,根据运动角度动态选择最佳电极组合,实现自动调整刺激位置以跟踪肌肉运动点。同时,本文引入ADRC并优化控制量实现角度跟踪控制,提高系统对内部扰动和外部干扰的鲁棒性和适应性。此外,根据康复目的设计了上肢功能性电刺激康复系统并进行实验验证。结果显示,同样使用ADRC,在上肢运动过程中根据不同角度区间实时切换电极组合,与固定电极相比,实现了更高的轨迹跟踪精度。
1 上肢FES康复系统和动力学模型
1.1 上肢FES康复系统
上肢FES康复系统的结构如图1所示。该系统硬件平台主要包括上位机、控制器、多通道刺激器、电极阵列、角度传感器及EMG采集器等。控制器使用Arduino Nano单片机,通过串口与上位机通信,用于控制多通道刺激器输出特定频率和脉宽的刺激信号。多通道刺激器集成多通道信号发生模块、多通道输出接口、电源接口及USB接口,通过USB发送PWM信号生成所需刺激信号,并传输到电极阵列,电源接口连接外部电源,为刺激器提供稳定电压。电极阵列由柔性电路板(flexible printed circuit, FPC)制成,包括4×4个独立电极和1个参考电极,贴附在被试者肱二头肌的皮肤表面。由于FPC的可弯折性能够覆盖肱二头肌的整个肌腹,每个电极覆盖导电电极凝胶,能够降低接触电阻,提升舒适感。使用Biometrics Ltd角度传感器测量肘关节运动角度,采样频率为100 Hz,使用时将两端分别固定在被试者上臂和前臂,采集到的角度信号实时反馈至控制器,控制器根据预设的控制策略实时调整输出的PWM信号。肌电信号使用Delsy系统采集,用于分析肌肉疲劳程度。
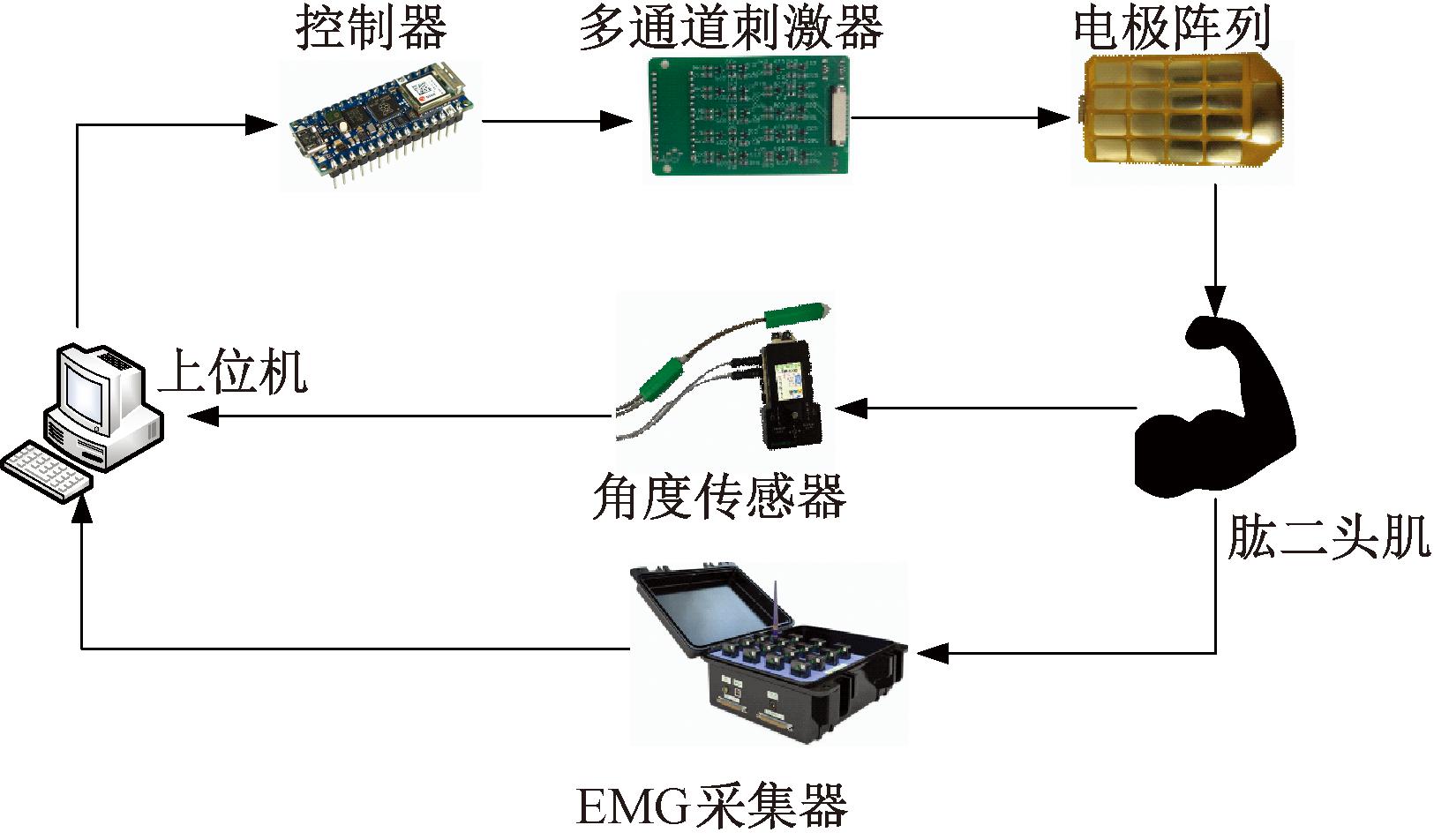
图1 上肢功能性电刺激康复系统结构图
Figure 1 Structural diagram of functional electrical stimulation rehabilitation system of upper limb
1.2 上肢动力学模型
患者脑卒中后,肱二头肌常出现过度活跃和痉挛,会限制上肢的伸展和功能性使用,影响患者的日常生活[20]。通过针对性刺激肱二头肌,可以增强其力量和控制能力,改善上肢功能[21]。目前研究者已经提出了许多复杂的肌肉模型,但这些模型通常跨越多个关节,这使得上肢肌骨系统非常复杂[22-23]。
图2为上肢结构模型及电极阵列组合方式。如图2(a)所示,肩关节和肘关节、肘关节和腕关节的连线确定了一个平面,肘关节的屈/伸运动始终在该平面内。假设在肱二头肌上施加FES会产生一个与前臂、上臂正交的轴的力矩,从而影响肘关节的角度[24],因此,可以得到上肢动力学模型:
(1)
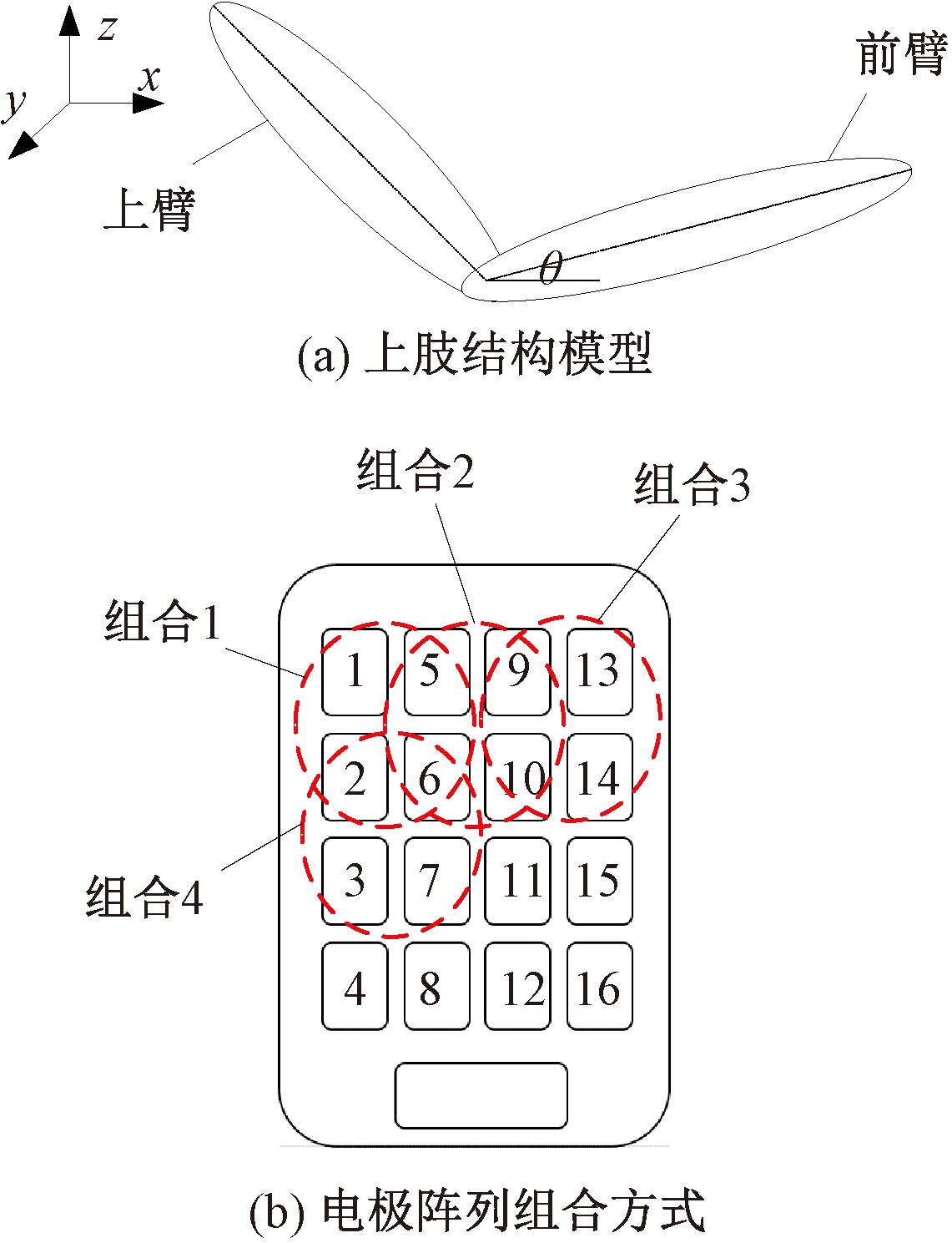
图2 上肢结构模型及电极阵列组合方式
Figure 2 Structure model of upper limb and electrode array combination
式中:g(·)表示应用FES产生的力矩;Bh(·)为惯性矩阵;Ch(·)为科里奥利力矩阵;Fh(·)为摩擦力;Gh(·)为重力;θ为前臂和水平面的夹角;u为发送到电极阵列内各单元的电刺激脉冲宽度信号。
假设电极阵列内每个单元输出的电刺激都能引起肘关节做屈伸运动。测试表明,使用电极单元太少会导致电流密度过大,被试者会感到刺痛;过多则会刺激到多余肌肉。最终采用图2(b)所示的4个电极组合,取横向相邻的两个电极与其对应下方的两个电极构成一组电极组合,共计9种组合方式:
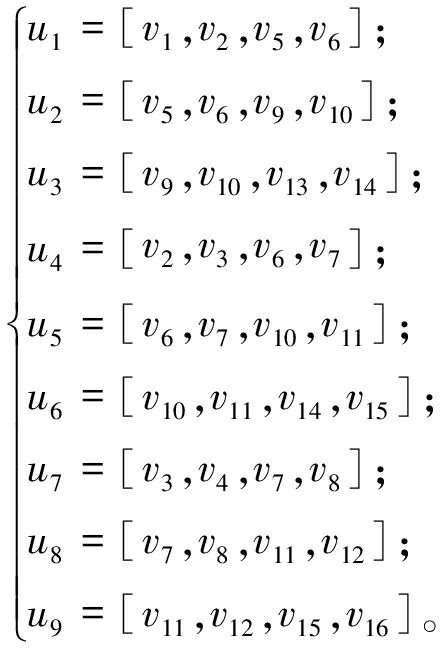
(2)
式中:vi为阵列内各电极单元的序号。每种组合方式产生的力矩为相应4个电极单元输出电刺激产生的力矩之和,即
(3)
由于上肢在屈伸运动中Ch(·)和Fh(·)一般较小,可以忽略。对相同被试者,在相同关节角度下,不同电极组合刺激产生的力矩大小只与![]() 有关,即
有关,即
因此,通过分析关节运动的角加速度,可以判断不同电极组合产生力矩的强弱。
2 控制策略
2.1 电极切换算法
在电刺激肱二头肌产生肘关节运动时,将每个电极组合得到的运动角度划分组距等于10°的若干区间。根据1.2节上肢动力学模型,在上肢质量和关节角度确定的情况下,力矩取决于角加速度,即角加速度越大,力矩越大。因此,在每个角度区间内,使得角加速度最大的电极组合即为该角度区间的最优组合。
在电刺激过程中由于肌肉的非线性响应、刺激信号的高频特性以及传感器采样率不足等因素的影响,角度传感器获得的关节角度存在明显抖动。为减少干扰,首先对采集的角度值进行滑动平均滤波:
(4)
式中:θf(t)为第t时刻经过滤波后的值;θ(t-n)为第t时刻的原始信号值;M为滑动窗口的大小,设置滑动窗口M=5;n为窗口内的样本索引。
对滤波后的角度值按照10°的组距进行划分,并对每个角度区间求取平均角加速度:
(5)
式中:α为角加速度;θ为角度值;t为采样时间。
定义αmj为第m个区间内第j个电极组合的平均角加速度。对每个角加速度按照分组求其平均角加速度,比较每个角度区间的平均角加速度,即可得到第m个区间的最优电极组合为
(6)
在确定所有角度区间的最优电极组合后,即可在电刺激产生的关节运动依次达到每个角度区间时实时切换对应的电极组合,提升FES的效果。
2.2 电刺激控制量归一化
结合2.1节所示的电极切换算法,由于每个电极组合刺激的位置不同,其阈值脉宽也有所差异,为防止ADRC输出的控制信号超出当前电极组合的阈值脉宽,对被试者造成不适,应先确定每个电极组合的阈值脉宽τth:
τth,j=τbase+Δτ。
(7)
式中:τth,j为第j个电极组合的阈值脉宽;τbase为基础脉宽,设定τbase=0;Δτ为脉宽增量,设定Δτ=10。
为了使ADRC输出的控制信号适应不同电极组合的阈值脉宽,需要将控制量归一化到[0,1]内,假设ADRC输出的原始控制量为u(t),得到归一化的控制量:
(8)
式中:umin为控制量的最小值,为简化计算,设定umin=0;umax为控制量的最大值。
考虑到每个实验对象的个体差异和不同的耐受程度,为确保电刺激在安全范围内,将预实验确定的最大阈值乘以一个安全系数以确定umax:
umax=σ·τth,j。
(9)
取σ=0.8,则式(8)可简化为
(10)
在实验过程中,由于肌肉疲劳和位置变化等因素,ADRC的控制量可能会变化,因此,需要根据实时反馈动态调整控制量,并将归一化后的控制量重新缩放到当前电极组合的阈值范围内,得到最终的控制量:
ufinal(t)=min(unorm(t),1)τth。
(11)
式中:τth为当前应用的电极组合的阈值脉宽。
2.3 基于PD控制的ADRC算法
ADRC包括3个主要部分:跟踪-微分器(tracking differentiator, TD),扩张状态观测器(extended state observer, ESO)和非线性状态误差反馈(nonlinear state error feedback, NLSEF)[25]。为避免参数过多导致系统设计和调试复杂,本文将NLSEF简化为PD控制率,得到简化后的ADRC控制器框图如图3所示。
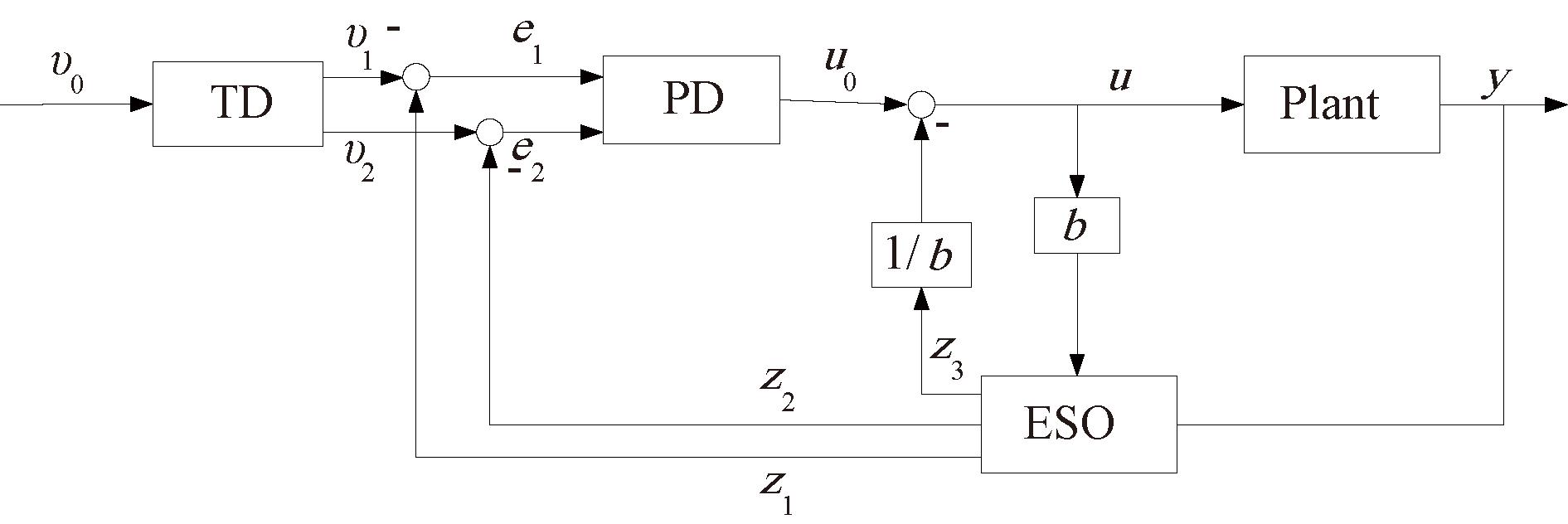
图3 简化后的ADRC控制器框图
Figure 3 Simplified ADRC controller block diagram
TD 用于对系统参考输入进行平滑处理,可以有效地处理噪声,为控制系统提供平滑的参考信号和参考信号的导数,二阶系统的非线性TD描述为
![]()
(12)
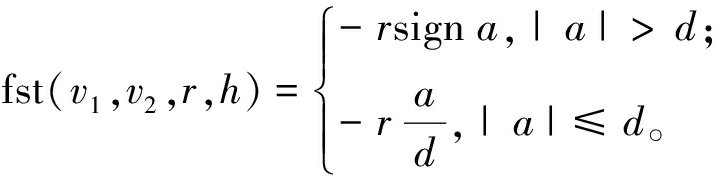
(13)
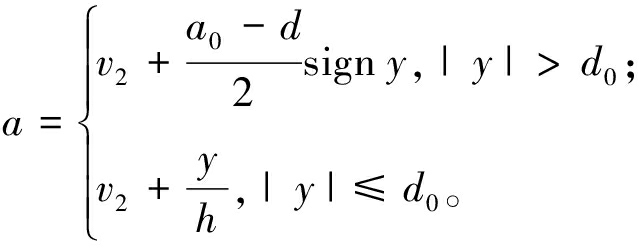
(14)
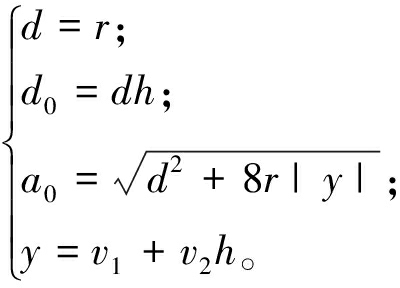
(15)
式中:状态变量v1、v2分别为期望信号v的跟踪信号和微分信号;k为第k个信号采样时间;h为采样步长;r为速度因子;a为系统的加速因子;y为输入信号的跟踪信号。
外部扰动和未建模动态通过 ESO 对系统状态进行实时估计并给出补偿:
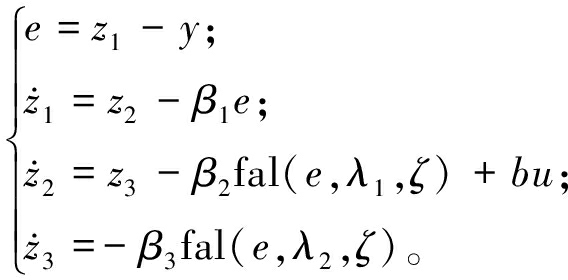
(16)
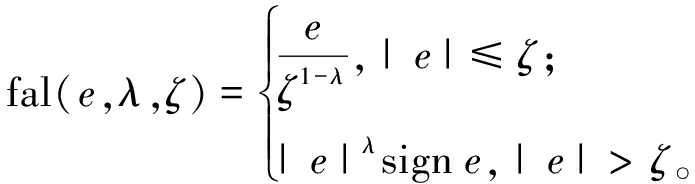
(17)
式中:e为系统的估计误差;b为控制对象参数;λi>0(i=1,2),取λ1=0.50,λ2=0.25;βi>0(i=1,2,3);ζ为步长,ζ=0.002 5;fal(·)为非线性函数。ESO的输出变量可以跟踪系统的状态变量,即z1为角度的观测估计,z2为角速度的观测估计,z3为系统总扰动的估计。
简化后的ADRC采用PD控制律,其控制信号u0为
u0=kp(v1-z1)-kdz2。
(18)
式中:kp和kd分别为比例系数和微分系数。扰动补偿形成控制量:
(19)
3 仿真与实验验证
3.1 仿真分析
为验证所设计的基于ADRC的多电极协同功能性电刺激控制方法的有效性,本文首先对应用于关节角度跟踪的ADRC在Simulink中进行仿真实验,仿真示意图如图4所示。
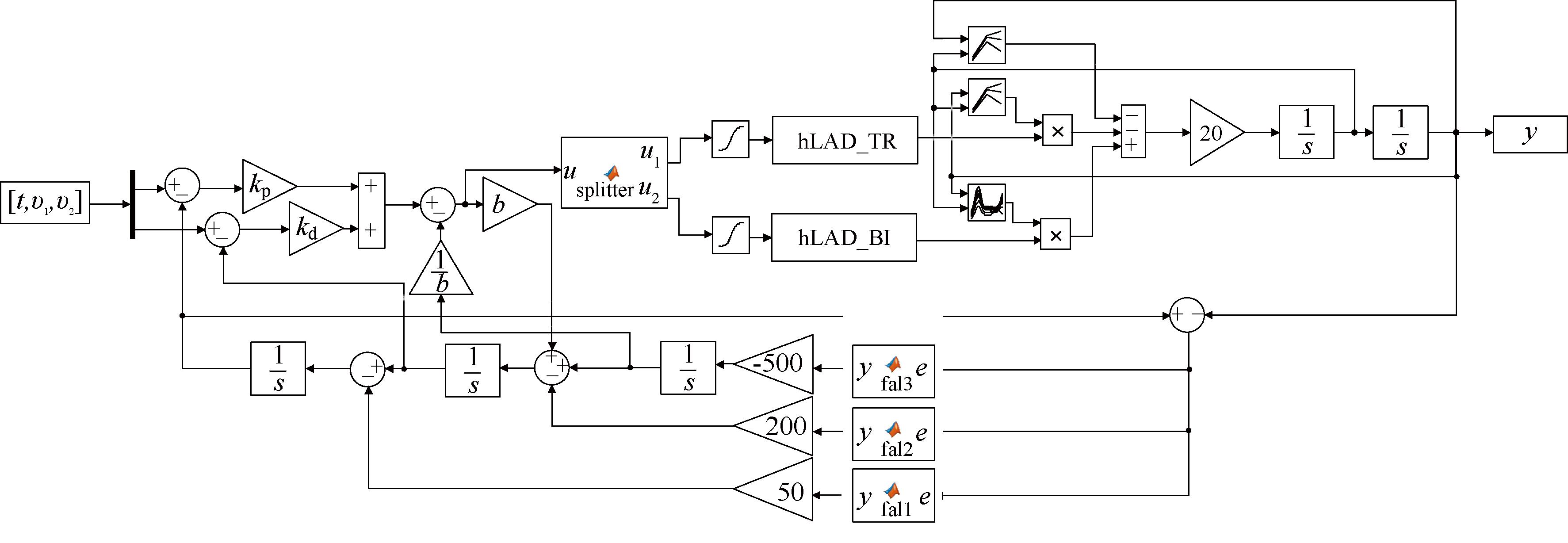
图4 Simulink仿真示意图
Figure 4 Simulation diagram
ADRC中的ESO和PD控制器的参数可以通过带宽法来确定。带宽法的基本思想是通过设定观测器和控制器的带宽来确定其参数,以确保系统具有良好的动态性能,一般取![]() 这样,ADRC的参数简化为r、h、b、ω0、kp、kd。本文取r=100、h=0.01、b=0.01、ω0=2、kp=100、kd=50。
这样,ADRC的参数简化为r、h、b、ω0、kp、kd。本文取r=100、h=0.01、b=0.01、ω0=2、kp=100、kd=50。
设定采样频率为40 Hz,仿真时间为10 s,期望信号v0=
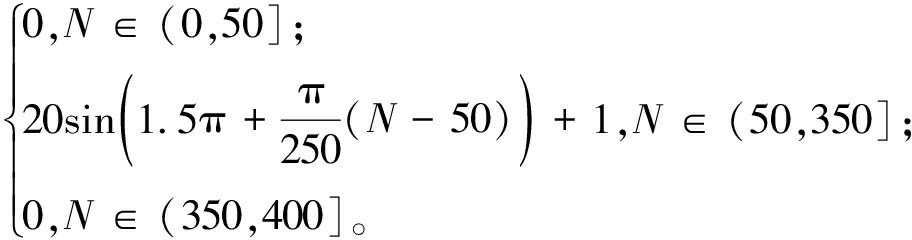
图5为TD跟踪期望角度的信号。由图5可以看出,在给定参数下跟踪信号v1能够快速无超调地跟踪期望信号v0 ,显示出良好的动态响应特性。v2为TD对期望信号v0的微分,反映了信号变化的速度,这表明TD不仅在角度跟踪上表现出色,还能有效地估计信号的动态变化特性。
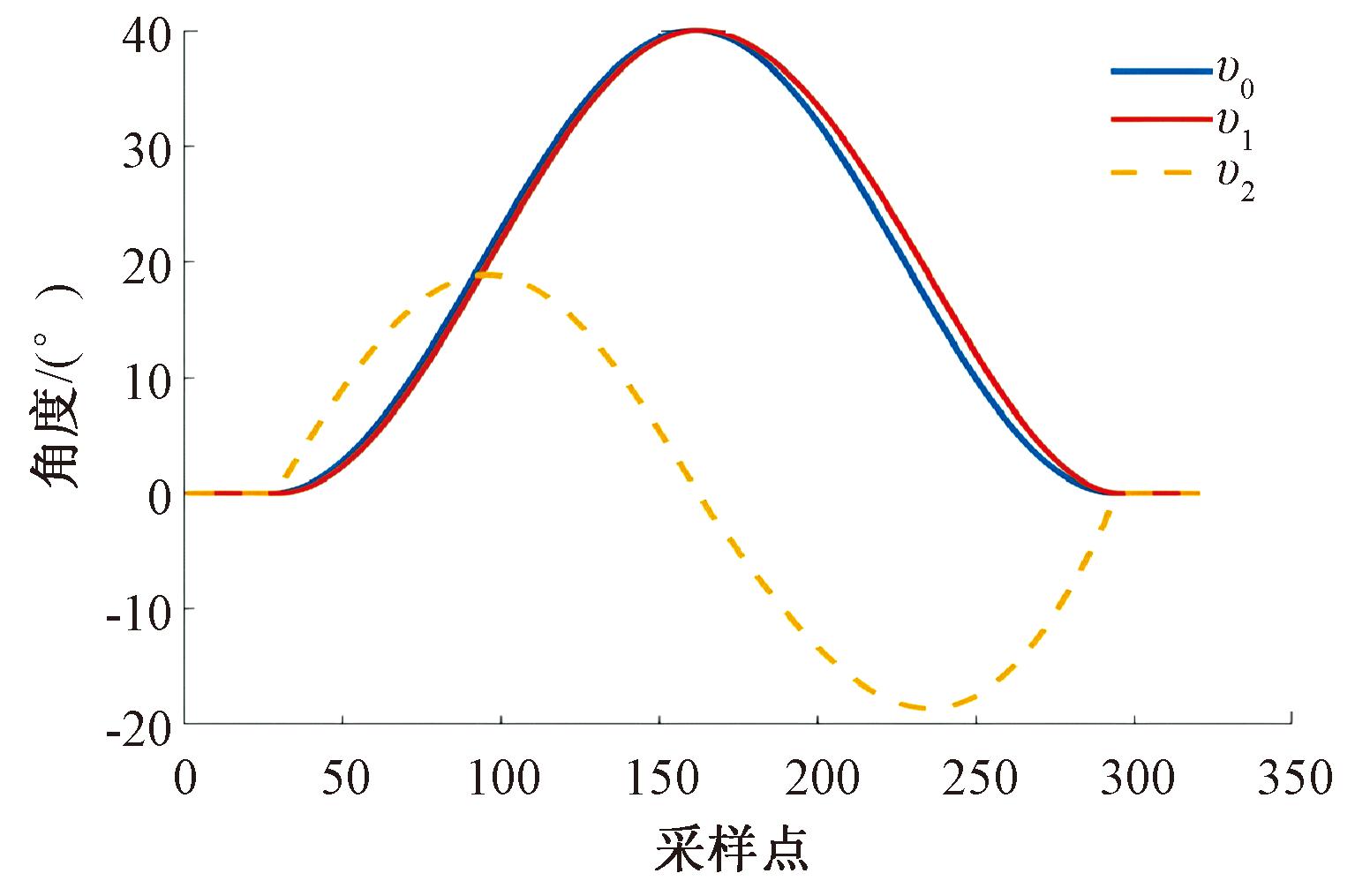
图5 TD对期望角度的跟踪曲线
Figure 5 Trace curve of TD for expected angle
以上结果验证了 TD 在本次实验条件下的有效性和可靠性,证明其在控制系统中应用的可行性。
本文采用Freeman[24]设计的上肢肌骨模型作为仿真模型,图6为在该模型的基础上ESO跟踪期望信号的结果。y为控制器作用于肌骨模型跟踪v1的输出信号,z1为ESO对肌骨模型角度输出的状态观测。由图6可以看出,输出的角度值y能够实现对期望信号的跟踪,并且ESO的跟踪值z1与肌骨模型的输出y基本重合,这表明ESO能够准确地跟踪肱二头肌肌骨模型的状态变量。
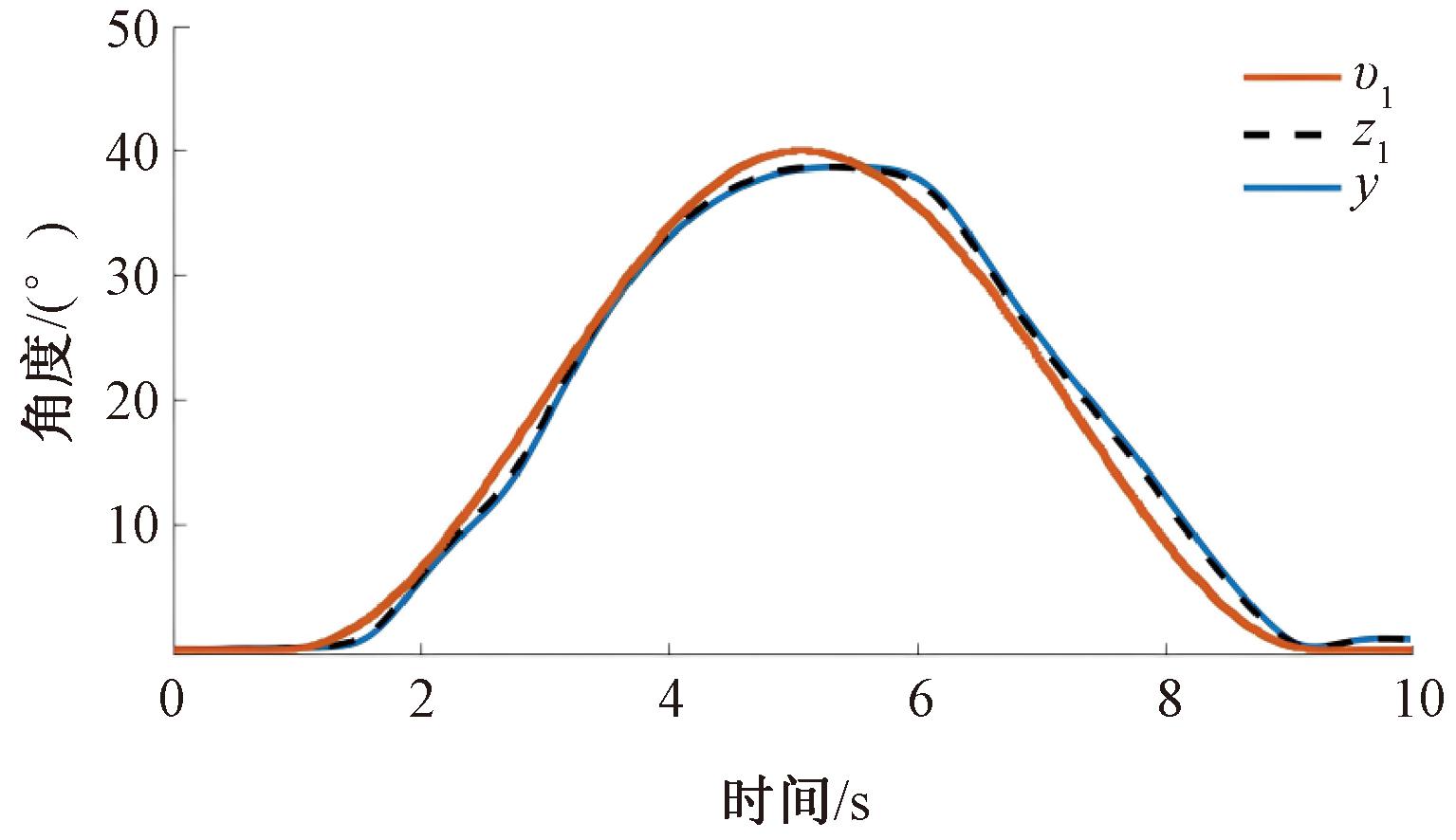
图6 ADRC跟踪肱二头肌肌骨模型角度输出曲线
Figure 6 Angular output curve of biceps musculoskeletal model tracked by ADRC
3.2 实验验证
为了验证本控制策略在实际康复应用中的可行性,对4名健康的实验对象进行测试,在实验前获得所有实验对象的书面同意。在参加实验前没有上半身关节问题的病史和神经系统方面的疾病,也没有报告任何肱二头肌的疼痛,在实验开始前24 h内,实验对象的肱二头肌处于放松状态,没有经历长时间的收缩疲劳。本文的实验已获得郑州大学生命科学伦理审查委员会的许可,伦理证书编号:ZZUIRB2023-085。
图7为实验设置示意图。如图7所示,设置串口连接上位机和多通道刺激器,接入电源使多通道刺激器处于工作状态,使用排线连接多通道刺激器和电极阵列,将电极阵列用医用胶带贴附至每名实验对象肱二头肌的肌腹,并在肘关节处固定角度传感器,将每名实验对象在自然放松状态下角度传感器测量得到的肘关节角度置零。角度传感器的两端分别固定在实验对象的上臂和前臂,确保传感器与肘关节连接稳定。为达到准确测量效果,传感器的安装位置须在肘关节的中心轴线附近,以便有效捕捉肘关节的运动角度变化。
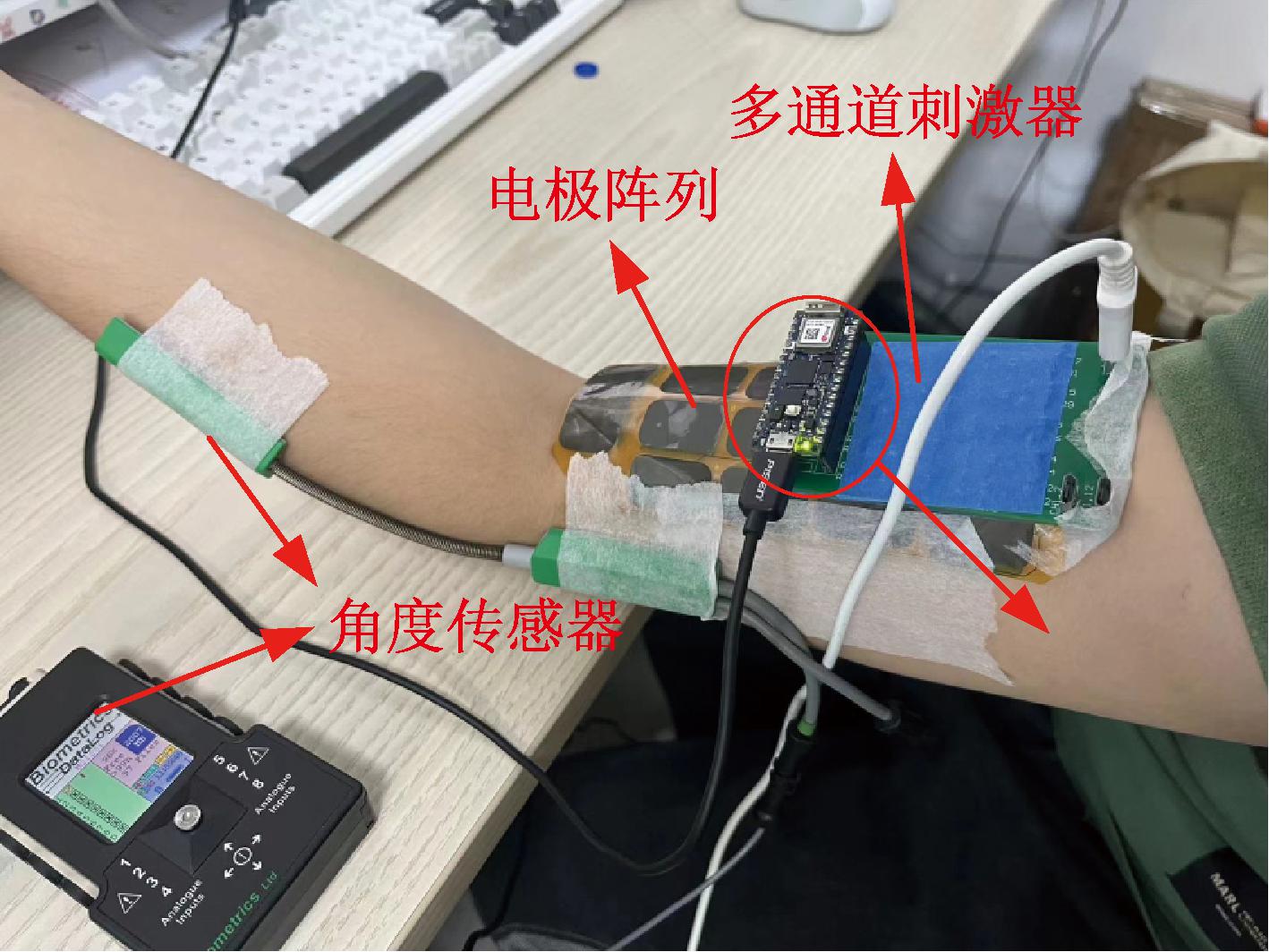
图7 实验设置示意图
Figure 7 Schematic diagram of experimental setup
实验首先确定每名实验对象不同角度区间的最优电极组合,为模拟脑卒中患者的上肢偏瘫状态,每名实验对象的被试上肢在电刺激过程中处于放松状态,不加入自主意愿。
实验具体流程如下。
步骤1 阈值电压测试。对电极组合1,从0开始逐步增加脉宽,通过多通道电刺激器对实验对象施加电刺激。当实验对象感到不适时,立即停止输出,并记录此时的阈值脉宽和关节产生的运动角度。
步骤2 重复测试。对剩余的8种电极组合重复步骤1中的测试过程,为防止肌肉疲劳产生的不良影响,每名实验对象休息1 min后进行下一组测试。
步骤3 数据处理。完成所有9组测试后,将电极组合及对应的角度值输入到电极切换算法,根据该算法确定每名实验对象在不同角度区间的最优电极组合。
图8为分别应用9种电极组合电刺激实验对象3得到对应的阈值脉宽,肱二头肌不同的部位对电刺激的耐受程度表现出明显差异。对实验对象3来说,电极组合4和5的阈值脉宽较低,能够在较小的电刺激脉宽下有效激活目标肌肉,而较高的阈值脉宽即电极组合9需要更强的刺激才能达到相同的激活效果。这表明电极组合的选择对于刺激效果和耐受性的调节至关重要。不同部位的阈值脉宽数据反映了肌肉组织在电刺激响应方面的生理差异,这些差异对于个性化的功能性电刺激治疗方案的制定具有重要意义。
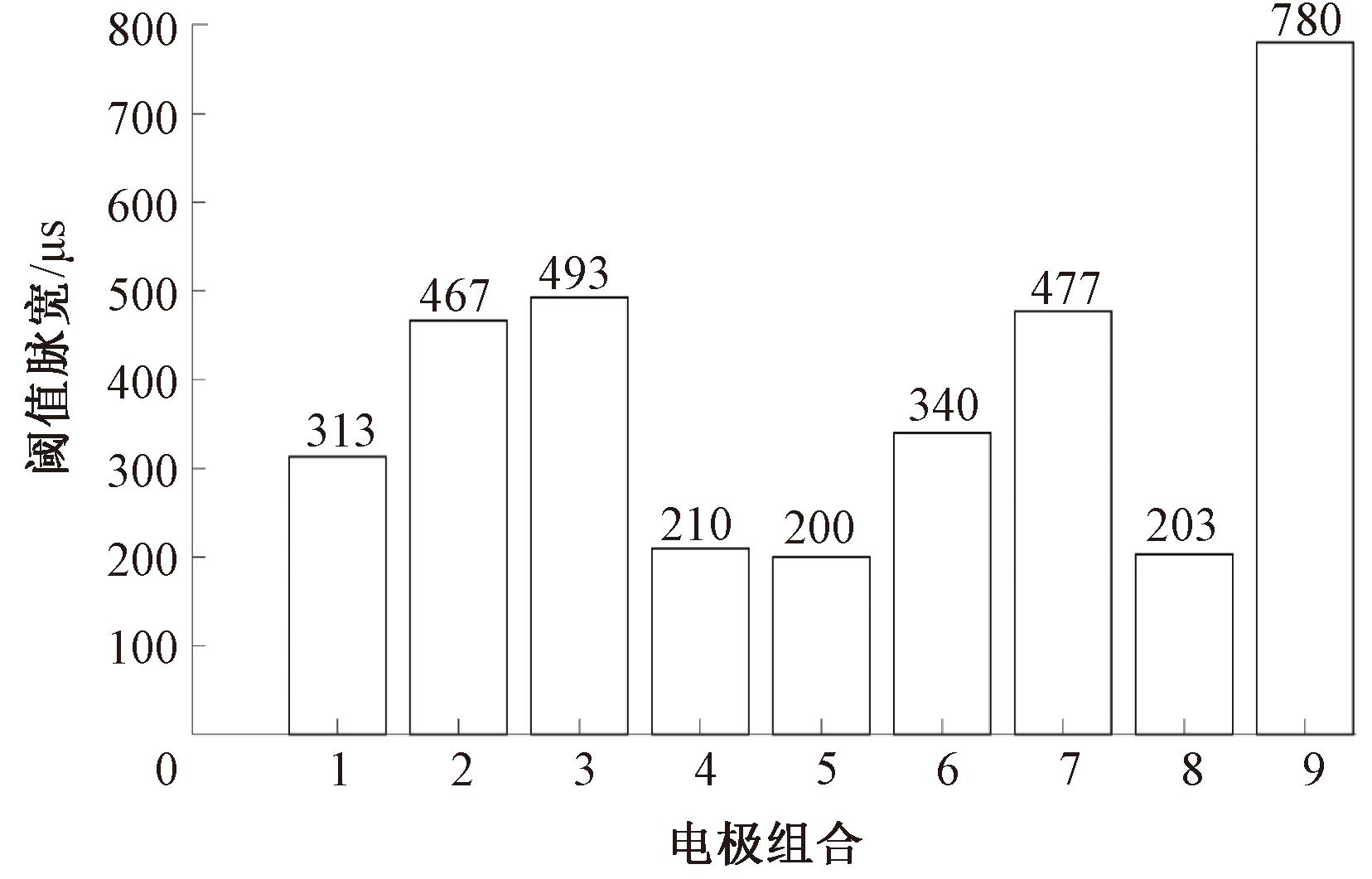
图8 实验对象3应用9种电极组合对应的阈值脉宽
Figure 8 Threshold pulse width corresponding to 9 electrode combinations applied to subject 3
图9反映了实验对象3的9种电极组合在不同角度区间下的平均角加速度。实验对象3在不同电极组合的刺激下产生的肘关节运动中,平均角加速度可以反映电极组合的刺激效果,平均角加速度越大,则刺激效果越好。由图9可以看出,每种电极组合在每个角度区间的作用效果不同,并且每个角度区间内的最佳电极组合也不同。这表明在关节运动过程中,最佳的刺激位置和组合会随角度的变化而改变。
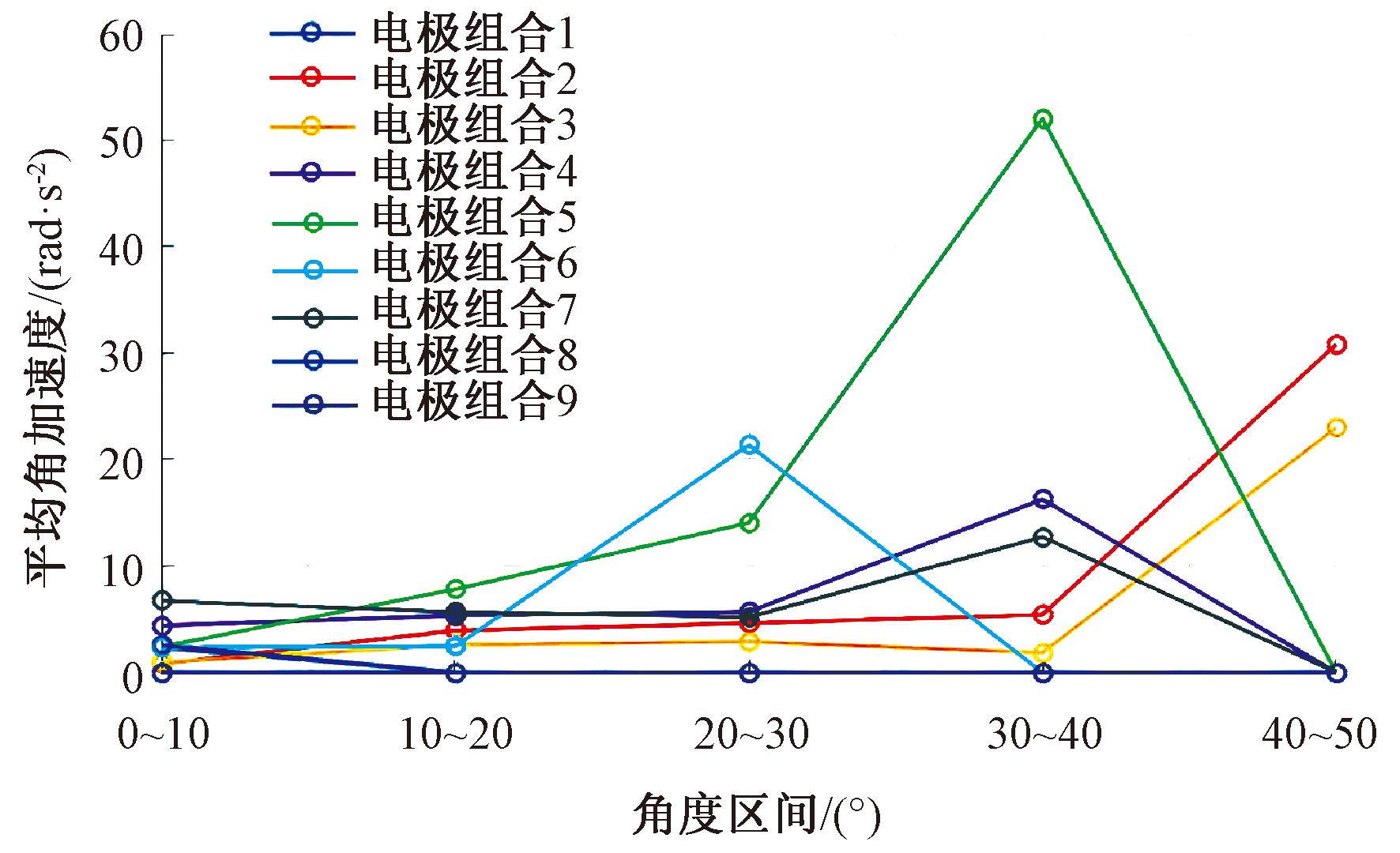
图9 实验对象3应用9种电极组合在不同角度区间下的平均角加速度
Figure 9 Average angular acceleration of subject 3 with different angle interval with 9 electrode combinations
图10为根据平均角加速度得出的实验对象3在不同角度区间的最优电极组合。由图10可以看出,实验对象3在0~10°时最优电极组合为电极组合7,10°~20°时为电极组合5,20°~30°时为电极组合6,30°~40°时为电极组合5,40°~50°时为电极组合2。结合电极阵列的贴附位置来看,随着FES过程中肌肉收缩产生的肘关节运动,肱二头肌的肌腹呈现向肩关节方向移动的趋势,这与实际做屈肘运动时肱二头肌的变化相符。
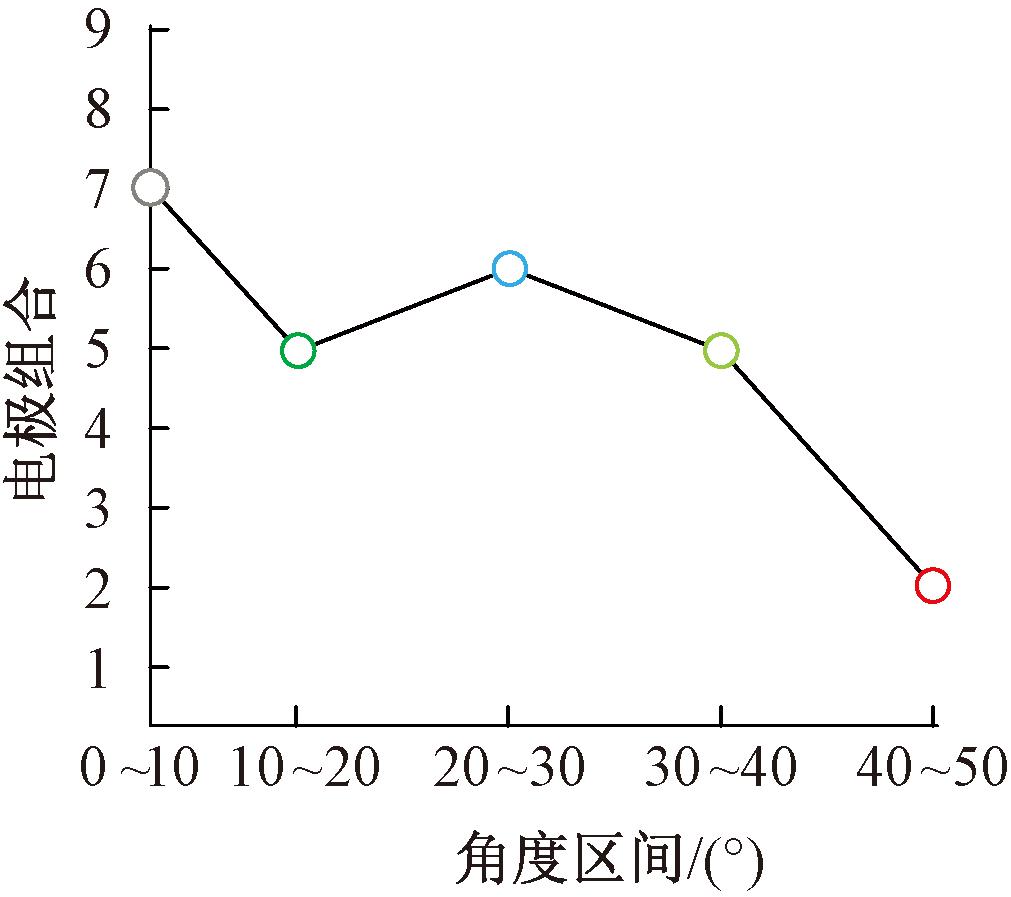
图10 实验对象3在不同角度区间下最优电极组合的变化
Figure 10 The change of the optimal electrode combination of subject 3 in different angle interv
在确定4名实验对象每个角度区间的最优电极组合后,采用本文设计的控制器对每名实验对象做角度跟踪控制,为防止肌肉疲劳,每名实验对象做一次实验。期望v0设为峰值为40°的正弦波形,采样频率为40 Hz,实验时间为10 s。由于ADRC的鲁棒性,不同实验对象的ADRC参数虽然不同,但互相具有参考意义,根据个体情况调整的ADRC各参数如表1所示。
表1 4名实验对象的ADRC控制器参数
Table 1 ADRC controller parameters of 4 subjects
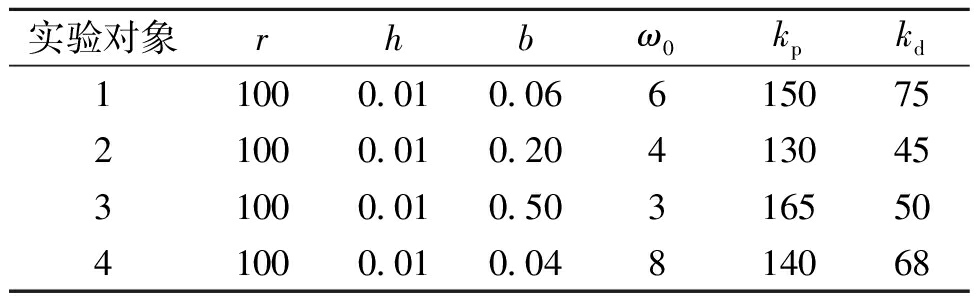
实验对象rhbω0kpkd11000.010.0661507521000.010.2041304531000.010.5031655041000.010.04814068
根据上述参数,得到如图11所示的基于ADRC的控制器跟踪结果。由图11可以看出,系统输出与参考输入非常接近,没有过大的波动,表明本文提出的控制器能够在上肢运动过程中实现高精度、高稳定性的角度跟踪,有效提高了系统的控制性能。
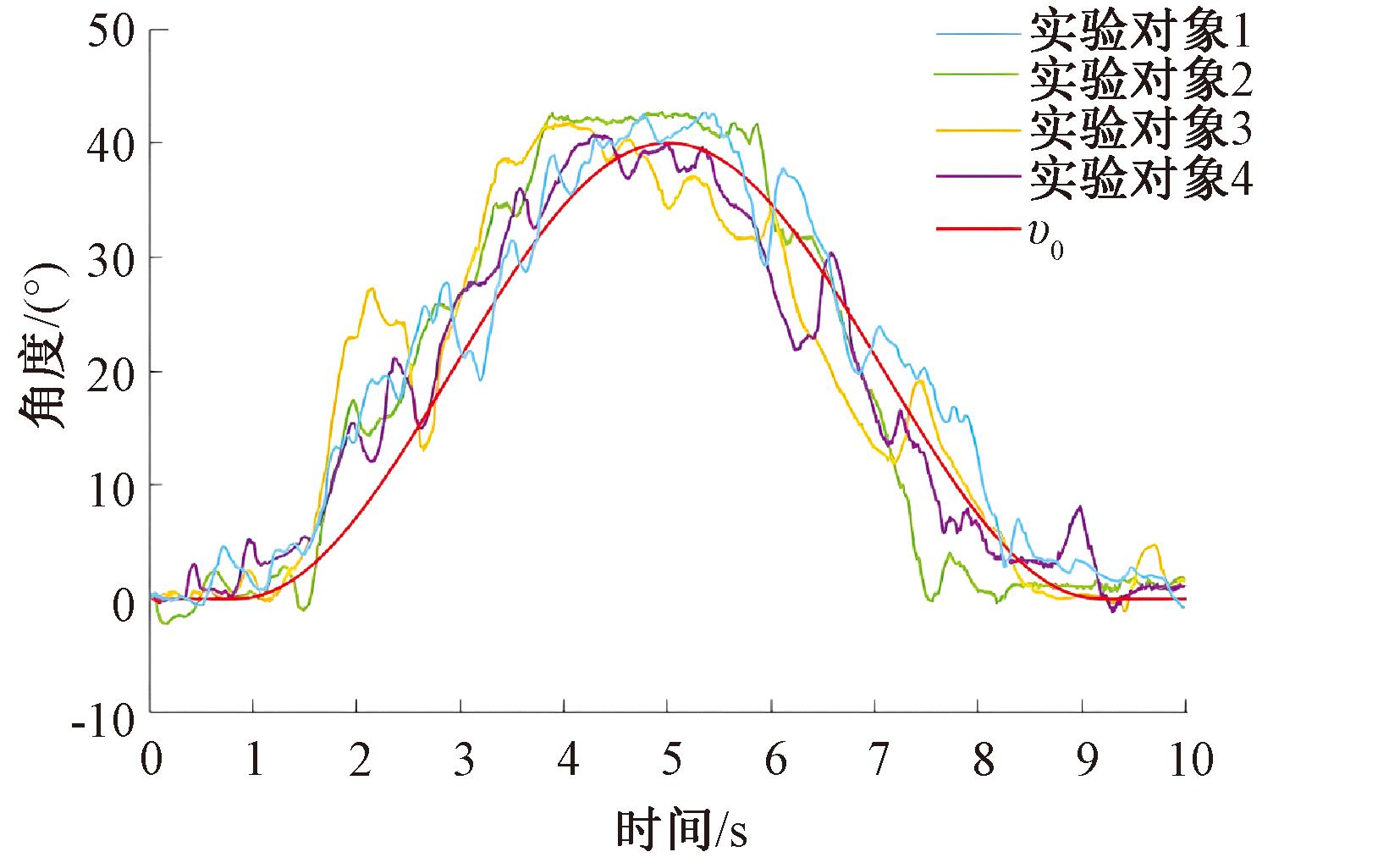
图11 基于ADRC的多电极协同控制实验结果
Figure 11 Results of multi-electrode collaborative control experiments based on ADRC
作为对比,本文设计了一组基于ADRC的固定电极角度跟踪控制实验,实验中使用了相同的电极阵列,统计了每名实验对象在所有角度区间内最常用的电极组合。用该组合进行后续ADRC角度跟踪实验,控制参数保持不变,以评估固定电极组合在角度跟踪控制中的效果,实验结果如图12所示。采用固定电极的角度跟踪虽然与期望信号的趋势走向相同,但存在明显的波动,这表明固定电极组合无法精确地匹配肌肉收缩产生的力量和速度需求,难以适应不同角度下肌肉收缩产生的力量变化,导致控制精度较低。
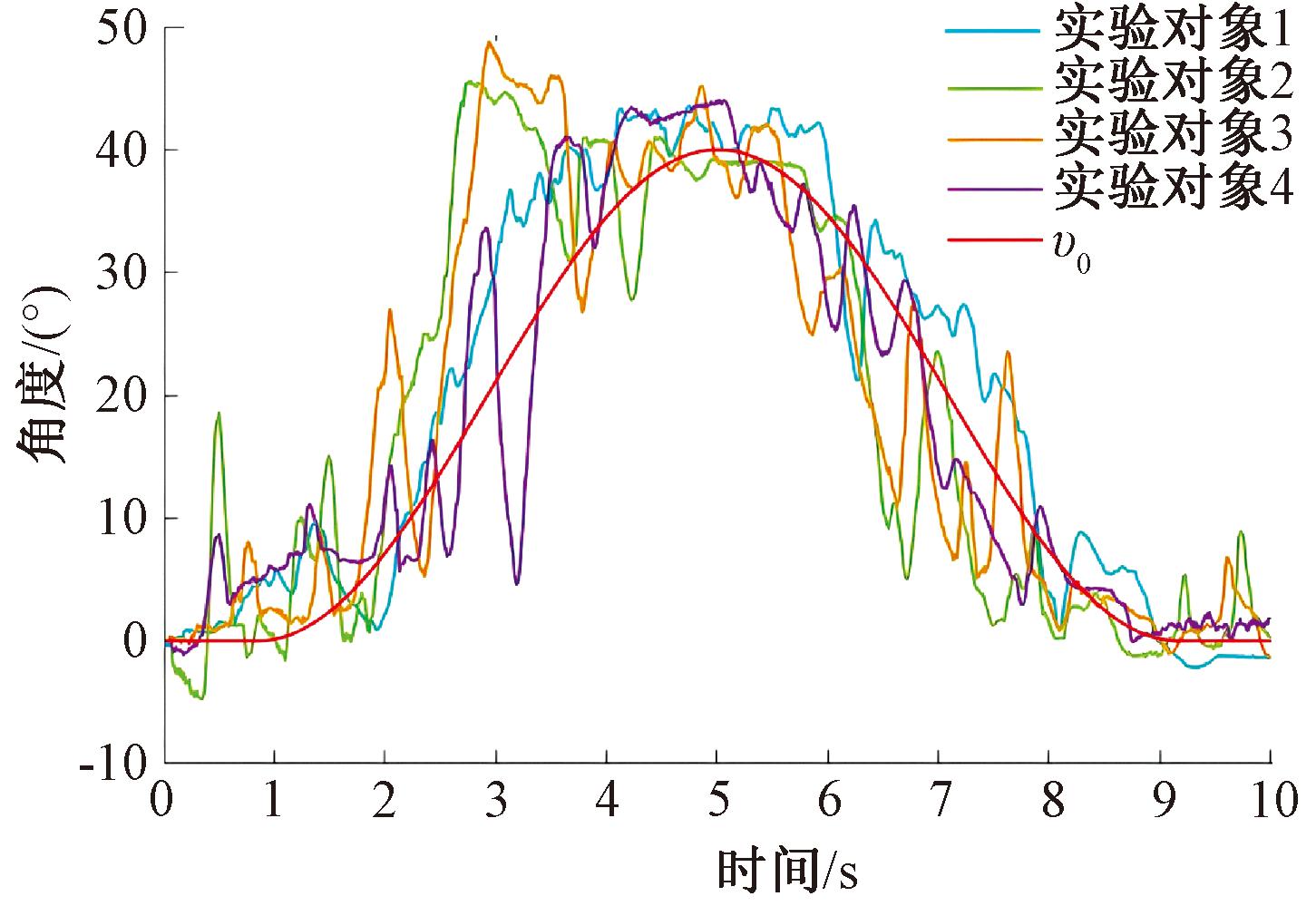
图12 基于ADRC的固定电极控制实验结果
Figure 12 Results of fixed electrode control experiments based on ADRC
为进一步直观地判断控制效果,用实际输出信号减去期望信号,获取每名实验对象的跟踪误差值的均值和方差。根据表2的数据,实验对象在采用电极切换策略时,跟踪误差显著低于使用固定电极时的水平,平均跟踪误差均值降低了50.41%,均方差降低了43.30%。
表2 4名实验对象不同控制策略下的跟踪误差统计值
Table 2 Tracking error statistics of 4 subjects in different control strategies
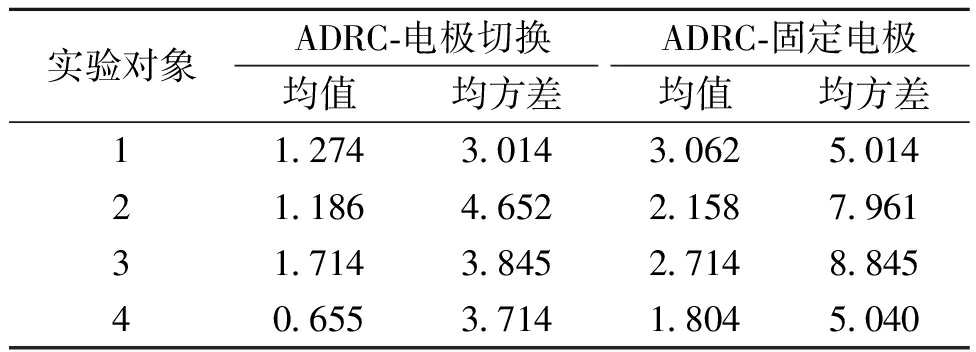
实验对象ADRC-电极切换ADRC-固定电极均值均方差均值均方差11.2743.0143.0625.01421.1864.6522.1587.96131.7143.8452.7148.84540.6553.7141.8045.040
为分析切换电极和固定电极对肌肉的影响,本文在每名实验对象完成两种控制策略的FES 10 min后,使用Delsys表面肌电采集系统采集实验对象做肘部屈伸时肱二头肌处的肌电信号。采集后对信号进行简要分析,图13为肌电信号采集实验示意图。如图13所示,将EMG采集器贴附在实验对象肱二头肌的中部,距离肘关节5 cm的位置,以捕捉肱二头肌的肌电信号。

图13 肌电信号采集实验示意图
Figure 13 Schematic diagram of the EMG signal acquisition experiment
实验对象2的结果如图14所示,相较于固定电极策略,切换电极策略的肌电信号波动更小、稳定性更高,这表明切换电极策略能够更有效地减少单一肌肉群的过度刺激,提升肌肉收缩的协调性和效率。
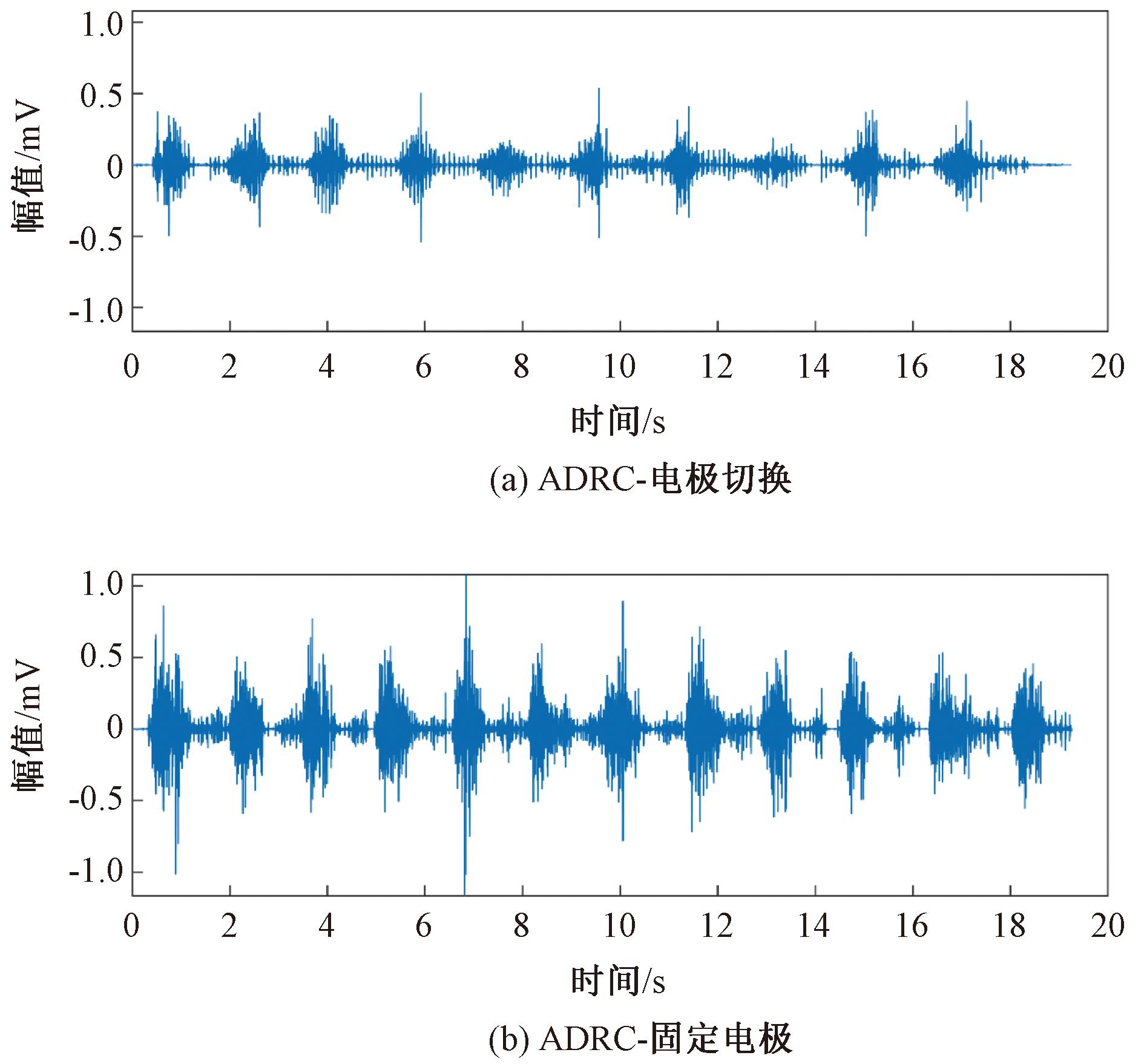
图14 实验对象2在不同控制策略下的肌电信号
Figure 14 EMG of subject 2 under different control strategies
表3为4名实验对象不同控制策略下的肌电信号的振幅平均绝对值MAV和中值频率MF,其公式如下所示:
(20)
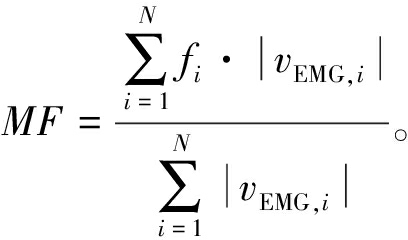
(21)
表3 4名实验对象在不同控制策略下的肌电信号统计值
Table 3 Statistical values of EMG of 4 subjects in different control strategies
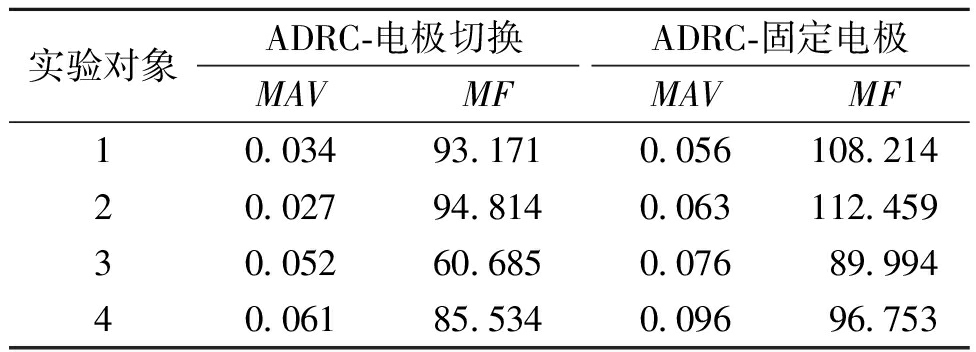
实验对象ADRC-电极切换ADRC-固定电极MAVMFMAVMF10.03493.1710.056108.21420.02794.8140.063112.45930.05260.6850.07689.99440.06185.5340.09696.753
式中:vEMG,i为第i时刻采集到的肌电信号。
MAV和MF是表征肌肉疲劳程度的重要指标。MAV反映了肌肉的整体激活水平,其值越大表明肌肉的激活程度越高。而MF则与肌肉纤维的疲劳程度相关,随着疲劳的增加,MF通常会上升[26]。
具体来看,实时根据运动角度切换刺激位置能够有效地抑制肌肉疲劳和不必要的激活,而固定电极由于无法动态调整刺激强度,导致肌肉在反复刺激下逐渐疲劳,从而增加了肌电信号的幅值和频率。表3为4名实验对象在不同控制策略下的肌电信号统计值。表3数据显示,与固定电极策略相比,本文方法的MAV值平均减少了40.21%,MF值减少了17.97%,表明电极切换策略在减少肌肉过度刺激和疲劳方面效果显著,为优化上肢功能性电刺激系统设计提供了有力的实证支持。
4 结论
针对目前FES控制策略存在的两大问题:一是在电刺激过程中传统的表面电极无法精确地跟踪肌肉收缩,难以确定合适的刺激位置;二是现有的控制方法容易受到内外扰动的影响,导致控制精度不佳。本文提出了一种基于ADRC的多电极协同上肢康复运动控制方法,主要包含以下结论。
(1)通过分析上肢的动力学模型提出了电极切换方法,利用电极阵列实现对肱二头肌的多点刺激,将加速度作为不同电极组合的刺激效果的评判标准,在角度跟踪过程中根据角度区间动态调整电极组合。
(2)优化ADRC控制量,大大增强了系统对内外扰动的适应性,通过实时估计和补偿系统的扰动,保证了系统的稳定性和控制精度。仿真结果验证了本文提出的控制器能够在上肢运动过程中实现高精度、高稳定性的角度跟踪,有效提高了系统的控制性能。
(3)搭建上肢功能性电刺激康复系统,对不同的实验对象在相同的ADRC控制参数下进行对比实验。实验结果表明,采用电极切换策略与采用固定电极策略相比,其系统输出的角度曲线与期望值高度吻合,没有出现过大的波动或振荡,平均跟踪误差降低了50.41%,均方根误差降低了43.30%。
(4)通过对实验对象肌电信号的分析发现,采用电极切换策略的肌电信号幅值和频率均较采用固定电极策略有所降低,有效减轻了单一肌肉群的过度疲劳。
这些实验结果验证了本文提出的控制方案在上肢康复训练中的潜力和优越性。这种动态调整策略不仅可以提升角度跟踪的准确性,还能够适应不同运动需求和个体差异,为康复治疗和运动控制领域带来新的应用前景。
未来工作将在本研究的基础上针对脑卒中患者开展临床实验,以直接评估本文提出的方法在康复中的有效性和适用性。此外,将进一步优化控制算法,通过结合机器学习和数据驱动的方法,提高其对复杂和动态环境的适应能力。
[1] FEIGIN V L, BRAININ M, NORRVING B, et al. World stroke organization (WSO): global stroke fact sheet 2022[J]. International Journal of Stroke, 2022, 17(1): 18-29.
[2] MARKUS H S, LEUNG T. Stroke in China[J]. International Journal of Stroke, SAGE Publications, 2023, 18(3): 256-258.
[3] LEE S H, KIM S S, LEE B H. Action observation training and brain-computer interface controlled functional electrical stimulation enhance upper extremity performance and cortical activation in patients with stroke: a randomized controlled trial[J]. Physiotherapy Theory and Practice, 2022, 38(9): 1126-1134.
[4] YAO M H, REN Y, JIA Y L, et al. Projected burden of stroke in China through 2050[J]. Chinese Medical Journal, 2023, 136(13): 1598-1605.
[5] DOUCET B M, LAM A, GRIFFIN L. Neuromuscular electrical stimulation for skeletal muscle function[J]. Yale Journal of Biology and Medicine, 2012, 85(2): 201-215.
[6] SHEFFLER L R, CHAE J. Neuromuscular electrical stimulation in neurorehabilitation[J]. Muscle &Nerve, 2007, 35(5): 562-590.
[7] ALON G, LEVITT A F, MCCARTHY P A. Functional electrical stimulation enhancement of upper extremity functional recovery during stroke rehabilitation: a pilot study[J]. Neurorehabilitation and Neural Repair, 2007, 21(3): 207-215.
[8] DOWNEY R J, BELLMAN M J, KAWAI H, et al. Comparing the induced muscle fatigue between asynchronous and synchronous electrical stimulation in able-bodied and spinal cord injured populations[J]. IEEE Transactions on Neural Systems and Rehabilitation Engineering, 2015, 23(6): 964-972.
[9] TRIOLO R J, LIU M Q, KOBETIC R, et al. Selectivity of intramuscular stimulating electrodes in the lower limbs[J]. Journal of Rehabilitation Research and Development, 2001, 38(5): 533-544.
[10] GOBBO M, GAFFURINI P, BISSOLOTTI L, et al. Transcutaneous neuromuscular electrical stimulation: influence of electrode positioning and stimulus amplitude settings on muscle response[J]. European Journal of Applied Physiology, 2011, 111(10): 2451-2459.
[11] IBITOYE M O, HAMZAID N A, HASNAN N, et al. Strategies for rapid muscle fatigue reduction during FES exercise in individuals with spinal cord injury: a systematic review[J]. PLoS One, 2016, 11(2): e0149024.
[12] GOBBO M, MAFFIULETTI N A, ORIZIO C, et al. Muscle motor point identification is essential for optimizing neuromuscular electrical stimulation use[EB/OL]. (2014-02-15)[2024-09-10].https:∥doi.org/10.1186/1743-0003-11-17.
[13] MOE J H, POST H W. Functional electrical stimulation for ambulation in hemiplegia[J]. The Journal-lancet, 1962, 82: 285-288.
[14] KRALJ A, BAJD T, TURK R. Enhancement of gait restoration in spinal injured patients by functional electrical stimulation[J]. Clinical Orthopaedics and Related Research, 1988(233): 34-43.
[15] PECKHAM P H, KNUTSON J S. Functional electrical stimulation for neuromuscular applications[J]. Annual Review of Biomedical Engineering, 2005, 7: 327-360.
[16] ALLEN B C, STUBBS K J, DIXON W E. Adaptive trajectory tracking during motorized and FES-induced biceps curls via integral concurrent learning[EB/OL].(2020-10-05)[2024-09-10].https:∥doi.org/10.1115/DSCC2020-3125.
[17] CAMILO E M, GUTIÉRREZ J A M, RAM REZ O P, et al. A functional electrical stimulation controller for contralateral hand movements based on EMG signals[C]∥The 17th International Conference on Electrical Engineering, Computing Science and Automatic Control (CCE). Piscataway: IEEE, 2020: 1-6.
REZ O P, et al. A functional electrical stimulation controller for contralateral hand movements based on EMG signals[C]∥The 17th International Conference on Electrical Engineering, Computing Science and Automatic Control (CCE). Piscataway: IEEE, 2020: 1-6.
[18] ZHANG J M, ZHANG L, GUO S C, et al. Iterative learning control of functional electrical stimulation based on joint muscle model[C]∥Proceedings of the 3rd International Conference on Computational Intelligence and Intelligent Systems. New York: ACM, 2020: 119-123.
[19] ARROFIQI F, WATANABE T, ARIFIN A. A computer simulation study on movement control by functional electrical stimulation using optimal control technique with simplified parameter estimation[J]. IEICE Transactions on Information and Systems, 2023, E106.D(5): 1059-1068.
[20] LUM P S, BURGAR C G, SHOR P C. Evidence for improved muscle activation patterns after retraining of reaching movements with the MIME robotic system in subjects with post-stroke hemiparesis[J]. IEEE Transactions on Neural Systems and Rehabilitation Engineering, 2004, 12(2): 186-194.
[21] YU B B, ZHANG X T, CHENG Y H, et al. The effects of the biceps brachii and brachioradialis on elbow flexor muscle strength and spasticity in stroke patients[J]. Neural Plasticity, 2022, 2022(1): 1295908.
[22] CHADWICK E K, BLANA D, VAN DEN BOGERT A J T, et al. A real-time, 3-D musculoskeletal model for dynamic simulation of arm movements[J]. IEEE Transactions on Bio-Medical Engineering, 2009, 56(4): 941-948.
[23] ZHANG D G, GUAN T H, WIDJAJA F, et al. Functional electrical stimulation in rehabilitation engineering: a survey[C]∥Proceedings of the 1st International Convention on Rehabilitation Engineering &Assistive Technology: in Conjunction with 1st Tan Tock Seng Hospital Neurorehabilitation Meeting. NewYork: ACM, 2007: 221-226.
[24] FREEMAN C T. Upper limb electrical stimulation using input-output linearization and iterative learning control[J]. IEEE Transactions on Control Systems Technology, 2015, 23(4): 1546-1554.
[25] 韩京清. 从PID技术到“自抗扰控制” 技术[J]. 控制工程, 2002, 9(3): 13-18.HAN J Q. From PID technique to active disturbances rejection control technique[J]. Basic Automation, 2002, 9(3): 13-18.
[26] CIFREK M, MEDVED V, ![]() S, et al. Surface EMG based muscle fatigue evaluation in biomechanics[J]. Clinical Biomechanics, 2009, 24(4): 327-340.
S, et al. Surface EMG based muscle fatigue evaluation in biomechanics[J]. Clinical Biomechanics, 2009, 24(4): 327-340.