内分泌干扰物(endocrine disrupting chemicals,EDCs)是一种可对生物体内分泌系统产生不可逆伤害的外源性化合物,在生产和使用过程中产生大量的含EDCs废水。EDCs具有来源多、分布广、不易降解、生物累积和毒性潜伏期较长等特点,对生态平衡和人类健康造成严重的威胁。4,4′-硫代二苯酚(TDP)和双酚F(BPF)是典型的EDCs,两者的分子结构相似,TDP的雌激素活性较高,对生物体造成严重的负面影响;BPF不仅能够通过促进氧化应激来造成细胞毒性和功能障碍,还能导致DNA和染色体畸变。低浓度下的EDCs也会对生物体产生危害,所以急需寻找一条高效处理EDCs废水的方法。目前,EDCs废水处理方法主要包括生物法[1]、膜分离技术[2]、氧化法[3]和吸附法[4]等,其中吸附法因去除率高、成本低、简单高效、选择性好,是处理EDCs废水的理想方法之一。
黏土、沸石、石墨烯、金属有机骨架、碳纳米管等已用于处理EDCs废水的吸附剂[5]。在吸附过程中,吸附剂是影响吸附效率和处理成本的主要因素。由于大多数处理EDCs废水的吸附剂存在吸附容量较低、回收困难等问题,所以急需寻找一种高效吸附剂。活性炭因其具有丰富的孔隙结构和官能团在废水处理中得到了广泛的关注。活性炭的生产原料主要是煤炭和石油焦等。由于煤炭等的不可再生性,所以急需寻找可再生原料制备活性炭[6]。生物质具有来源广、廉价、可再生等特点,可作为制备活性炭的原料。糠醛渣(FR)是糠醛生产过程中的副产物,其含碳量较高,可以用于制备活性炭。本文以工业固废物FR为原料,采用水蒸气活化法制备糠醛渣活性炭(FRAC),并用于处理含4,4′-硫代二苯酚和双酚F的双酚类内分泌干扰物废水。利用工业废弃物糠醛渣为原料制备活性炭,既找到了新的活性炭生产原料,也对糠醛渣进行了资源化利用,同时达到了以废治废的目的,为EDCs废水的处理提供新方法。
1 实验
1.1 试剂与仪器
糠醛渣(FR)取自山东省巨野鲁源两糠生化有限公司;4,4′-硫代二苯酚(TDP)和双酚F(BPF)购于上海阿拉丁生化科技股份有限公司;乙醇、盐酸、氢氧化钠均为分析纯。
AL-204型电子分析天平;PHS-3C型精密酸度计;CF080-S型电热鼓风干燥箱;ZWY-240型恒温振荡器;TU-1810型紫外可见分光光度计;JW-BK132F型比表面积及孔径分析仪;AXIS Supra X射线光电子能谱;PerkinElmer Spectrum Tow 傅里叶变换红外光谱。
1.2 糠醛渣活性炭的制备
将一定量糠醛渣装入干馏釜内,在723 K缺氧条件下碳化60 min,然后冷却至室温,得到炭质前驱体。
将5 g炭质前驱体放入立式管式炉内,在N2的保护下以283 K/min速率程序升温至1 195 K,然后将N2切换为过热水蒸气对炭质前驱体活化62 min后停止加热,并在N2氛围下冷却至室温,得到的产物即为糠醛渣活性炭。利用比表面积分析仪测得FRAC比表面积为1 662.41 cm2/g,平均孔径为2.89 nm[7]。
1.3 实验方法
将一定剂量的FRAC和一定浓度的TDP或BPF溶液50 mL放入一系列100 mL锥形瓶中,密封瓶口,在恒温震荡箱中以150 r/min的速率震荡吸附一定时间,吸附结束后用0.45 μm微孔膜过滤得到滤液,并在最大吸收波长248 nm或227 nm下使用紫外可见分光光度计分别测定TDP或BPF溶液的吸光度,通过标准曲线计算剩余的TDP或BPF浓度。所有吸附实验均重复进行以保证其重现性。FRAC对TDP或BPF的吸附量qe(mmol/g)和去除率R通过式(1)和(2)计算得到:
(1)
(2)
式中:C0为TDP或BPF溶液的初始浓度,mmol/L;Ce为吸附平衡时TDP或BPF的浓度,mmol/L;V为TDP或BPF溶液的体积,L;m为FRAC的质量,g。
2 结果与讨论
2.1 吸附时间对吸附过程的影响
选择TDP或BPF溶液初始浓度0.2 mmol/L,FRAC用量0.1 g/L,选用TDP原溶液pH值5.61,BPF原溶液pH值5.53,在298 K下探究吸附时间对TDP或BPF吸附的影响,如图1所示。从图1可以看出,FRAC对TDP和BPF的吸附量在前60 min内迅速增加。随着溶液中TDP和BPF浓度的减小以及FRAC表面吸附位点的减少,FRAC对TDP和BPF的吸附量缓慢增加,直至达到吸附平衡。FRAC对TDP和BPF的吸附平衡时间分别为180 min和240 min。
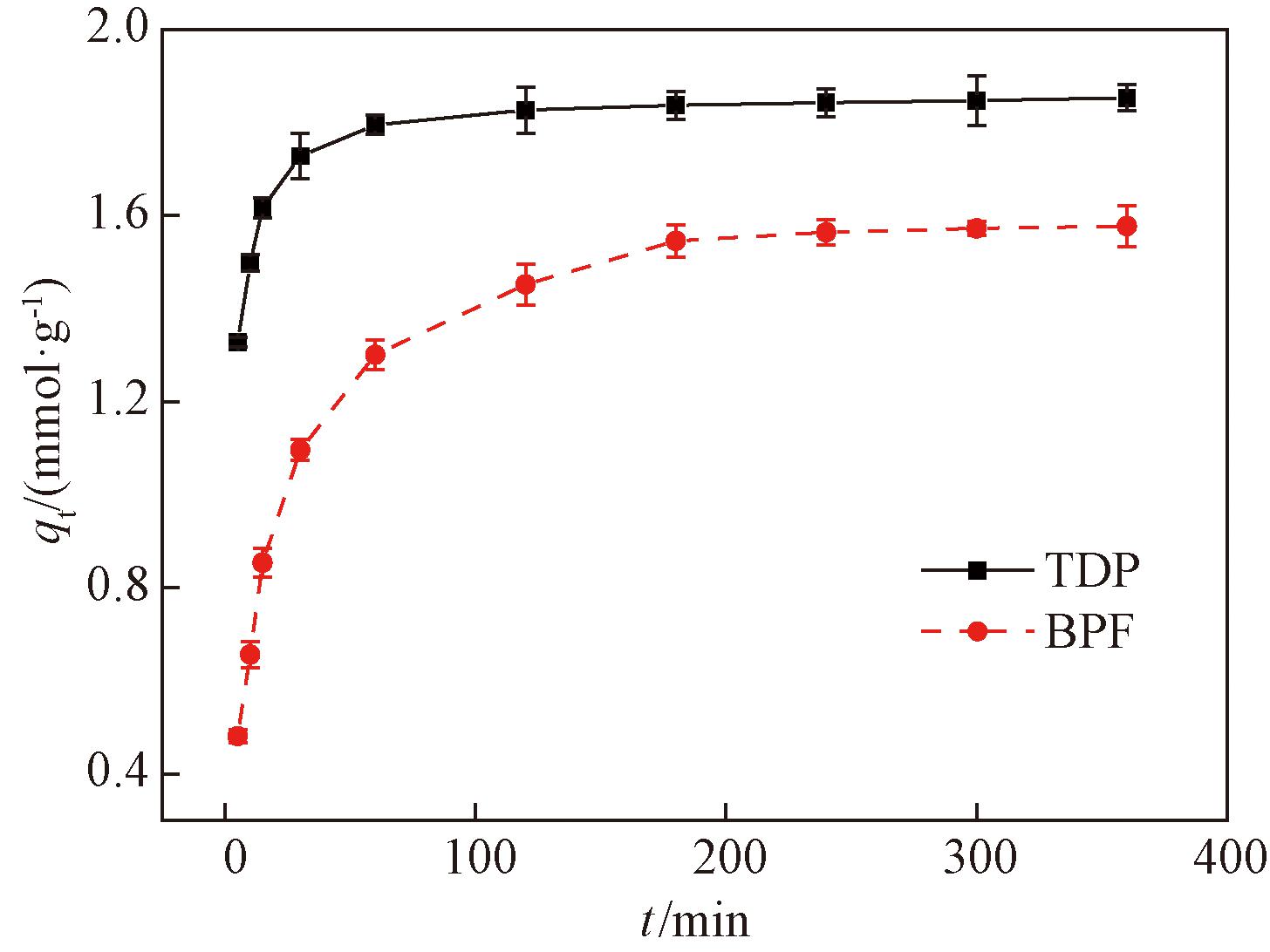
图1 吸附时间对TDP和BPF吸附的影响
Figure 1 Effect of time on the adsorption of TDP and BPF
2.2 吸附剂用量对吸附过程的影响
选择TDP或BPF溶液初始浓度为0.2 mmol/L,吸附平衡时间分别为180 min和240 min,选用TDP和BPF溶液的pH值分别为5.61和5.53,在298 K下探究吸附剂用量对FRAC吸附TDP或BPF的影响,结果如图2所示。从图2可以看出,随着吸附剂用量的增加,由于FRAC之间的竞争吸附导致FRAC吸附TDP或BPF的单位质量吸附量逐渐减小,但去除率逐渐增大。综合考虑吸附量和去除率,后续实验FRAC用量均为0.1 g/L。
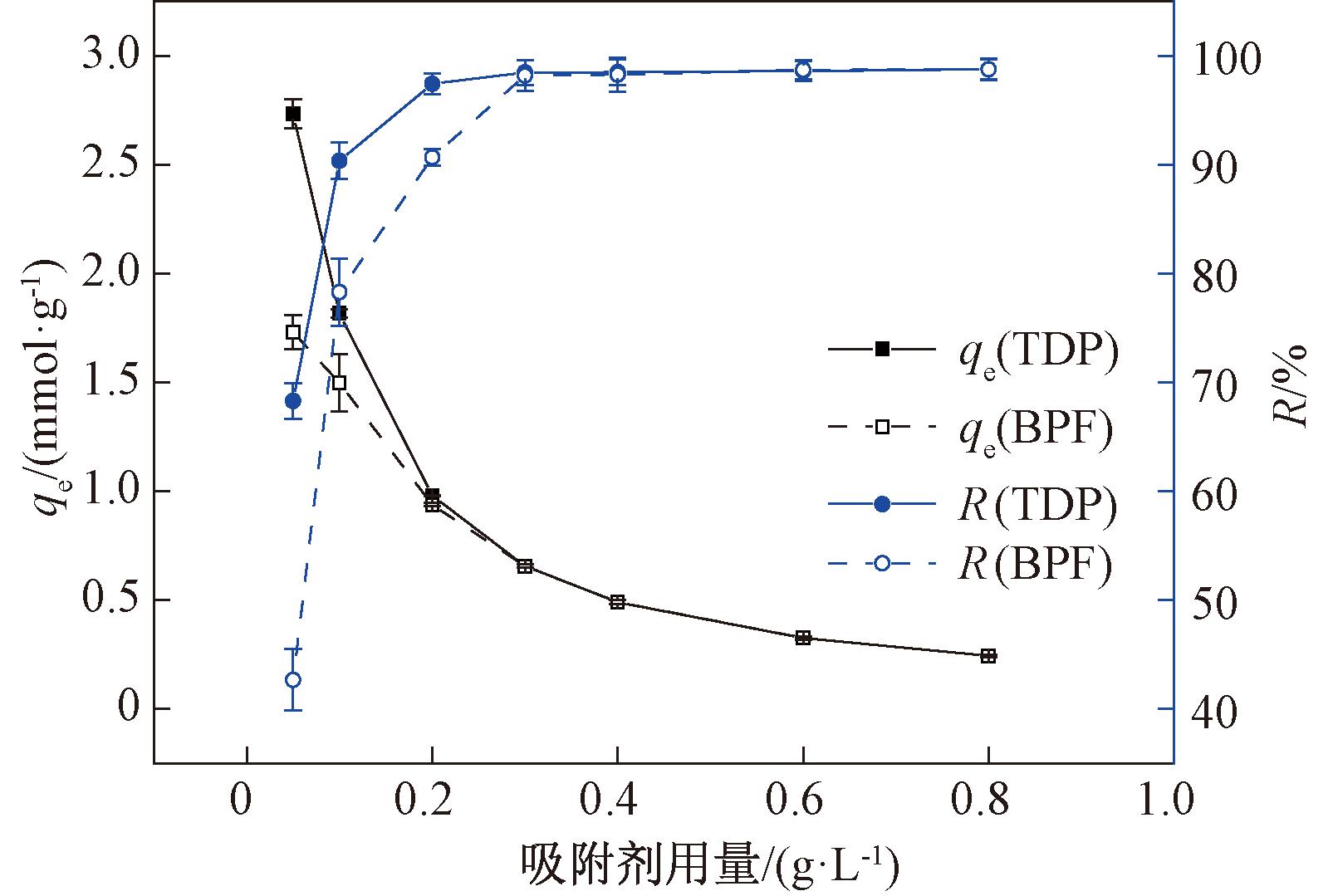
图2 FRAC用量对TDP和BPF吸附的影响
Figure 2 Effect of FRAC dosage on the adsorption of TDP and BPF
2.3 吸附等温线
为了进一步研究FRAC与TDP或BPF之间的吸附作用机理,采用Langmuir、Freundlich、Sips和Koble-Corrigan等温模型(式(3)~(6))[8]对实验数据进行非线性拟合分析,模型预测值与实验值之间的偏离程度用非线性χ2(式(7))检验。
Langmuir等温模型:
(3)
Freundlich等温模型:
qe=KFCe1/n。
(4)
Sips等温模型:
(5)
Koble-Corrigan等温模型:
(6)
(7)
式中:qe和qm分别为吸附剂FRAC的平衡吸附量和最大单分子层吸附量,mmol/g;Ce为TDP或BPF的平衡浓度,mmol/L;KL为Langmuir模型常数,L/mmol;KF为Freundlich模型常数,(mmol/g)·(L/mmol)1/n;qms为饱和吸附容量,mmol/g;Ks为Sips模型常数,L/mmol;m为Sips模型常数;Ak、Bk和M均为K-C模型参数;qe,exp和qe,cal分别表示平衡吸附量的实际值和模型预测值,mmol/g。
分别取50 mL不同初始浓度的TDP或BPF溶液置于一系列100 mL锥形瓶中,FRAC用量为0.1 g/L,TDP和BPF的吸附平衡时间分别为180 min和240 min,TDP和BPF的pH值分别选用5.61和5.53,在不同温度下震荡吸附探究TDP或BPF初始浓度对吸附的影响,并按式(3)~(6)对实验数据进行非线性拟合分析,结果见图3和表1。
表1 FRAC吸附TDP和BPF的等温线参数
Table 1 Parameters of isotherm for TDP and BPF onto FRAC
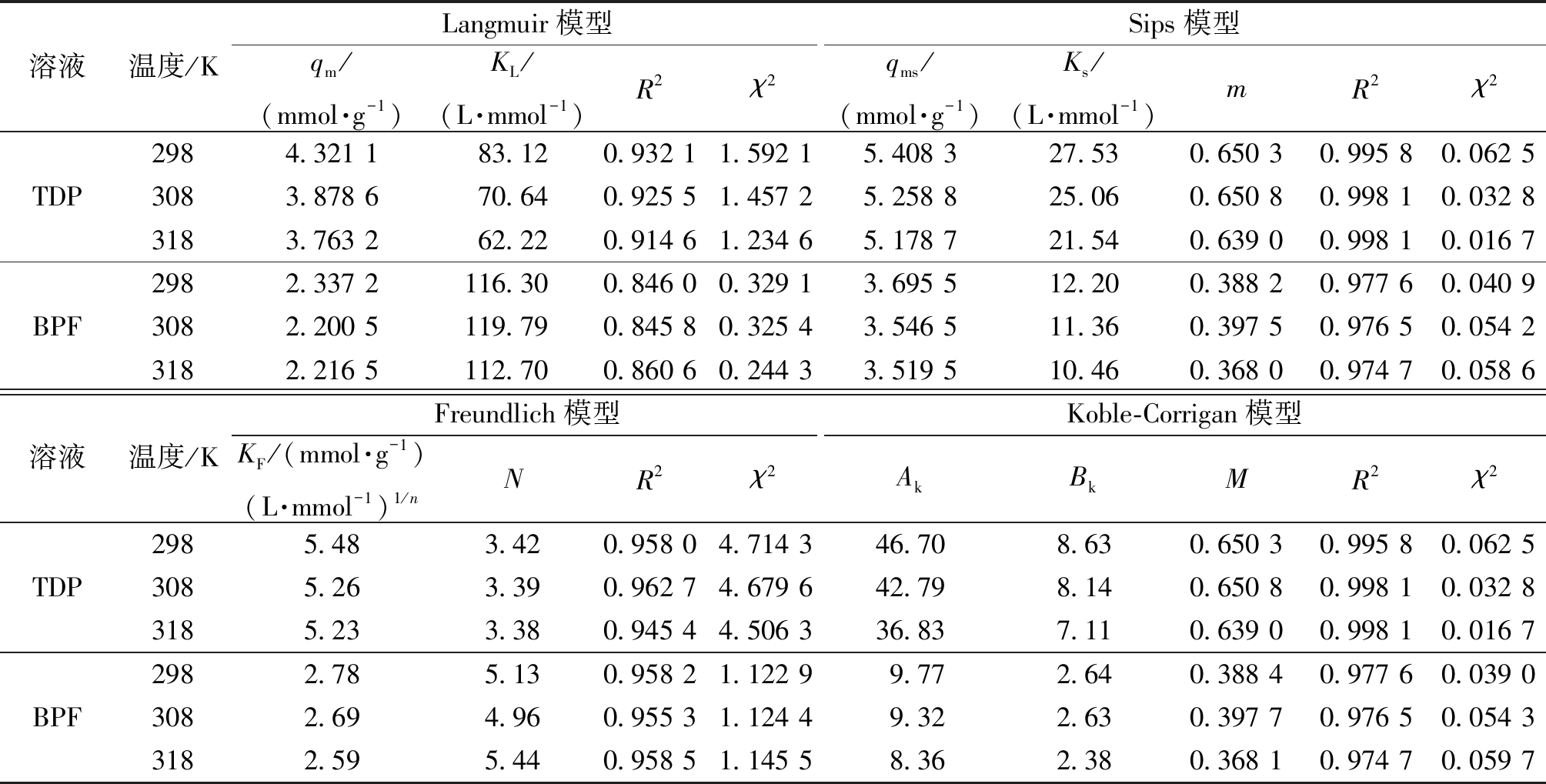
溶液温度/KLangmuir模型Sips模型qm/(mmol·g-1)KL/(L·mmol-1)R2χ2qms/(mmol·g-1)Ks/(L·mmol-1)mR2χ2TDPBPF2984.321 183.120.932 11.592 15.408 327.530.650 30.995 80.062 53083.878 670.640.925 51.457 25.258 825.060.650 80.998 10.032 83183.763 262.220.914 61.234 65.178 721.540.639 00.998 10.016 72982.337 2116.300.846 00.329 13.695 512.200.388 20.977 60.040 93082.200 5119.790.845 80.325 43.546 511.360.397 50.976 50.054 23182.216 5112.700.860 60.244 33.519 510.460.368 00.974 70.058 6溶液温度/KFreundlich模型Koble-Corrigan模型KF/(mmol·g-1)(L·mmol-1)1/nNR2χ2AkBkMR2χ2TDPBPF2985.483.420.958 04.714 346.708.630.650 30.995 80.062 53085.263.390.962 74.679 642.798.140.650 80.998 10.032 83185.233.380.945 44.506 336.837.110.639 00.998 10.016 72982.785.130.958 21.122 99.772.640.388 40.977 60.039 03082.694.960.955 31.124 49.322.630.397 70.976 50.054 33182.595.440.958 51.145 58.362.380.368 10.974 70.059 7
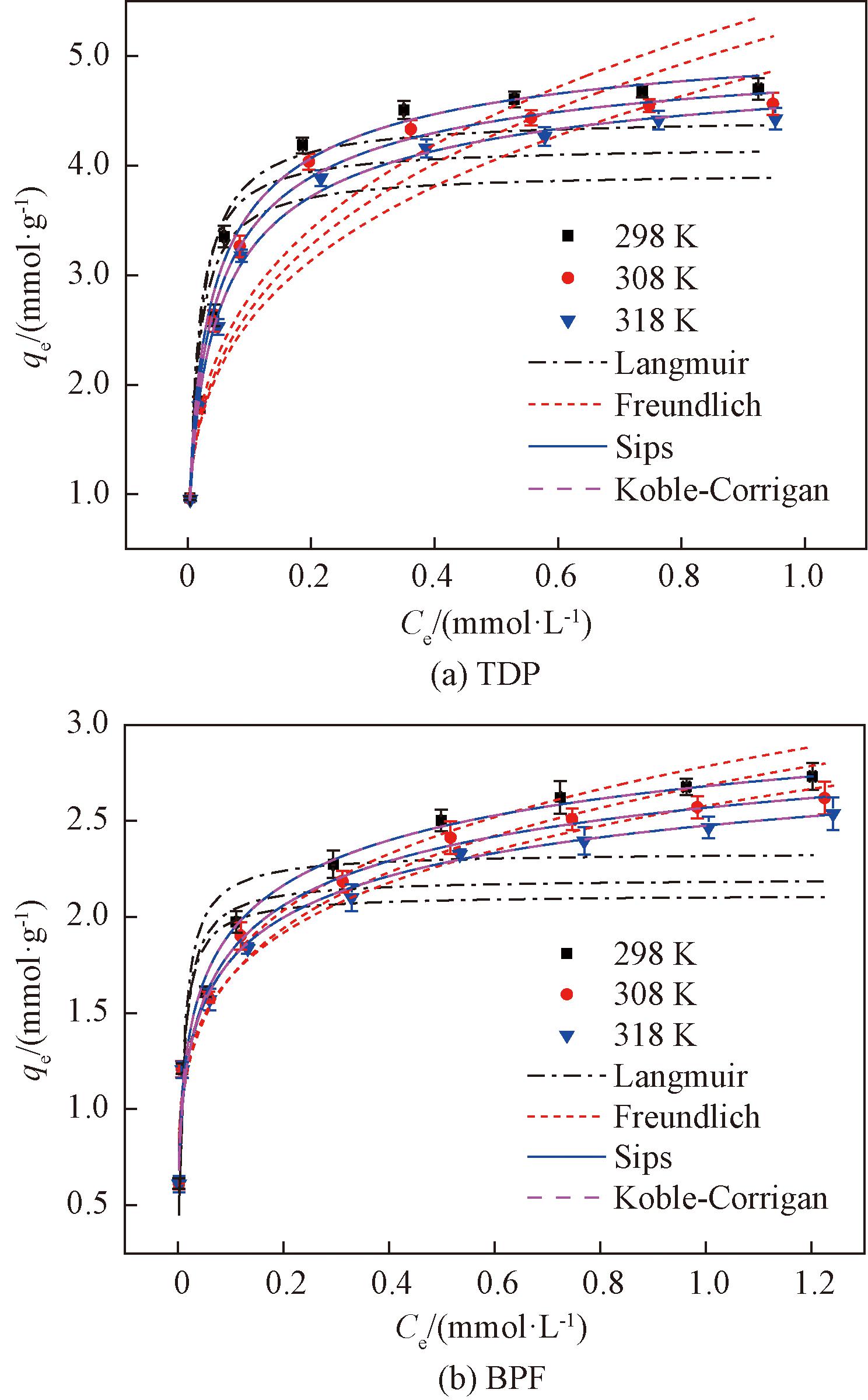
图3 FRAC吸附TDP和BPF的等温线模型拟合曲线图
Figure 3 Isotherm model curves for the adsorption of TDP and BPF onto FRAC
由图3(a)和表1可知,在FRAC吸附TDP的过程中,Sips模型和Koble-Corrigan模型在3个温度下的相关系数R2>0.99,χ2<0.06,表明Sips和Koble-Corrigan模型可以很好地描述FRAC对TDP的吸附过程。Sips模型中参数qms和Ks均随着温度的升高而减小,表明低温有利于吸附过程,温度298 K时,FRAC对TDP的最大饱和吸附量为5.408 3 mmol/g。Langmuir模型和Freundlich模型的相关系数R2均较小、 χ2均较大,表明Langmuir和Freundlich模型不能很好地描述TDP在FRAC上的吸附行为。
由图3(b)和表1可知,FRAC吸附BPF时,Sips模型和Koble-Corrigan模型在3个温度下的R2>0.97,χ2<0.06,表明Sips和Koble-Corrigan模型同样可以很好地描述FRAC对BPF的吸附过程。在温度为298 K时,FRAC对BPF的最大饱和吸附量为3.695 5 mmol/g。由于模型相关系数R2均较小,χ2较大,说明BPF在FRAC上的吸附行为不符合Langmuir和Freundlich等温模型。
热力学参数吉布斯自由能ΔG(kJ/mol)、焓变ΔH(kJ/mol)和熵变ΔS(kJ/(mol·K))通过式(8)、(9)和(10)计算[8]:
(8)
ΔG=-RTln Kp;
(9)
(10)
式中:Cad和Ce分别为吸附平衡时TDP或BPF在吸附剂和溶液中的剩余浓度,mmol/L;Kp为吸附平衡常数,通过ln(Cad/Ce) 对Cad作图,将Cad外推至0时得到;R=8.314 J/(mol·K),为通用气体常数;T为温度,K。
计算得到的热力学参数见表2。由表2可知,在298、308、318 K温度下,FRAC吸附TDP或BPF的ΔG均为负值,表明FRAC对TDP或BPF的吸附是自发进行的。FRAC吸附二者的ΔH和ΔS均小于0,说明FRAC对TDP或BPF的吸附过程均是放热的熵减过程。
表2 FRAC吸附TDP和BPF的热力学参数
Table 2 Thermodynamic parameters of the adsorption of TDP and BPF onto FRAC

吸附质ΔH/(kJ·mol-1)ΔS/(kJ·(mol·K)-1)ΔG/(kJ·mol-1)298 K308 K318 KTDP-32.88-72.50-11.31-10.47-9.86BPF-29.04-44.50-15.73-15.44-14.84
2.4 吸附动力学
选择吸附剂FRAC用量0.1 g/L,TDP或BPF溶液初始浓度为0.2 mmol/L,TDP和BPF的pH值分别选用5.61和5.53,探究FRAC对TDP或BPF的吸附量随温度和时间的变化规律。采用准一级动力学、准二级动力学、Elovich和颗粒内扩散模型(式(11)~(14))[8]对实验数据进行拟合分析:
准一级动力学模型:
qt=qe(1-e-k1t)。
(11)
准二级动力学模型:
(12)
Elovich模型:
(13)
颗粒内扩散模型:
qt=ktit1/2+Ci。
(14)
式中:qe和qt分别为吸附平衡和t时刻的吸附量,mmol/g;k1为准一级动力学模型的速率常数,1/min;k2为准二级动力学模型的速率常数,g/(mmol·min);α和β均为Elovich常数,mmol/(g·min)和g/mmol;kti为颗粒内扩散模型的速率常数,mmol/(g·min1/2);Ci为与边界层厚度有关的常数。
对实验数据按式(11)~(14)进行非线性拟合分析的结果见图4和表3。由图4可知,FRAC对TDP或BPF的吸附量均随着吸附时间的延长先迅速增加,然后缓慢增加,最后达到吸附平衡。
表3 FRAC吸附TDP和BPF的动力学模型参数
Table 3 Parameters of kinetic models for TDP and BPF onto FRAC
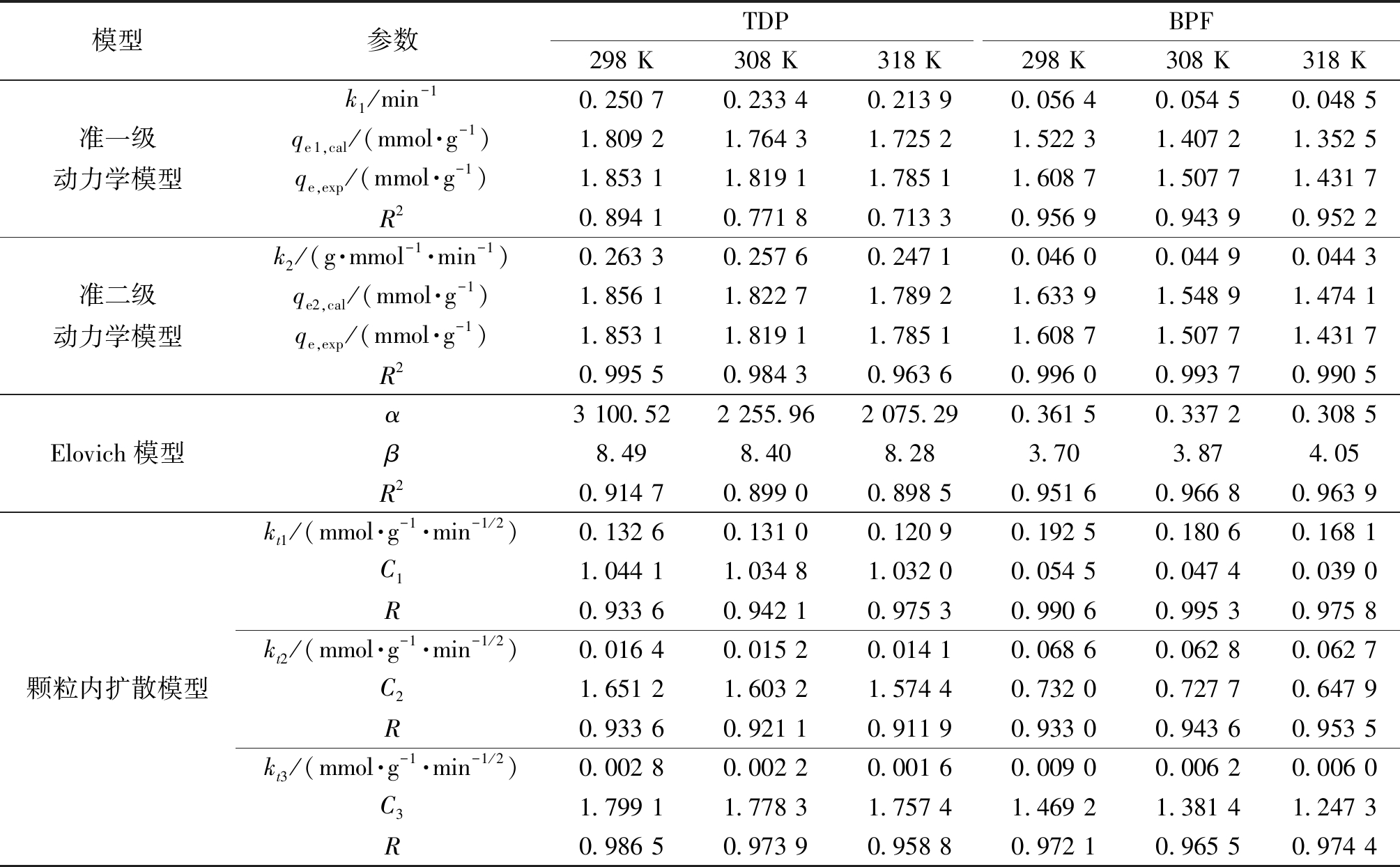
模型参数TDPBPF298 K308 K318 K298 K308 K318 K准一级动力学模型k1/min-10.250 70.233 40.213 90.056 40.054 50.048 5qe1,cal/(mmol·g-1)1.809 21.764 31.725 21.522 31.407 21.352 5qe,exp/(mmol·g-1)1.853 11.819 11.785 11.608 71.507 71.431 7R20.894 10.771 80.713 30.956 90.943 90.952 2准二级动力学模型k2/(g·mmol-1·min-1)0.263 30.257 60.247 10.046 00.044 90.044 3qe2,cal/(mmol·g-1)1.856 11.822 71.789 21.633 91.548 91.474 1qe,exp/(mmol·g-1)1.853 11.819 11.785 11.608 71.507 71.431 7R20.995 50.984 30.963 60.996 00.993 70.990 5Elovich模型α3 100.522 255.962 075.290.361 50.337 20.308 5β8.498.408.283.703.874.05R20.914 70.899 00.898 50.951 60.966 80.963 9颗粒内扩散模型kt1/(mmol·g-1·min-1/2)0.132 60.131 00.120 90.192 50.180 60.168 1C11.044 11.034 81.032 00.054 50.047 40.039 0R0.933 60.942 10.975 30.990 60.995 30.975 8kt2/(mmol·g-1·min-1/2)0.016 40.015 20.014 10.068 60.062 80.062 7C21.651 21.603 21.574 40.732 00.727 70.647 9R0.933 60.921 10.911 90.933 00.943 60.953 5kt3/(mmol·g-1·min-1/2)0.002 80.002 20.001 60.009 00.006 20.006 0C31.799 11.778 31.757 41.469 21.381 41.247 3R0.986 50.973 90.958 80.972 10.965 50.974 4
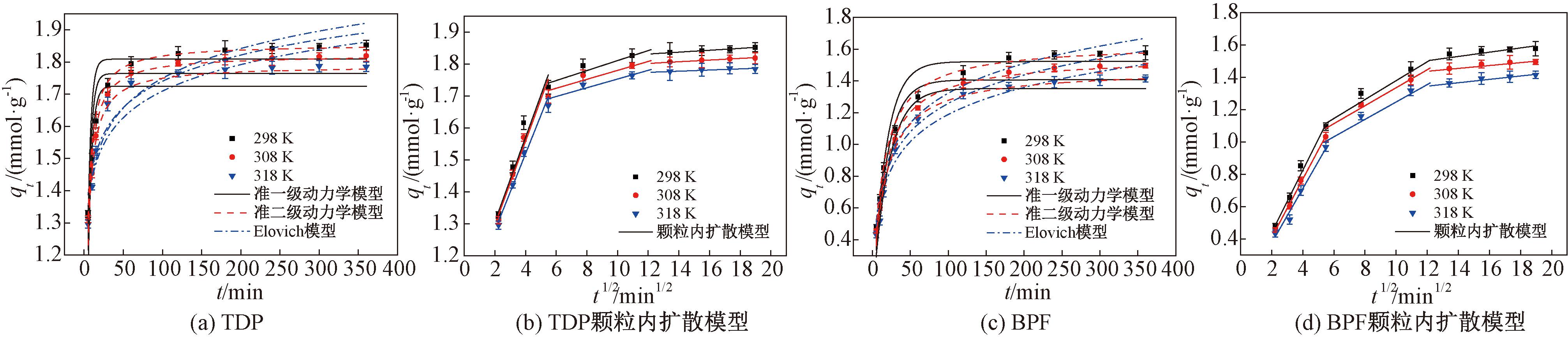
图4 FRAC吸附TDP和BPF的动力学模型拟合曲线图
Figure 4 Kinetic model curves for the adsorption of TDP and BPF onto FRAC
由表3可知,对于FRAC吸附TDP和BPF的过程,准二级动力学模型在3个温度下的相关系数R2均大于0.96,吸附速率常数k2随温度的升高而降低,表明低温有利于吸附,并且qe2,cal值与qe,exp值相近,说明准二级动力学模型能很好地描述FRAC对TDP和BPF的吸附过程。准一级动力学模型以及Elovich模型的相关系数R2均较低,说明不适用于描述FRAC对TDP和BPF的吸附过程。
从图4(b)和图4(d)可以看出,FRAC对TDP和BPF的吸附过程均可以分为3个阶段:①膜扩散阶段,TDP或BPF分子从溶液快速扩散到FRAC边界层;②颗粒内扩散阶段,TDP或BPF分子由边界层扩散至FRAC内部孔隙结构中;③吸附平衡阶段。在相同温度下,FRAC吸附TDP或BPF的吸附速率常数kt1>kt2>kt3,而常数C1<C2<C3。此外,所有的拟合曲线均没有经过原点,表明颗粒内扩散并不是FRAC吸附TDP或BPF过程中唯一的速率控制步骤,膜扩散对吸附也产生了影响。
2.5 红外光谱分析
采用KBr压片法对FRAC吸附TDP和BPF前后的FT-IR进行测定,如图5所示。由图5可知,在3 447 cm-1处宽带吸收归因于FRAC的—OH伸缩振动或所吸附的水[9]。在2 924和2 853 cm-1处的特征峰分别为甲基和亚甲基的C—H拉伸和弯曲振动[10]。在1 632 cm-1处的特征峰可能归因于C![]() O的伸缩振动[11]。在1 384 cm-1处的伸缩振动与—CH3有关[12]。在1 118 cm-1处的吸收带是由C—O伸缩振动所致。
O的伸缩振动[11]。在1 384 cm-1处的伸缩振动与—CH3有关[12]。在1 118 cm-1处的吸收带是由C—O伸缩振动所致。
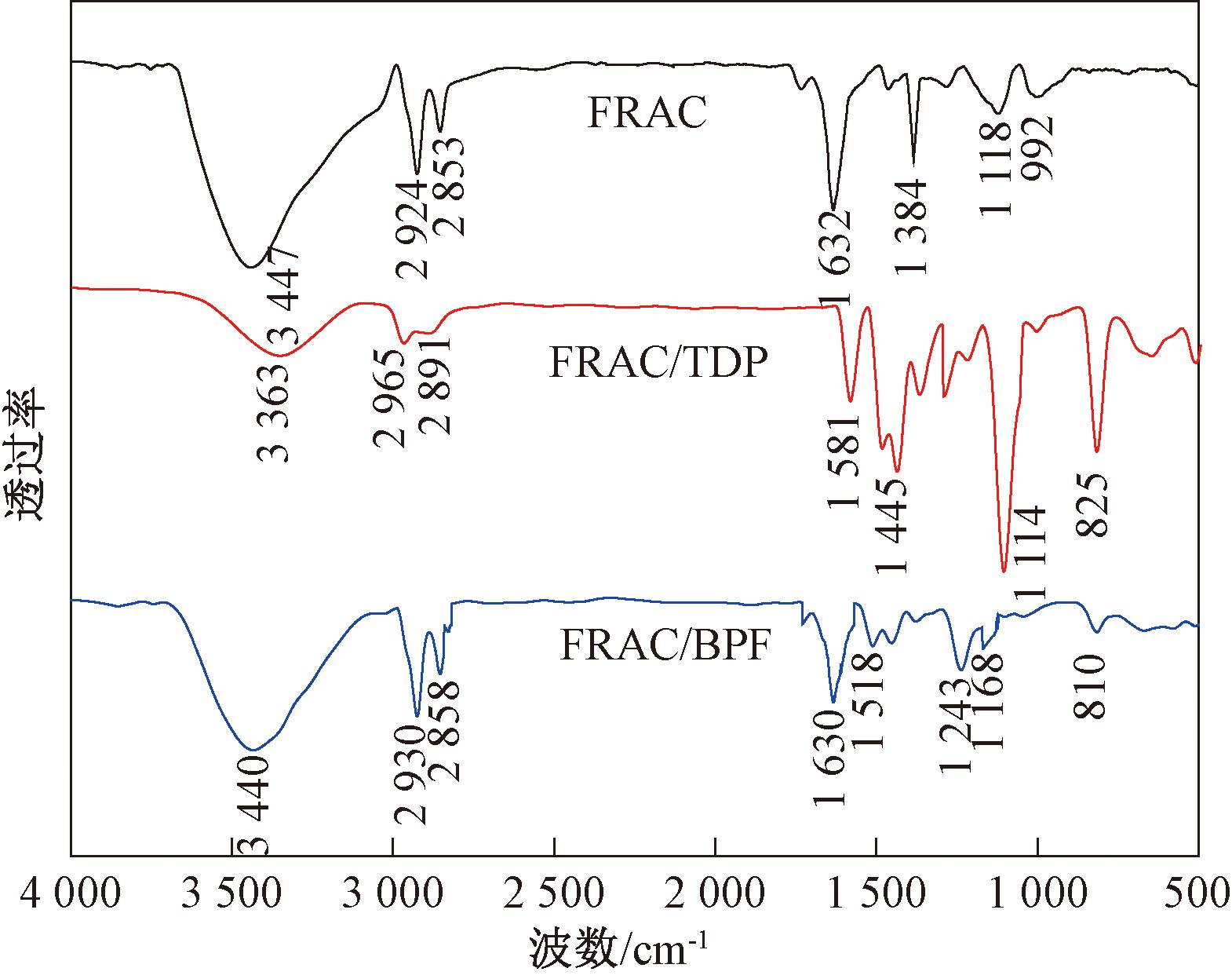
图5 FRAC吸附TDP和BPF前后的红外光谱图
Figure 5 FT-IR spectra of FRAC before and after adsorption of TDP and BPF
从FRAC吸附TDP和BPF前后的FT-IR图可以看出,有些吸收峰的位置和强度发生了变化,并出现了新峰。FRAC吸附TDP后,1 445 cm-1以及825 cm-1处出现的吸收峰分别是TDP上苯环的C![]() C键伸缩振动和TDP上苯环的C—H面外弯曲振动所导致的。由于TDP的C—S—C基团使1 114 cm-1处特征峰[13]强度明显增加,均证明了TDP成功吸附在FRAC的表面上。
C键伸缩振动和TDP上苯环的C—H面外弯曲振动所导致的。由于TDP的C—S—C基团使1 114 cm-1处特征峰[13]强度明显增加,均证明了TDP成功吸附在FRAC的表面上。
FRAC吸附BPF后,在1 518 cm-1和810 cm-1处出现新的特征峰,分别是由BPF上苯环的碳骨架C![]() C以及苯环的C—H面外弯曲振动所导致的,表明BPF成功吸附在FRAC上。
C以及苯环的C—H面外弯曲振动所导致的,表明BPF成功吸附在FRAC上。
2.6 X射线光电子能谱分析
FRAC吸附TDP或BPF前后的全谱图、C1s谱图以及O1s谱图如图6所示。从图6(a)中可以看出,FRAC吸附TDP或BPF前后的C元素和O元素的含量发生了变化,表明TDP或BPF成功吸附在FRAC的表面上。
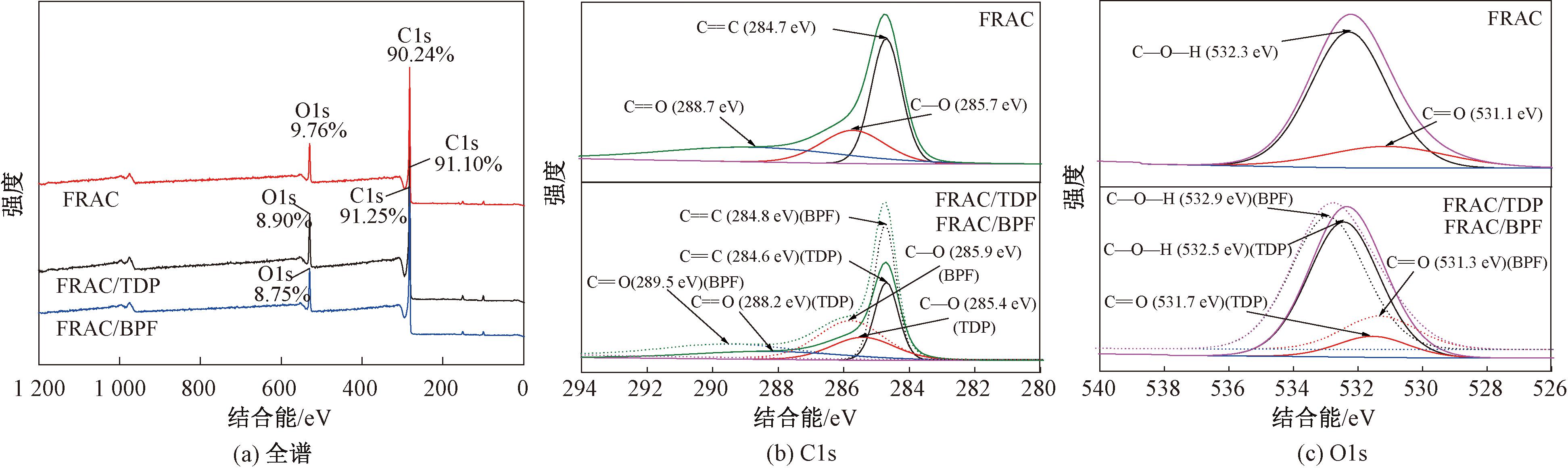
图6 FRAC吸附TDP和BPF前后的XPS光谱图
Figure 6 XPS spectra before and after FRAC adsorption of TDP and BPF
由图6(b)可知,C1s在284.7 、285.7、288.7 eV处的峰分别对应于FRAC的C![]() C、C—O、C
C、C—O、C![]() O基团的特征峰[14]。FRAC吸附TDP或BPF后C
O基团的特征峰[14]。FRAC吸附TDP或BPF后C![]() C的结合能均发生了改变,表明 FRAC与TDP(BPF)之间存在π—π相互作用。另外,吸附TDP或BPF后C
C的结合能均发生了改变,表明 FRAC与TDP(BPF)之间存在π—π相互作用。另外,吸附TDP或BPF后C![]() O的结合能从288.7 eV分别变为288.2 eV和289.5 eV,这可能是由于FRAC表面的羰基与TDP或BPF分子上的羟基之间形成氢键引起的[15]。
O的结合能从288.7 eV分别变为288.2 eV和289.5 eV,这可能是由于FRAC表面的羰基与TDP或BPF分子上的羟基之间形成氢键引起的[15]。
从图6(c)可知,O1s在532.3、531.1 eV处的峰分别为FRAC的C—O—H和C![]() O的特征峰[16]。FRAC吸附TDP或BPF后,C
O的特征峰[16]。FRAC吸附TDP或BPF后,C![]() O的结合能从531.1 eV分别变为531.7、531.3 eV;同时C—O—H的结合能从532.3 eV分别变为532.5、532.9 eV,再次说明了FRAC与TDP和BPF分子之间存在氢键相互作用。因此,氢键作用是FRAC吸附TDP或BPF的主要原因。
O的结合能从531.1 eV分别变为531.7、531.3 eV;同时C—O—H的结合能从532.3 eV分别变为532.5、532.9 eV,再次说明了FRAC与TDP和BPF分子之间存在氢键相互作用。因此,氢键作用是FRAC吸附TDP或BPF的主要原因。
2.7 pH值对吸附过程的影响和吸附机理探讨
选择吸附剂FRAC用量0.1 g/L,TDP或BPF溶液初始浓度0.2 mmol/L,吸附平衡时间分别为180 min和240 min,使用0.1 mol/L的NaOH或HCl调节pH值,在298 K下考察pH值对TDP或BPF吸附的影响,结果见图7。从图7可以看出,当溶液pH值从3升高到7时,FRAC对TDP或BPF的吸附量趋于平稳;当溶液pH值继续升高时,FRAC对TDP或BPF的吸附量逐渐降低。
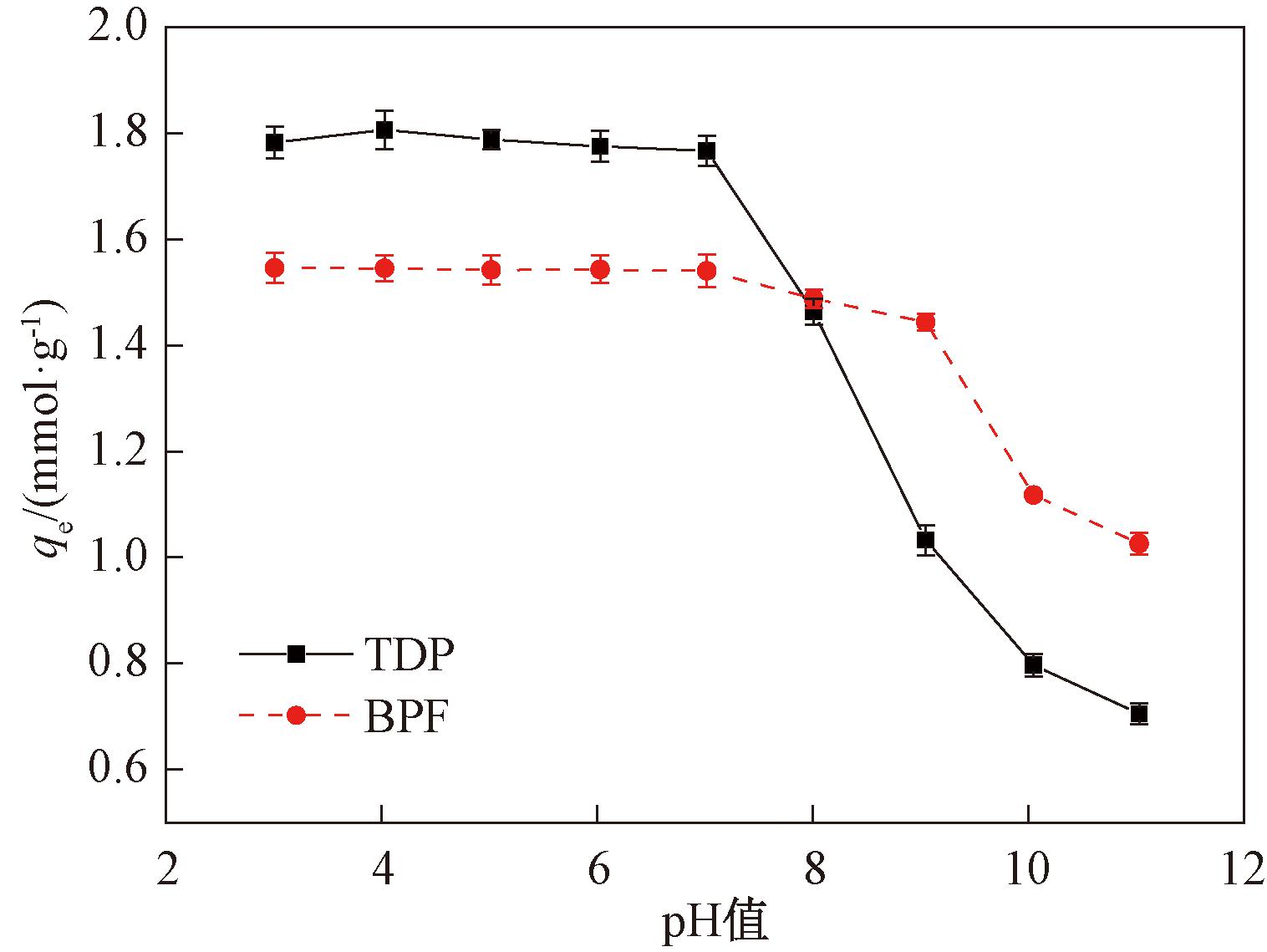
图7 pH值对吸附TDP和BPF的影响
Figure 7 Effect of pH on the adsorption of TDP and BPF
经实验测定,FRAC的等电点pHPZC为8.23[7]。当pH<8.23时,FRAC表面带正电荷;当pH>8.23时,FRAC表面带负电荷。TDP和BPF的电离常数pKa分别为9.31[17]和7.55[18]。由TDP分布系数可知,当pH<9.31时,溶液中以分子TDP为主;pH=9.31时,TDP和TDP-各占50%;当pH>9.31时,TDP则主要以阴离子(TDP-)形式存在。BPF也具有相同规律。
憎水性物质在吸附过程中与吸附剂之间可能有疏水作用,主要通过辛醇-水分配系数(log Kow)的大小来表征疏水作用的强弱[19]。log Kow的值越大,表明疏水性越强,吸附剂对吸附质的吸附量也就越大。TDP和BPF的log Kow值分别为3.34和2.91[20],所以TDP疏水性大于BPF。
吸附机理图见图8。TDP分子上的羟基和FRAC表面的羰基形成的氢键以及TDP分子上的硫醚基与FRAC表面的羟基形成的氢键是吸附过程中的主要作用力。同时TDP分子上的疏水基团使TDP通过疏水作用被吸附到FRAC的疏水表面。TDP 分子和FRAC 之间还产生了π—π相互作用。另外,静电作用对FRAC吸附TDP也产生一定影响。当pH>7时,TDP分子上羟基去质子化形成TDP-与FRAC之间氢键作用力逐渐减弱;同时TDP-与FRAC表面负电荷之间的静电排斥力也导致FRAC对TDP的吸附量急剧降低。
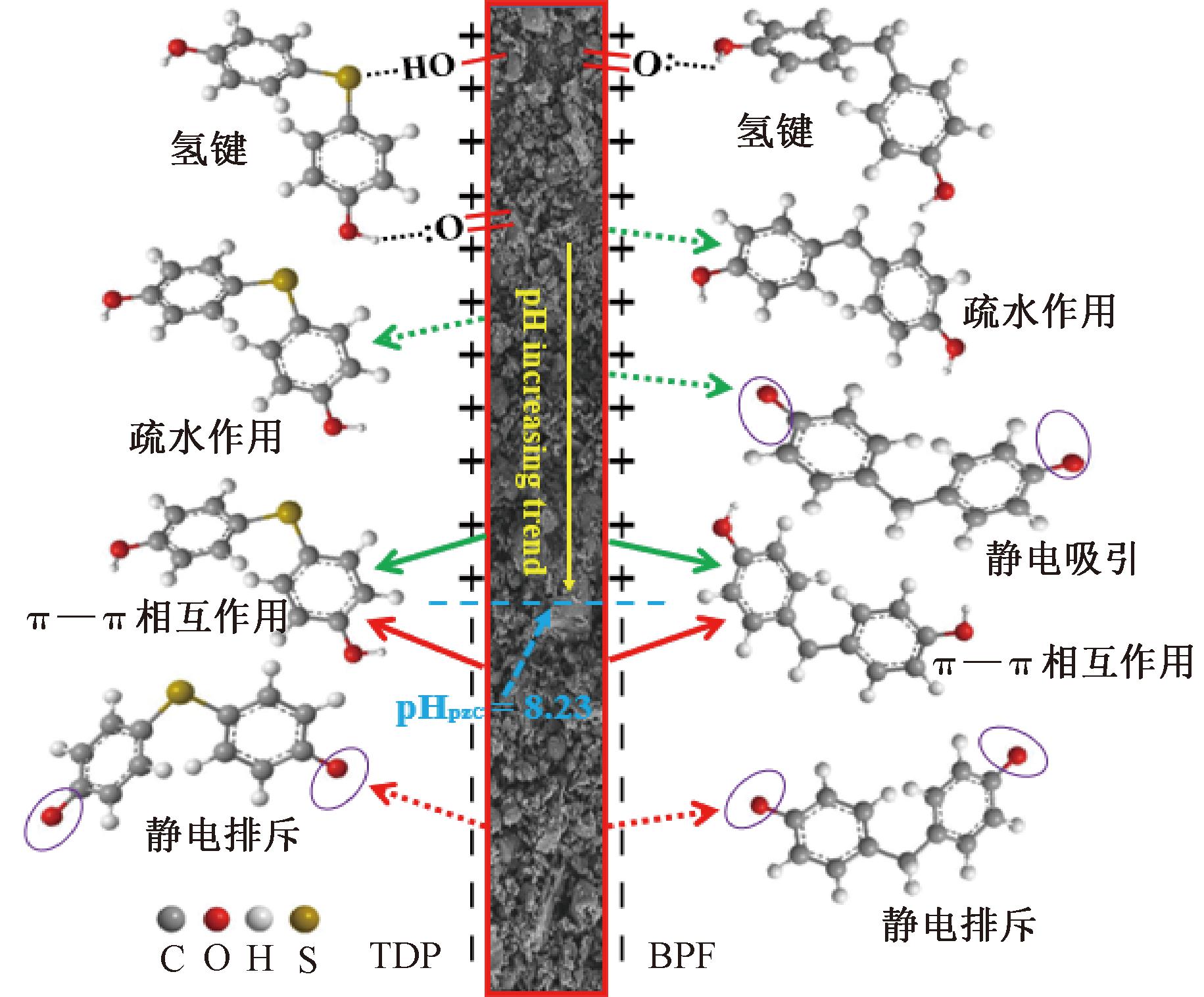
图8 FRAC对TDP和BPF吸附机理示意图
Figure 8 Schematic diagram of TDP and BPF adsorption onto FRAC
同样,FRAC对BPF的吸附也同样归因于氢键、π—π相互作用、疏水作用和静电作用的共同影响。当 pKa(7.55)
从图7可看出,FRAC对TDP吸附量大于BPF。主要是由于FRAC与TDP之间的疏水作用大于BPF;TDP分子上的硫醚键也可与FRAC上的羟基形成氢键作用,进一步促进了吸附过程。由于氢键和疏水作用的差异导致二者吸附量不同,所以FRAC对TDP和BPF的吸附主要受到氢键和疏水作用影响。
2.8 FRAC再生性能研究
吸附材料FRAC的再生性能通过再生实验进行评估。选择TDP或BPF溶液初始浓度为0.2 mmol/L,FRAC用量为0.1 g/L,在298 K温度下进行吸附实验,使用乙醇溶液对吸附TDP或BPF后的FRAC进行脱附,再生后的FRAC用于下一次吸附实验,连续经过5次再生循环,结果如图9所示。从图9中可以看出,经过5次再生实验后,FRAC对TDP和BPF的吸附量仍可分别达到1.748 6 mmol/g和1.403 0 mmol/g,说明FRAC具备很好的再生性能。

图9 FRAC吸附TDP和BPF的再生实验
Figure 9 Regeneration experiment of TDP and BPF adsorption onto FRAC
3 结论
研究了糠醛渣活性炭对内分泌干扰物TDP和BPF的吸附性能,对吸附TDP或BPF前后FRAC进行表征,并探讨了吸附机理。FRAC吸附TDP和BPF的吸附平衡时间分别为180、240 min。热力学研究表明,FRAC吸附TDP和BPF的吸附平衡数据符合Sips和Koble-Corrigan等温模型。热力学参数表明,FRAC对TDP或BPF的吸附均是自发进行的放热过程,降低温度有利于FRAC对TDP或BPF的吸附。动力学研究表明,FRAC吸附TDP或BPF的动力学数据均符合准二级动力学模型,吸附过程均受颗粒内扩散和膜扩散联合控制。制备的FRAC对TDP或BPF均有较高的吸附性能,为双酚类EDCs废水的处理提供了一种新方法。
[1] ZDARTA J, ANTECKA K, FRANKOWSKI R, et al. The effect of operational parameters on the biodegradation of bisphenols by Trametes versicolor laccase immobilized on Hippospongia communis spongin scaffolds[J]. Science of the Total Environment, 2018, 615: 784-795.
[2] GUO H, PENG L E, YAO Z K, et al. Non-polyamide based nanofiltration membranes using green metal-organic coordination complexes: implications for the removal of trace organic contaminants[J]. Environmental Science &Technology, 2019, 53(5): 2688-2694.
[3] MOUSSAVI G, POURAKBAR M, SHEKOOHIYAN S, et al. The photochemical decomposition and detoxification of bisphenol A in the VUV/H2O2 process: degradation, mineralization, and cytotoxicity assessment[J]. Chemical Engineering Journal, 2018, 331: 755-764.
[4] REZANIA S, CHO J, DERAKHSHAN NEJAD Z, et al. Microporous metal-organic frameworks against endocrine-disruptor bisphenol A: parametric evaluation and optimization[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2021, 626: 127039.
[5] CAI J Z, ZHANG P L, KANG S J, et al. Fast and efficient adsorption of bisphenols pollutants from water by using Hydroxypropyl-β-cyclodextrin polymer[J]. Reactive and Functional Polymers, 2020, 154: 104678.
[6] MA M J, YING H J, CAO F F, et al. Adsorption of Congo red on mesoporous activated carbon prepared by CO2 physical activation[J]. Chinese Journal of Chemical Engineering, 2020, 28(4): 1069-1076.
[7] LIU C L, LIANG L L, HAN X L, et al. Optimized preparation of activated carbon from furfural residue using response surface methodology and its application for bisphenol S adsorption[J]. Water Science and Technology, 2022, 85(3): 811-826.
[8] ACOSTA R, NABARLATZ D, S NCHEZ-S
NCHEZ-S NCHEZ A, et al. Adsorption of bisphenol A on KOH-activated tyre pyrolysis char[J]. Journal of Environmental Chemical Engineering, 2018, 6(1): 823-833.
NCHEZ A, et al. Adsorption of bisphenol A on KOH-activated tyre pyrolysis char[J]. Journal of Environmental Chemical Engineering, 2018, 6(1): 823-833.
[9] ZHANG H, SUN Y M, LI S, et al. Preparation, characterization, and efficient chromium (Ⅵ) adsorption of phosphoric acid activated carbon from furfural residue: an industrial waste[J]. Water Science and Technology, 2020, 82(12): 2864-2876.
[10] SHI X X, QIAO Y Y, AN X X, et al. High-capacity adsorption of Cr(Ⅵ) by lignin-based composite: characterization, performance and mechanism[J]. International Journal of Biological Macromolecules, 2020, 159: 839-849.
[11] ZHU G Z, DENG X L, HOU M, et al. Comparative study on characterization and adsorption properties of activated carbons by phosphoric acid activation from corncob and its acid and alkaline hydrolysis residues[J]. Fuel Processing Technology, 2016, 144: 255-261.
[12] KYZAS G Z, DELIYANNI E A, MATIS K A. Activated carbons produced by pyrolysis of waste potato peels: cobalt ions removal by adsorption[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2016, 490: 74-83.
[13] 丁雅琴. 基于4, 4′-二羟基二苯硫醚光学树脂制备及性能[D]. 武汉: 华中科技大学,2017.
DING Y Q. Preparation and property of optical resin based on 4,4′-dihydroxy diphenyl sulfide[D]. Wuhan: Huazhong University of Science and Technology, 2017.
[14] ZHU M P, ZHOU K B, SUN X D, et al. Hydrophobic N-doped porous biocarbon from dopamine for high selective adsorption of p-Xylene under humid conditions[J]. Chemical Engineering Journal, 2017, 317: 660-672.
[15] LIU L, CUI W, LU C, et al. Analyzing the adsorptive behavior of Amoxicillin on four Zr-MOFs nanoparticles: functional groups dependence of adsorption performance and mechanisms[J]. Journal of Environmental Management, 2020, 268: 110630.
[16] LIANG L L, NIU X Y, HAN X L, et al. Salt sealing induced in situ N-doped porous carbon derived from wheat bran for the removal of doxycycline from aqueous solution[J].Environmental Science and Pollution Research, 2022, 29(32): 49346-49360.
[17] LV Y C, ZHANG R S, ZENG S L, et al. Removal of p-arsanilic acid by an amino-functionalized indium-based metal-organic framework: adsorption behavior and synergetic mechanism[J]. Chemical Engineering Journal, 2018, 339: 359-368.
[18] BELTRAME K K, CAZETTA A L, DE SOUZA P S C, et al. Adsorption of caffeine on mesoporous activated carbon fibers prepared from pineapple plant leaves[J]. Ecotoxicology and Environmental Safety, 2018, 147: 64-71.
[19] WU P F, CAI Z W, JIN H B, et al. Adsorption mechanisms of five bisphenol analogues on PVC microplastics[J]. Science of the Total Environment, 2019, 650: 671-678.
[20] 张迪, 杨迪, 徐翠, 等. 还原氧化石墨烯高效吸附双酚F的机理研究[J]. 材料导报, 2019, 33(6):954-959.
ZHANG D, YANG D, XU C, et al. Study on mechanism of highly effective adsorption of bisphenol F by reduced graphene oxide[J]. Materials Review, 2019, 33(6):954-959.