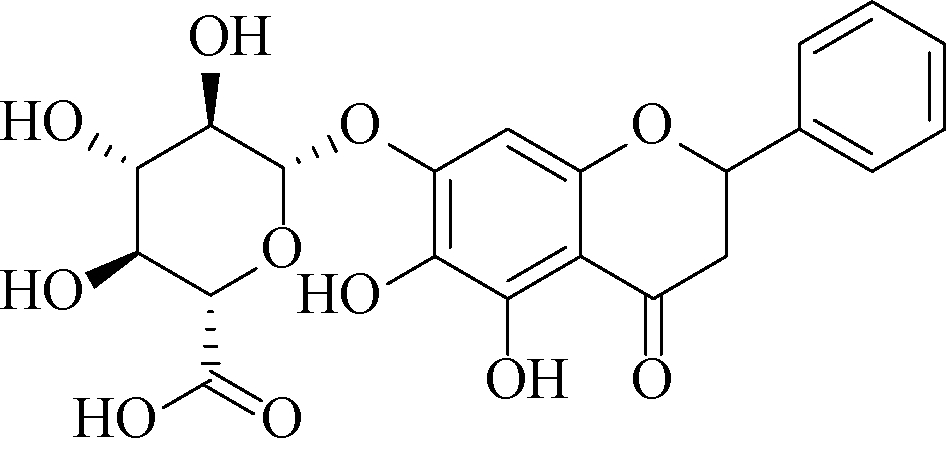
黄芩为中国传统大宗药材,主要用于上呼吸道感染等疾病。以“三方三药”为代表的中医药在控制新冠疫情中发挥了巨大作用,而黄芩就是主要药味之一[1-2],市场对于黄芩和黄芩提取物需求较大。黄芩苷是黄芩及其制剂的主要质量控制指标成分[3],《中国药典》2020年版一部黄芩提取物项下规定黄芩苷纯度不低于85%[4]。黄芩苷的分子结构如下:
现有文献对黄芩苷的纯化工艺考察还仅限于实验室研究,对工业化生产鲜有报道。因此目前黄芩提取物生产企业依然采用药典纯化方法对黄芩苷进行精制。该纯化工艺为将提取液加盐酸调pH值至1.0~2.0,在80 ℃保温,静置,滤过。沉淀物加适量水搅拌,用40%氢氧化钠调pH值至7.0,加等量乙醇,搅拌使溶解,滤过,滤液再加盐酸调节pH值至1.0~2.0,60 ℃保温,静置,滤过,沉淀依次用适量水及不同浓度的乙醇洗至pH至中性,挥尽乙醇,减压干燥,即得[4]。该纯化过程反复碱溶酸沉,并采用乙醇除杂,造成有效成分损失较大,且操作烦琐、生产周期长。本实验结合工业化生产实际,以黄芩苷得率和黄芩苷纯度为响应值,对酸沉法、碱溶酸沉法、重结晶法和药典纯化方法进行实验对比,确定黄芩苷的最佳纯化方法;然后采用筛选试验(Plackett-Burman,PB)[5-7]和Box-Behnken响应面试验[8-10],对整个工艺条件进行考察,同时基于QbD理念[11-12]构建操作空间,为工业化生产黄芩提取物提供理论依据。
1 仪器与试药
1.1 仪器
赛默飞UltiMate3000高效液相色谱仪(赛默飞世尔科技有限公司);DZKW-4电热恒温水浴锅(北京中兴伟业仪器有限公司);THD-1008W低温恒温槽(宁波天恒仪器厂);101-1AB电热鼓风干燥箱(天津赛得利斯实验分析仪器制造厂)。
1.2 试药
黄芩苷对照品(中国食品药品检定研究院,批号:110715-202122);黄芩药材(购自中国禹州药材市场);用于液相分析的甲醇为色谱级;其余试剂为分析纯。
2 方法
2.1 黄芩水提液的制备
取黄芩粗粉500 g,加入沸水5 L,于90 ℃浸泡1 h,超声提取20 min,滤过,再次加入沸水5 L,超声提取20 min,滤过,合并提取液,备用。
2.2 纯化方法比较
取黄芩水提液200 mL,依次采用酸沉法[13]、碱溶酸沉法[14]、重结晶法[15]和药典纯化方法[4]对黄芩苷进行精制,将得到的粗品于60 ℃干燥,称重,测定黄芩苷含量,计算黄芩苷得率。
2.3 碱溶酸沉法工艺操作
根据实验设计表中的运行序开展实验,将待纯化样品溶液浓缩成所需特定药液浓度的水提液,每份样品取200 mL,在设计的温度下加入要求浓度的氢氧化钠溶液调节pH至设计参数后,保温相应时间,过滤,滤液加热至设计要求温度,加入要求浓度盐酸溶液,pH调至要求水平,保温相应时间,保温结束后取出样品并置于低温恒温槽中静置相应时间,滤过,沉淀用蒸馏水洗至中性,抽滤,60 ℃真空干燥得黄芩苷粗品,称重,测定黄芩苷含量,计算黄芩苷得率。
2.4 黄芩苷含量的测定
2.4.1 色谱条件
色谱柱为Hypersil25005-254630(250 mm×4.6 mm,5 μm);流动相为甲醇-水-磷酸(47∶53∶0.2);检测波长为280 nm;流速为1 mL·min-1;柱温为30 ℃;进样量为10 μL。
2.4.2 对照品溶液的制备
精密称取黄芩苷对照品适量,加甲醇制成每1 mL含106.982 4 μg黄芩苷的对照品溶液。
2.4.3 供试品溶液的制备
黄芩水提液:精密量取提取液2 mL,置于100 mL容量瓶中,加适量70%乙醇,超声使之溶解,放至室温,加70%乙醇至刻度,摇匀。精密量取5 mL,置25 mL容量瓶中,加甲醇至刻度,摇匀,滤过,取续滤液,即得。
黄芩提取物:取本品10 mg,精密称定,置25 mL量瓶中,加甲醇适量使溶解,再加甲醇至刻度,摇匀。精密量取5 mL,置25 mL量瓶中,加甲醇至刻度,摇匀,滤过,取续滤液,即得。
2.4.4 线性关系考察
将对照品溶液稀释至6个不同浓度,按2.4.1节色谱条件进行分析。以峰面积为纵坐标,对照品的进样浓度为横坐标,得到回归方程,可知黄芩苷在3.343 2~106.982 4 μg·mL-1内呈良好的线性关系。
2.4.5 精密度、稳定性、重复性、回收率试验
精密度、稳定性、重复性及回收率试验按《中国药典》2020年版四部[16]要求进行考察,结果均符合要求,说明该方法具有良好的系统适用性。
2.5 黄芩苷得率计算
黄芩苷得率计算公式如下:
黄芩苷得率![]()
(1)
2.6 Plackett-Burman(PB)试验设计
以黄芩苷得率(Y1)和黄芩苷纯度(Y2)为指标,使用Design-Expert 10.0.4软件对碱溶酸沉法中涉及的11个工艺参数进行PB试验设计,筛选出对黄芩苷得率和黄芩苷纯度影响显著的主要因素,因素及水平见表1。
表1 Plackett-Burman试验设计因素及水平
Table 1 Factors and levels for Plackett-Burman test design
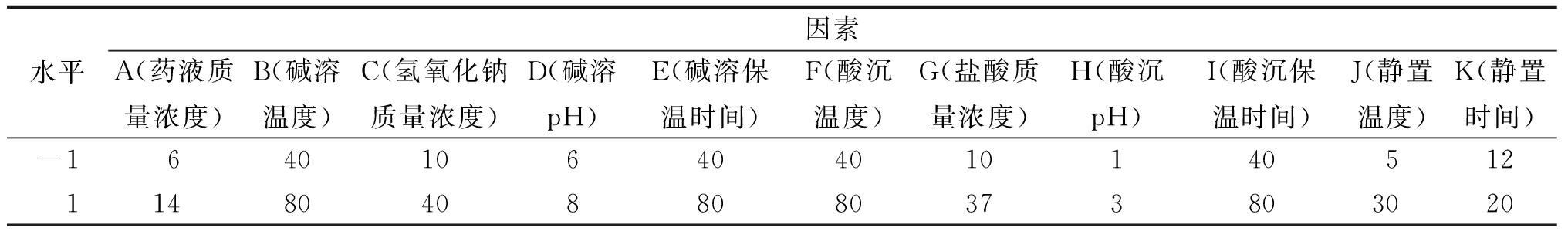
水平因素A(药液质量浓度)B(碱溶温度)C(氢氧化钠质量浓度)D(碱溶pH)E(碱溶保温时间)F(酸沉温度)G(盐酸质量浓度)H(酸沉pH)I(酸沉保温时间)J(静置温度)K(静置时间)-1640106404010140512114804088080373803020
2.7 Box-Behnken(BB)响应面试验设计
将PB试验筛选得到的药液质量浓度(A)、碱溶温度(B)、碱溶pH(D)、酸沉温度(F)和酸沉pH(H)5个关键参数使用Design-Expert 10.0.4软件进行5因素3水平的响应面试验设计,3个因素各设高、中、低3个水平,分别用1、0、-1表示,因素及水平见表2。
表2 Box-Behnken响应面试验设计因素及水平
Table 2 Factors and levels for Box-Behnken response surface design
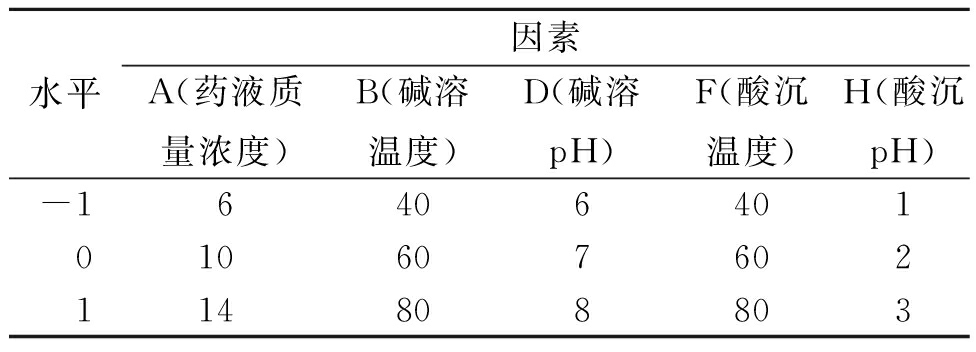
水平因素A(药液质量浓度)B(碱溶温度)D(碱溶pH)F(酸沉温度)H(酸沉pH)-16406401010607602114808803
3 结果与分析
3.1 对照品和供试品色谱图
对照品溶液和供试品溶液分别按照2.4.2节和2.4.3节方法进行制备,均通过2.4.1节色谱条件进行分析,各色谱图见图1。
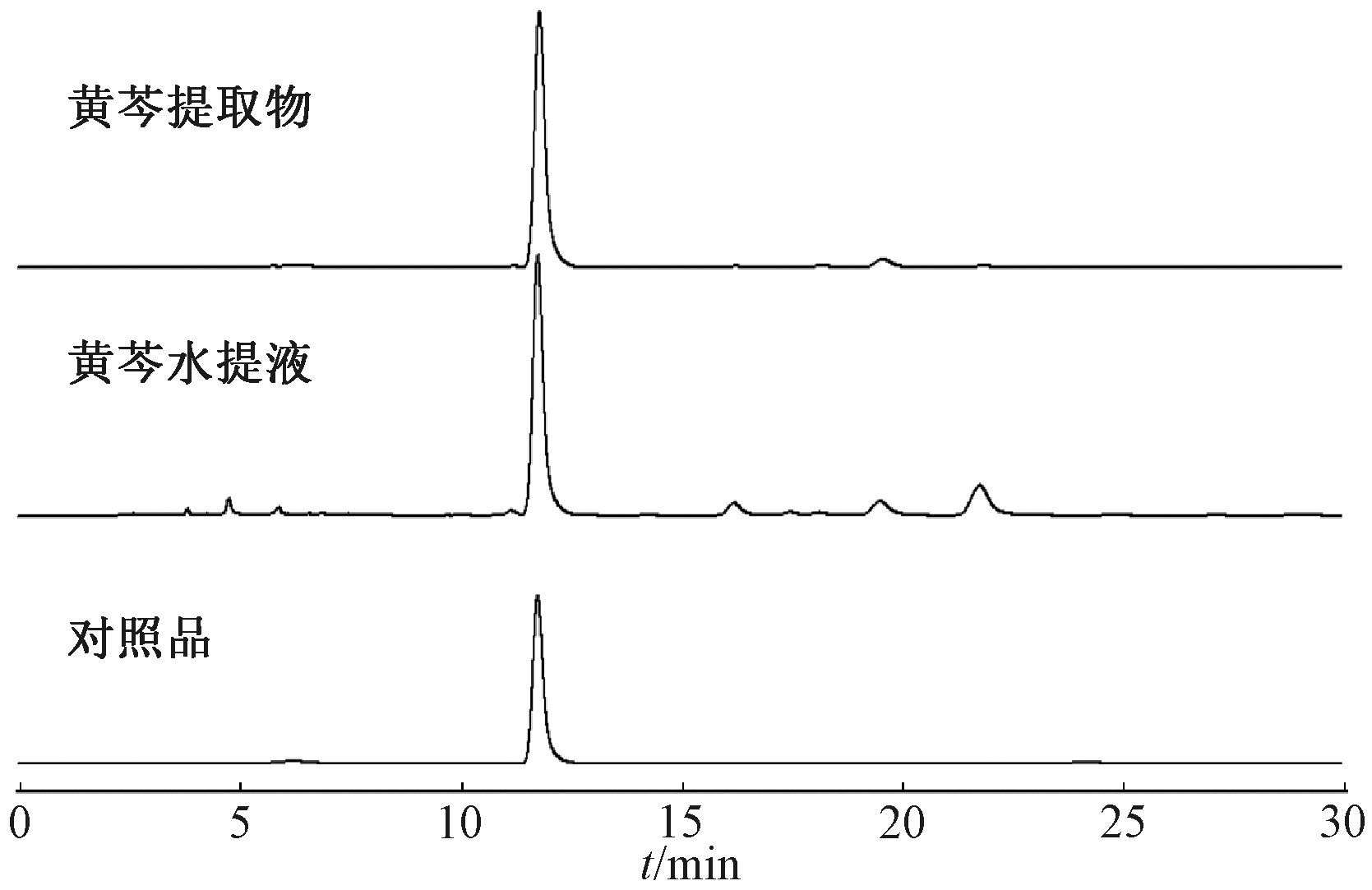
图1 对照品与供试品HPLC图
Figure 1 HPLC of control and test sample
3.2 黄芩苷不同纯化方法的实验结果
黄芩苷不同纯化方法的实验结果如表3所示,由实验结果可以看出,当采用碱溶酸沉法对黄芩苷进行精制时,黄芩苷得率和黄芩苷纯度均较其他3种纯化方法高,因此选取碱溶酸沉法更进一步地研究。
表3 黄芩苷纯化方法的比较
Table 3 Comparison of purification methods of baicalin
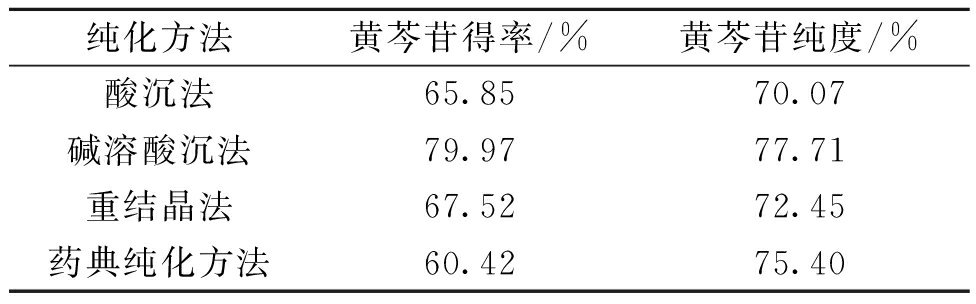
纯化方法黄芩苷得率/%黄芩苷纯度/%酸沉法65.8570.07碱溶酸沉法79.9777.71重结晶法67.5272.45药典纯化方法60.4275.40
3.3 Plackett-Burman(PB) 试验结果
通过PB试验设计对影响因素进行显著性分析,试验设计及结果见表4,试验结果效应分析见表5,各模型的P值均小于0.01,可知该模型具有极显著影响,表明模型具有统计学意义。从各个因素的P值可以看出药液质量浓度、碱溶温度和酸沉pH对黄芩苷得率有极显著影响;药液质量浓度、碱溶温度、碱溶pH、酸沉温度和酸沉pH对黄芩苷纯度有极显著影响。因此选取药液质量浓度(A)、碱溶温度(B)、碱溶pH(D)、酸沉温度(F)和酸沉pH(H)5个因素进一步优化处理。考虑到生产成本,在后续实验中将剩余工艺参数固定为40%的氢氧化钠溶液、碱溶保温时间40 min、浓盐酸、酸沉保温时间40 min、5~30 ℃状态下静置12 h。
表4 Plackett-Burman试验设计及结果
Table 4 Experimental design and results of Plackett-Burman design
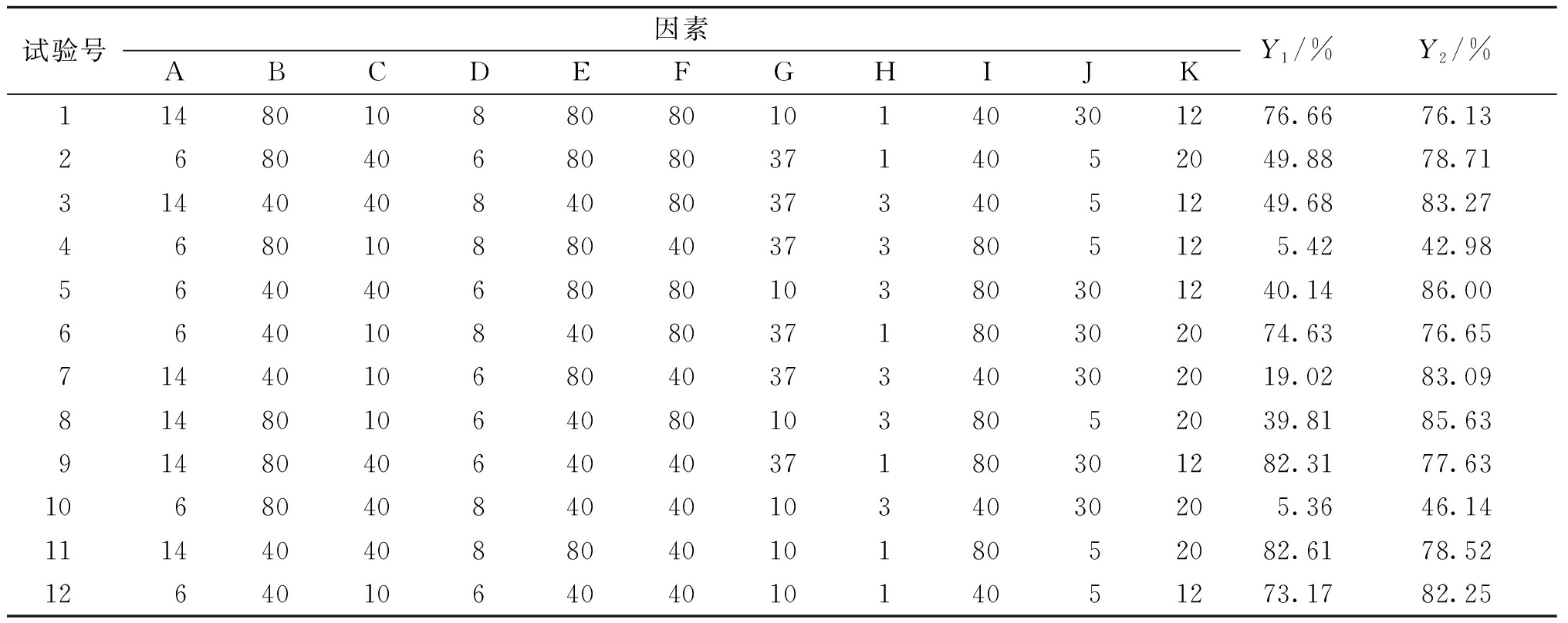
试验号因素ABCDEFGHIJKY1/%Y2/%11480108808010140301276.6676.13268040680803714052049.8878.713144040840803734051249.6883.2746801088040373805125.4242.985640406808010380301240.1486.006640108408037180302074.6376.6571440106804037340302019.0283.098148010640801038052039.8185.6391480406404037180301282.3177.631068040840401034030205.3646.1411144040880401018052082.6178.521264010640401014051273.1782.25
表5 Plackett-Burman试验设计分析
Table 5 Plackett-Burman test design analysis
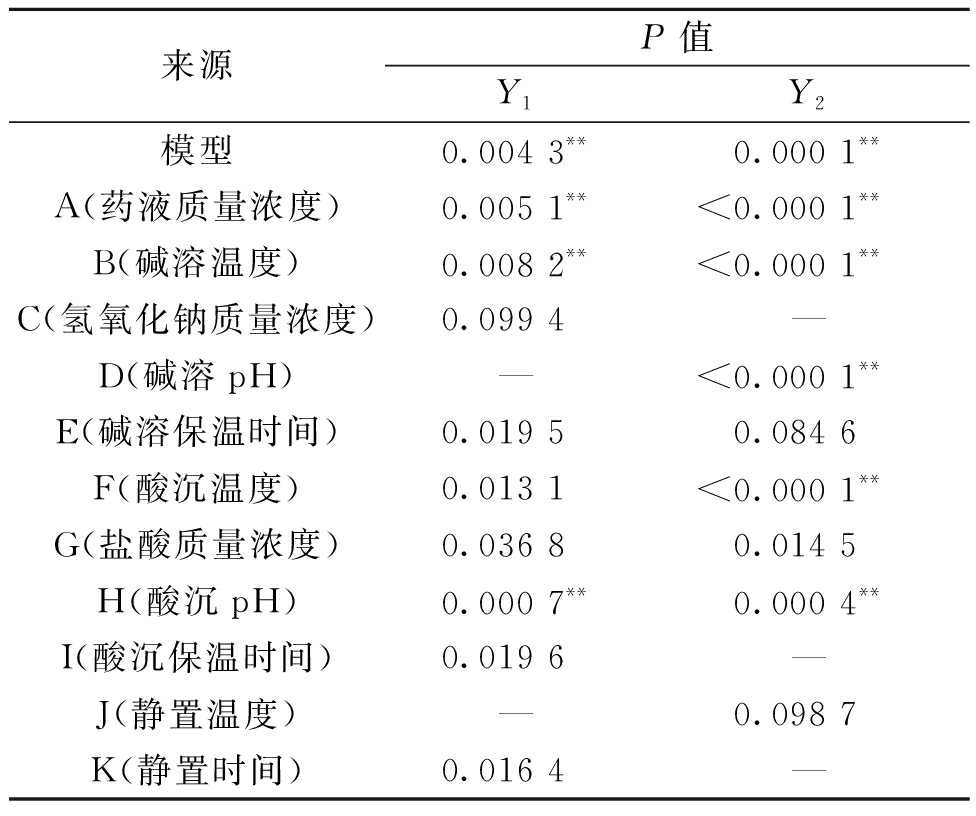
来源P值Y1Y2模型0.004 3**0.000 1**A(药液质量浓度)0.005 1**<0.000 1**B(碱溶温度)0.008 2**<0.000 1**C(氢氧化钠质量浓度)0.099 4—D(碱溶pH)—<0.000 1**E(碱溶保温时间)0.019 50.084 6F(酸沉温度)0.013 1<0.000 1**G(盐酸质量浓度)0.036 80.014 5H(酸沉pH)0.000 7**0.000 4**I(酸沉保温时间)0.019 6—J(静置温度)—0.098 7K(静置时间)0.016 4—
注:“**”表示差异极显著(P<0.01),“—”处代表该因素对模型的影响不显著(即P≥0.10)。
3.4 响应面试验结果
3.4.1 Box-Behnken试验设计结果及方差分析
应用Design-Expert 10.0.4对表6的试验数据进行拟合并进行方差分析,由表7可知两个模型P值均小于0.000 1,说明以黄芩苷得率和黄芩苷纯度为评价指标的回归模型具有显著统计学意义。失拟项P值分别为0.215 0和0.326 7,两方程的R2分别为0.960 2和0.958 4,说明各模型拟合度较好且有良好的预测性。对于黄芩苷得率,A(药液质量浓度)、H(酸沉pH)对模型具有极显著影响,B(碱溶温度)具有显著影响,各因素的影响程度从大到小为H(酸沉pH)、A(药液质量浓度)、B(碱溶温度)、D(碱溶pH)、F(酸沉温度);对于黄芩苷纯度,H(酸沉pH)对模型影响极显著,D(碱溶pH)具有显著影响,各因素的影响程度从大到小为H(酸沉pH)、D(碱溶pH)、B(碱溶温度)、F(酸沉温度)、A(药液质量浓度);其余项不显著。可以看出,药液质量浓度、碱溶温度、碱溶pH和酸沉pH是碱溶酸沉工艺中的关键参数。
表6 部分Box-Behnken设计及结果
Table 6 Partial Box-Behnken design and results
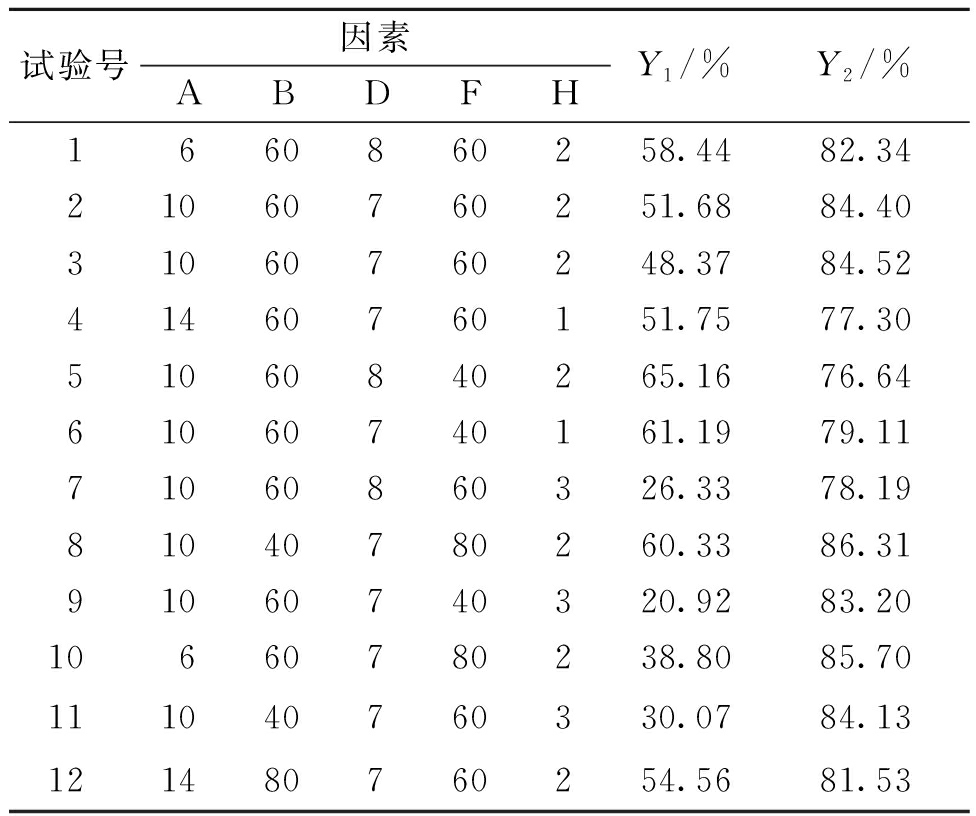
试验号因素ABDFHY1/%Y2/%1660860258.4482.3421060760251.6884.4031060760248.3784.5241460760151.7577.3051060840265.1676.6461060740161.1979.1171060860326.3378.1981040780260.3386.3191060740320.9283.2010660780238.8085.70111040760330.0784.13121480760254.5681.53
表7 二项模型的方差分析
Table 7 Analysis of variance of quadratic model
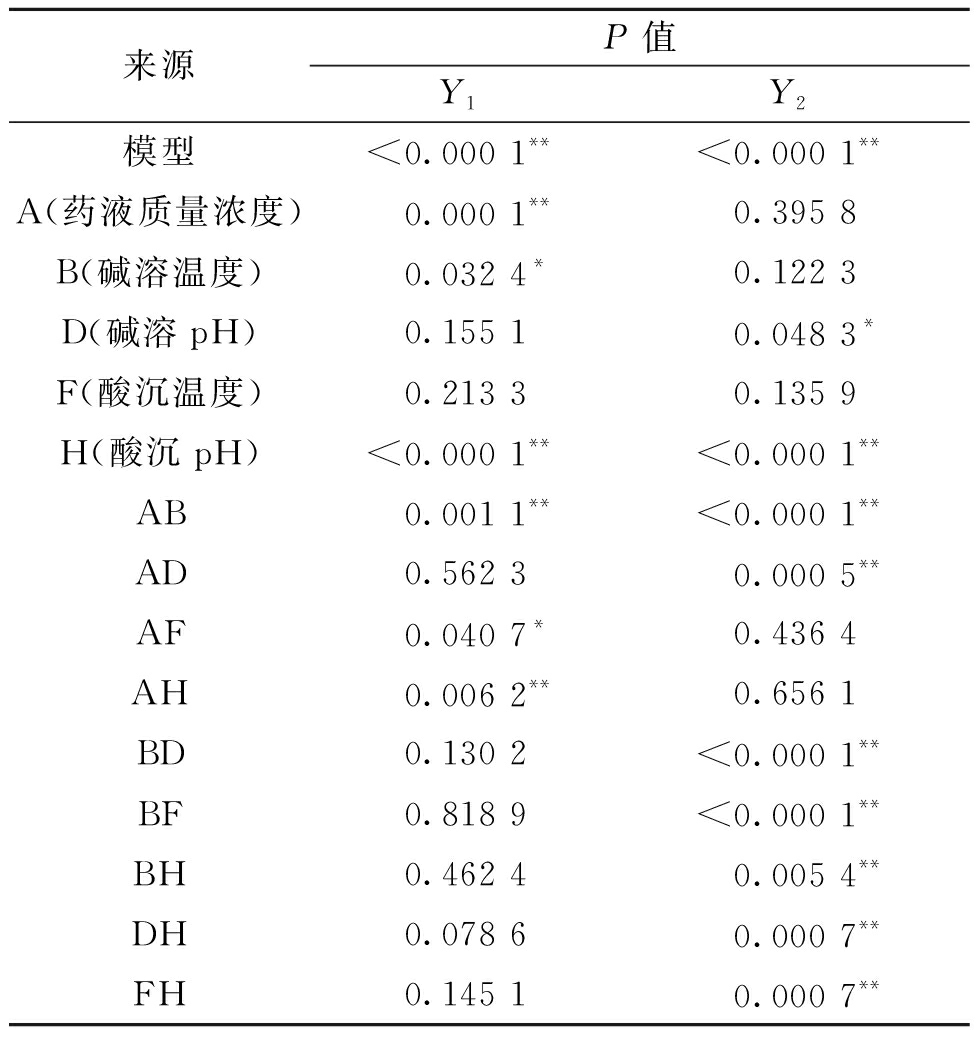
来源P值Y1Y2模型<0.000 1**<0.000 1**A(药液质量浓度)0.000 1**0.395 8B(碱溶温度)0.032 4*0.122 3D(碱溶pH)0.155 10.048 3*F(酸沉温度)0.213 30.135 9H(酸沉pH)<0.000 1**<0.000 1**AB0.001 1**<0.000 1**AD0.562 30.000 5**AF0.040 7*0.436 4AH0.006 2**0.656 1BD0.130 2<0.000 1**BF0.818 9<0.000 1**BH0.462 40.005 4**DH0.078 60.000 7**FH0.145 10.000 7**
注:“**”表示差异极显著(P<0.01),“*”表示差异显著(P<0.05)。
3.4.2 响应面分析
采用Design-Expert 10.0.4软件对黄芩苷得率(Y1)和黄芩苷纯度(Y2)进行响应面分析,从图2和图3可以看出,酸沉pH对黄芩苷得率和黄芩苷纯度的影响都较其他因素大:随着酸沉pH的降低,黄芩苷得率逐渐升高,而黄芩苷纯度逐渐下降。因此在纯化过程中对于酸沉pH的调节极为重要,只有酸沉pH在合适的范围内,才能保证响应值达到最优。
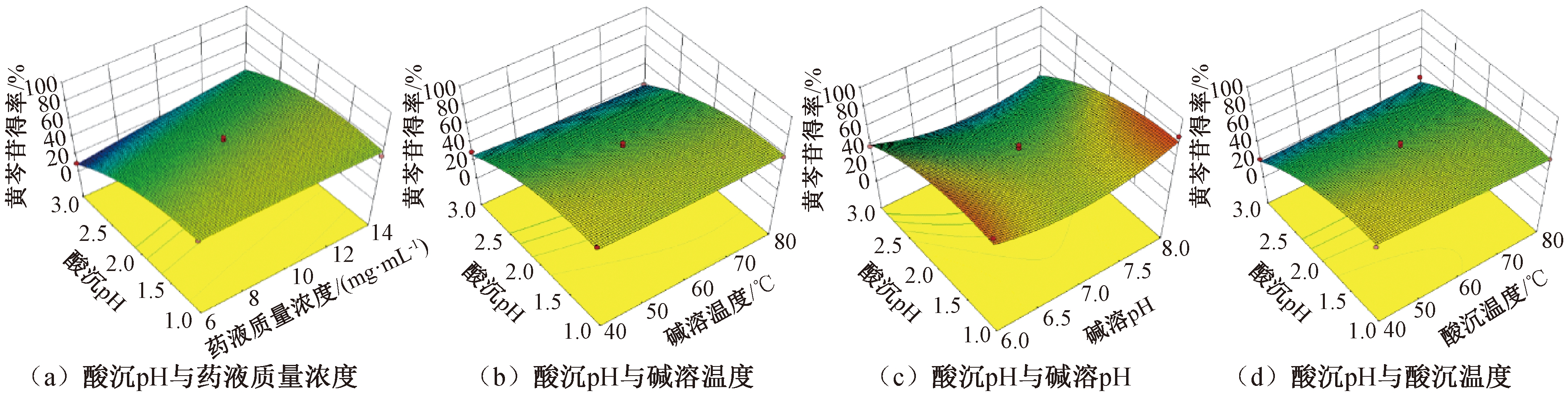
图2 各因素交互作用对黄芩苷得率的响应面图
Figure 2 Response surface of the effect of interaction terms on the yield of baicalin
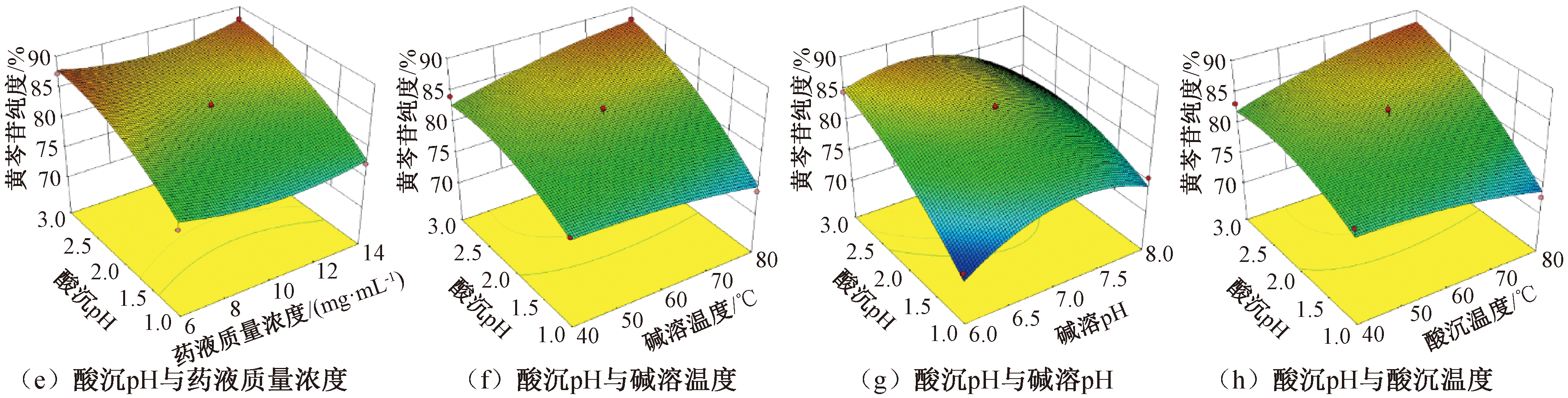
图3 各因素交互作用对黄芩苷纯度的响应面图
Figure 3 Response surface of the effect of interaction terms on the purity of baicalin
3.4.3 设计空间及验证
为便于实际生产中的操作,选择对响应值影响较大的关键工艺参数药液质量浓度和酸沉pH,通过 Design Expert 10.0.4软件建立了设计空间,结合生产企业实际生产需求,使响应值Y1>85%,Y2>85%。但由于模型的预测值与真实值会存在一定偏差,所以设计空间的边界具有不确定性。为了应对设计空间边界的不确定性,在定义设计空间时可加入置信水平α=0.05的置信区间,将设计空间优化,最终确定设计空间:碱溶温度为40 ℃、碱溶pH为8.0、酸沉温度为80 ℃、药液质量浓度为11.53~14 mg·mL-1、酸沉pH为1.17~2.33,结果用Overlay Plot展示,如图4所示,在黄色区域内任选一点进行操作,响应值均能达到85%以上。
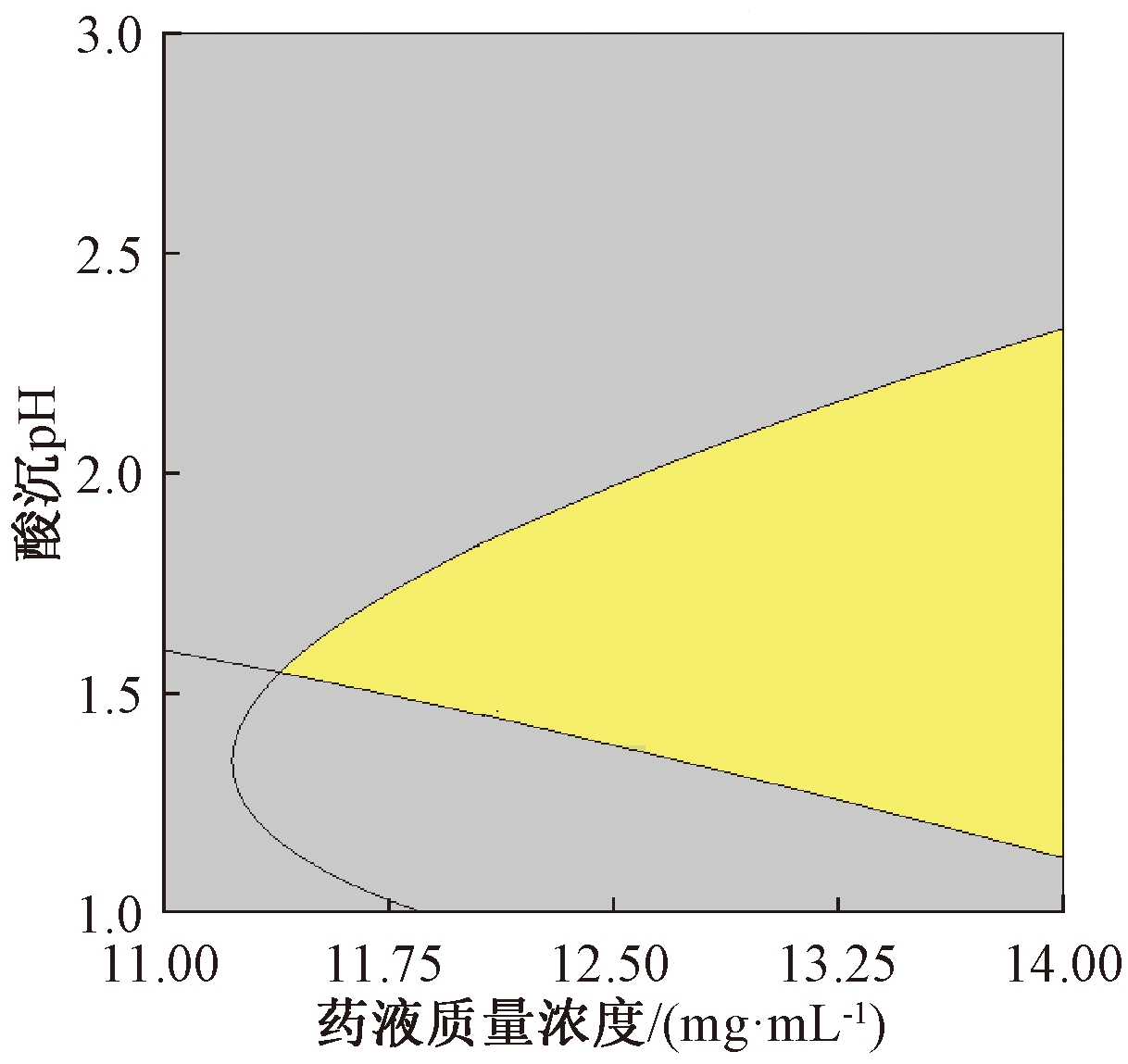
图4 设计空间图
Figure 4 Design space map
为验证设计空间的准确性,在设计空间内、外任取3个点进行验证,每个试验平行做3份,具体验证点试验条件和结果见表8。由验证结果得到的实际值和预测值接近,表明该模型具有良好的预测性。当工艺参数未在设计空间内时,不能达到目标要求;而当工艺参数落在设计空间内时,能够很好地达到预期目标,说明设计空间稳定可靠,对指导黄芩苷的实际生产具有重大参考意义,同时也符合质量源于设计(QbD)理念。
表8 设计空间验证试验结果
Table 8 Design space validation test results
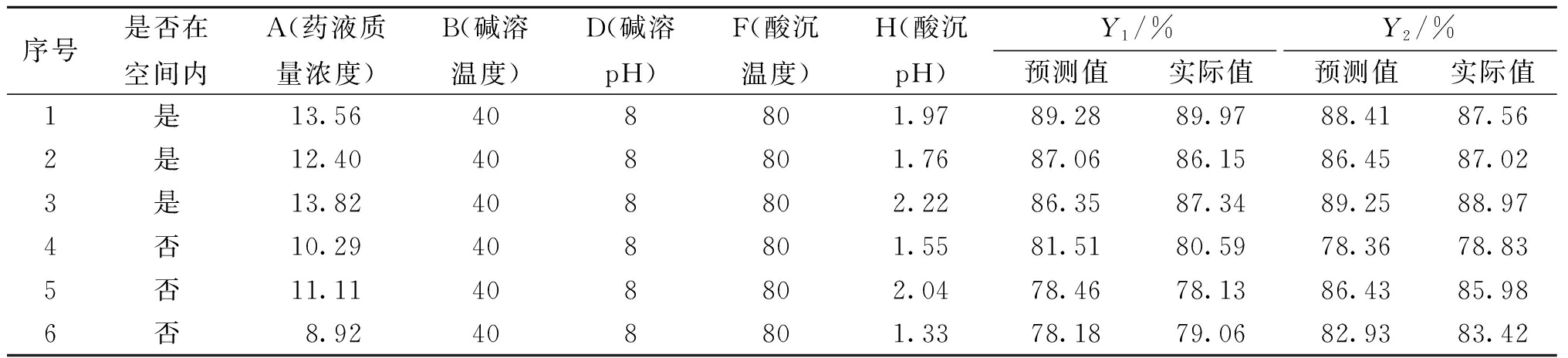
序号是否在空间内A(药液质量浓度)B(碱溶温度)D(碱溶pH)F(酸沉温度)H(酸沉pH)Y1/%Y2/%预测值实际值预测值实际值1是13.56408801.9789.2889.9788.4187.562是12.40408801.7687.0686.1586.4587.023是13.82408802.2286.3587.3489.2588.974否10.29408801.5581.5180.5978.3678.835否11.11408802.0478.4678.1386.4385.986否8.92408801.3378.1879.0682.9383.42
4 结论
以黄芩苷得率和纯度为考察指标,进行黄芩苷的纯化工艺研究,通过对酸沉法、碱溶酸沉法、重结晶法和药典纯化方法进行对比实验,结果发现采用碱溶酸沉法进行黄芩苷纯化时,其得率和纯度均比较高,因此采用PB试验和响应面试验对碱溶酸沉法中涉及的工艺参数进行系统研究。结果得到工业化生产推荐的操作空间:药液质量浓度为11.53~14.00 mg·mL-1、碱溶温度为40 ℃、碱溶pH为8.0、酸沉温度为80 ℃、酸沉pH为1.17~2.33。在设计空间内操作,能够满足关键工艺指标黄芩苷得率和纯度均在85%以上。实验结果说明采用一次碱溶酸沉法对黄芩苷进行纯化,不仅能得到较高的黄芩苷得率和黄芩苷纯度,且能够缩短生产周期、降低生产成本,适合于工业化生产,具有较好的实用价值。
[1] 李萌, 刘方舟, 杜昱, 等. 新型冠状病毒肺炎验案用药规律探析[J]. 世界科学技术-中医药现代化, 2021, 23(6): 1909-1914.
LI M, LIU F Z, DU Y, et al. Analysis and study of drug use patterns in COVID-19 treatment cases[J]. Modernization of Traditional Chinese Medicine and Materia Medica-World Science and Technology, 2021, 23(6): 1909-1914.
[2] 侯艺, 付亚辉, 于若愚, 等. 基于数据挖掘新型冠状病毒肺炎治疗期中药用药规律[J]. 世界科学技术-中医药现代化, 2021, 23(5): 1667-1675.
HOU Y, FU Y H, YU R Y, et al. Rule of Chinese materia medica in the treatment period of COVID-19 based on data mining[J]. Modernization of Traditional Chinese Medicine and Materia Medica-World Science and Techno-logy, 2021, 23(5): 1667-1675.
[3] 郑勇凤, 王佳婧, 傅超美, 等. 黄芩的化学成分与药理作用研究进展[J]. 中成药, 2016, 38(1): 141-147.
ZHENG Y F, WANG J J, FU C M, et al. Research progress on chemical constituents and pharmacological effects of baicalin [J]. Chinese Traditional Patent Medicine, 2016, 38(1): 141-147.
[4] 国家药典委员会. 中华人民共和国药典:一部[M]. 2020年版. 北京: 中国医药科技出版社, 2020.
Chinese Pharmacopoeia Commission. Pharmacopoeia of People′s Republic of China: Volume I[M]. 2020 ed. Beijing: China Medical Science Press, 2020.
[5] 王超越, 龚行楚, 付泽飞, 等. 确定性筛选设计结合设计空间法优化黄芩提取物的纯化工艺[J]. 中国中药杂志, 2021, 46(8): 2061-2066.
WANG C Y, GONG X C, FU Z F, et al. Definitive screening design combined with design space for optimizing purification process of Scutellariae Radix extract[J]. China Journal of Chinese Materia Medica, 2021, 46(8): 2061-2066.
[6] 黄樱华, 李丹涛. Plackett-Burman试验法结合星点设计-响应面法优化侧柏叶的纯化工艺[J]. 中药材, 2020, 43(3): 682-686.
HUANG Y H, LI D T. Optimization of purification process of Platycladus orientalis leaves by Plackett-Burman design combined with central composite design-response surface method [J]. Journal of Chinese Medicinal Materials, 2020, 43(3): 682-686.
[7] 滕毅, 杨海玲. Plackett-Burman设计联用星点设计-响应面法优选大青叶中靛玉红的提取工艺[J]. 中草药, 2019, 50(8): 1942-1946.
TENG Y, YANG H L. Optimal extraction of indirubin from Isatidis Folium based on Plackett-Burman design combined with central composite design-response surface methodology[J]. Chinese Traditional and Herbal Drugs, 2019, 50(8): 1942-1946.
[8] 王俪桦, 应泽茜, 孙贝贝, 等. 基于Box-Behnken设计-响应面法优化蜜麦麸的制备工艺[J]. 中草药, 2021, 52(12): 3538-3543.
WANG L H, YING Z X, SUN B B, et al. Optimization of processing technology of honey wheat bran based on Box-Behnken response surface methodology[J]. Chinese Traditional and Herbal Drugs, 2021, 52(12): 3538-3543.
[9] DING X R, ZHU J, ZHANG Y, et al. Separation and concentration of natural products by fast forced adsorption using well-dispersed velvet-like graphitic carbon nitride with response surface methodology optimisation[J]. Talanta, 2016, 154: 119-126.
[10] 任慧, 崔小敏, 胡静, 等. Box-Behnken响应面法优化金铃子散的醇提工艺[J]. 中药材, 2019, 42(11): 2631-2634.
REN H, CUI X M, HU J, et al. Optimization of alcohol extraction process of Jinlingzi powder by Box-Behnken response surface methodology[J]. Journal of Chinese Medicinal Materials, 2019, 42(11): 2631-2634.
[11] 刘玉娟, 王永洁, 邓莉莉, 等. 基于质量源于设计理念的中药制剂工艺研究进展[J]. 中国现代中药, 2022, 24(3): 523-528.
LIU Y J, WANG Y J, DENG L L, et al. Research on Chinese medicine preparation process based on quality by design concept: a review[J]. Modern Chinese Medicine, 2022, 24(3): 523-528.
[12] TROIANO G, NOLAN J, PARSONS D, et al. A quality by design approach to developing and manufacturing polymeric nanoparticle drug products[J]. The AAPS Journal, 2016, 18(6): 1354-1365.
[13] 李静. 黄芩苷的提取与纯化方法的研究[D]. 济南: 山东大学, 2011.
LI J. Research on the extraction and purification of baicalin[D]. Jinan: Shandong University, 2011.
[14] 田帅华, 李钦. 灯盏细辛中野黄芩苷提取纯化工艺研究[J]. 中成药, 2010, 32(1): 124-127.
TIAN S H, LI Q. Study on extraction and purification of scutellarin from Erigeron breviscapus [J]. Chinese Traditional Patent Medicine, 2010, 32(1): 124-127.
[15] 周健. 黄芩有效成分提取及纯化工艺的研究[D]. 西安: 西安理工大学, 2009.
ZHOU J. Study on extraction and purification process of baicalin active ingredient in Scutellaria Baicalensis Georai[D]. Xi′an: Xi′an University of Technology, 2009.
[16] 国家药典委员会. 中华人民共和国药典:四部[M]. 2020年版. 北京: 中国医药科技出版社, 2020.
Chinese Pharmacopoeia Commission. Pharmacopoeia of People′s Republic of China: Volume IV[M]. 2020 ed. Beijing: China Medical Science Press, 2020.