环丙沙星(ciprofloxacin,CIP)作为一种广谱抗生素,是首选的氟喹诺酮类药物之一,也是世界上使用最广泛的化疗抗生素[1]。然而,其并不能完全地被人或者动物吸收,这也导致大量的CIP通过生物排泄的方式进入污水系统中。CIP能在生物体内积累,并对生物健康造成严重威胁。
目前,生物修复、高级氧化法、臭氧氧化法和吸附法等多种方法被用于处理CIP废水。吸附法具备成本低、操作简单、去除率高和灵活性高等优点,在处理抗生素废水方面有比较大的应用潜力[2]。活性炭相较于树脂、金属有机框架、黏土等其他吸附剂,吸附量大和无毒无害是其一直以来具备的优势。Huang等[3]以木质素为原料、H3PO4为活化剂制备木质素活性炭处理环丙沙星废水,对环丙沙星的最大吸附量可以达到312.5 mg/g。对活性炭进行氮掺杂,使其具有独特的电子特性和更加丰富的表面官能团,从而进一步提高活性炭的吸附性能的方法是近年来的研究热点之一[4]。Ahmed等[5]以β沸石为模板分别制备活性炭(BTC)和氮掺杂型活性炭(nBTC)来处理抗生素废水。相较于BTC,nBTC在吸附过程中由于氮元素的存在,表现出比BTC更强的吸附能力。
然而传统的方法并不能制备高性能的氮掺杂活性炭。水热碳化氮掺杂能使生物质与氮掺杂剂接触更加充分、反应更加完全,是一种更加有效的氮掺杂方法。本文以农业废弃物柚子皮为原材料,采取水热炭化氮掺杂和氢氧化钾活化法制备高性能氮掺杂活性炭,并研究其对环丙沙星的吸附性能。
1 实验
1.1 试剂与仪器
柚子皮取自郑州农贸市场,CIP购于河南海正生物科技有限公司,尿素、氢氧化钾、盐酸均为分析纯(天津市科密欧化学试剂有限公司)。
AL204型电子分析天平;PHS-3C型精密酸度仪;ZWY-240型恒温振荡箱;TU-18型紫外可见分光光度计;JW-BK132F比表面积及孔径分析仪;PerkinElmer Spectrum Two傅里叶变换近红外光谱仪;FEI Quanta 200扫描电子显微镜;ESCALAB-250Xi X射线光电子能谱仪。
1.2 氮掺杂活性炭的制备
称取15 g粉碎干燥后的柚子皮,10 g的尿素于200 mL的不锈钢高压釜中,并加入150 mL去离子水。对不锈钢高压釜充氮气至1.0 MPa,然后以150 r/min的转速持续搅拌,以10 ℃/min的升温速度加热到220 ℃,并维持120 min进行水热碳化。反应结束后过滤,得到的产物称为水热碳。
将氢氧化钾与水热碳以质量比2.3∶1的比例充分研磨混合。将混合物放入管式炉中,在N2保护下,以10 ℃/min的加热速率加热至833 ℃,保持2.4 h。得到的煅烧产物用去离子水反复洗涤至中性,然后在80 ℃烘箱中干燥12 h,过0.178 mm筛,该产物即为氮掺杂活性炭(NAC),利用比表面积及孔径分析仪对NAC进行表征,测得其比表面积为2 481.81 cm2/g,平均孔径为2.05 nm。
1.3 实验方法
将一定量的NAC和50 mL一定质量浓度的CIP溶液放入一系列100 mL锥形瓶中,在恒温振荡箱中以150 r/min的速率振荡吸附一定时间。吸附结束后离心分离得到上层清液。使用紫外可见分光光度计在最大吸收波长276 nm下测量其吸光度,计算剩余的CIP质量浓度。NAC对CIP的吸附量qt(mg/g)和去除率r通过式(1)、(2)计算得到:
(1)
(2)
式中:C0为CIP的初始质量浓度,mg/L;Ct为t时刻CIP的质量浓度,mg/L;V为CIP溶液的体积,L;m为NAC的质量,g。
2 结果与讨论
2.1 吸附条件的优化
2.1.1 吸附剂用量对吸附过程的影响
选择CIP初始质量浓度200 mg/L,吸附平衡时间6 h,探究吸附剂用量对CIP的吸附量与去除率的影响,如图1所示。从图1中可以看出,随着吸附剂用量的升高,吸附剂NAC之间的竞争吸附导致CIP的单位质量吸附量逐渐降低,但去除率逐渐升高。当吸附剂用量为0.2 g/L时,CIP的吸附量与去除率分别为735.7 mg/g和73.57%。综合考虑,后续实验采取0.2 g/L的NAC用量。

图1 NAC的用量对CIP吸附效果的影响
Figure 1 Effect of NAC dosage on the adsorption of CIP onto NAC
2.1.2 BBD模型的建立
运用Box-Behnken中心组合设计(BBD)模型,选择吸附时间(X1)、pH(X2)和CIP初始质量浓度C0(X3)为3个变量,NAC对CIP的吸附量(qt)为响应值,建立了3因素3水平的实验模型,响应面的实验设计以及响应值如表1所示。
表1 实验设计与响应值
Table 1 Experimental design and response values

序号X1X2X3qt/(mg·g-1)吸附时间/minpHC0/(mg·L-1)实际预测1603150451.17468.7823003150612.60589.453609150496.01519.0143009150643.99626.225606100463.88445.3063006100493.88515.967606200629.42607.1783006200746.01764.3991803100464.29465.05101809100485.81481.19111803200638.39642.84121809200714.62713.69131806150684.35683.22141806150666.44683.22151806150670.90683.22161806150705.97683.22171806150688.84683.22
2.1.3 回归模型与响应面分析
使用Design-Expert 8软件对实验数据进行回归拟合分析,得到二次多项式模型方程为
qt=704.10-80.95X1+16.52X2+30.27X3-
1.90X1X2-16.15X1X3-4.66X2X3-
(3)
用于评估实验适用性的方差分析如表2所示。从表2可以看出,模型的P值<0.000 1,F值为29.15(大于5),表明模型的拟合结果显著。失拟项的P值为0.087 2(大于0.05),说明失拟项不显著,此模型拟合比较可靠。
表2 CIP吸附模型的方差分析
Table 2 ANOVA of empirical models for CIP adsorption
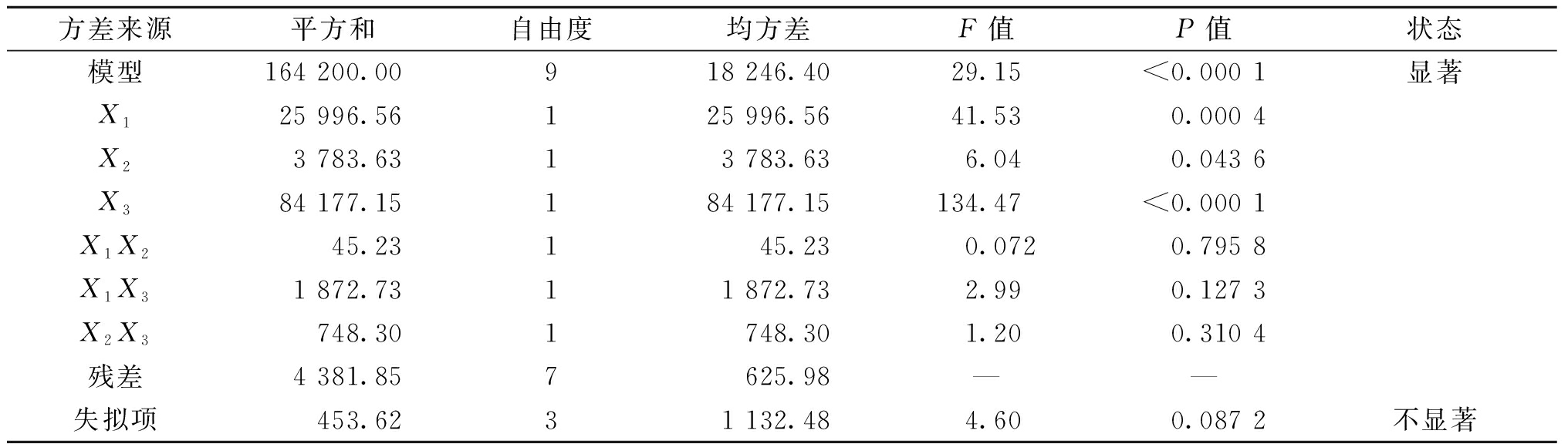
方差来源平方和自由度均方差F值P值状态模型164 200.00918 246.4029.15<0.000 1显著X125 996.56125 996.5641.530.000 4X23 783.6313 783.636.040.043 6X384 177.15184 177.15134.47<0.000 1X1X245.23145.230.0720.795 8X1X31 872.7311 872.732.990.127 3X2X3748.301748.301.200.310 4残差4 381.857625.98——失拟项453.6231 132.484.600.087 2不显著
2.1.4 三维响应面分析
以CIP的吸附量为响应值,不同变量间相互作用的三维响应面图如图2所示。从图2可以看出,随着pH的升高,CIP吸附量(qt)先迅速增加,然后降低;随着吸附时间的增加,qt值先增加然后趋于稳定;qt值随CIP的初始质量浓度的升高而不断增加。通过对方程(3)求偏导数,令偏导数等于0得到NAC吸附CIP的最佳吸附条件:吸附时间254.9 min、pH6.7、CIP初始质量浓度200 mg/L,预测吸附量757.03 mg/g。在最佳条件下进行了5组平行实验,CIP的吸附量分别为749.08、752.38、755.67、750.25、760.98 mg/g,与预测值接近,表明该模型可用于优化NAC对CIP的吸附条件。
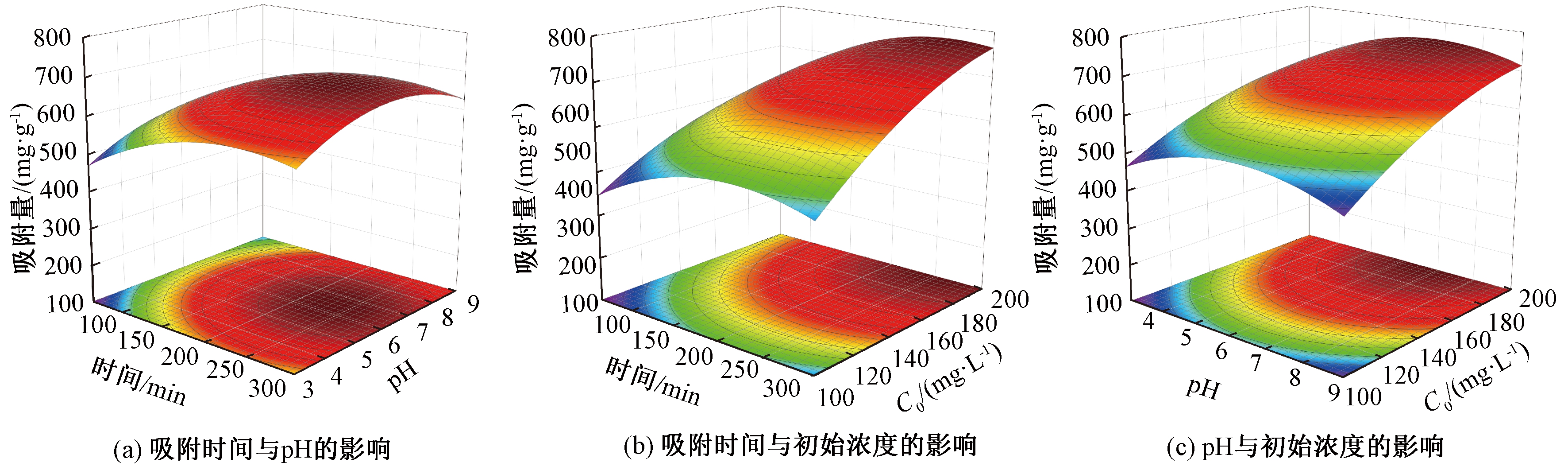
图2 CIP吸附的三维响应图
Figure 2 Three-dimensional response surface plots of CIP adsorption
2.2 吸附等温线
为了研究NAC与CIP之间的吸附行为,采用Langmuir、Freundlich和Koble-Corrigan等温模型对实验数据进行拟合。实验数据与模型计算数据之间的差异用χ2检测:
(4)
式中:qe,exp为实际吸附量,mg/g;qe,cal为预测吸附量,mg/g。
选择吸附剂用量0.2 g/L、吸附时间254.9 min,观察不同温度下CIP初始质量浓度对吸附的影响。对实验平衡数据拟合结果见图3及表3。
表3 NAC吸附CIP的吸附等温线参数
Table 3 Parameters of adsorption isotherm for CIP onto NAC
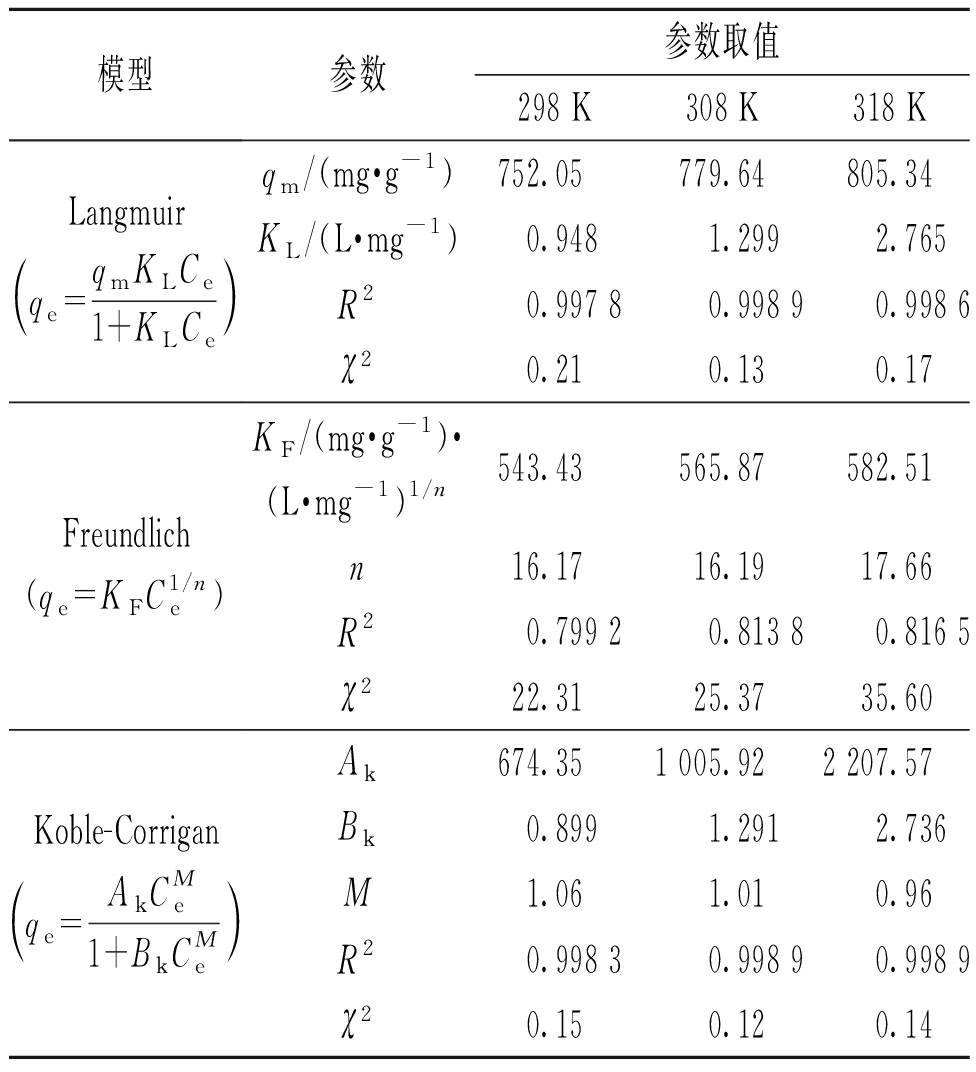
模型参数参数取值298 K308 K318 KLangmuirqe=qmKLCe1+KLCe Freundlich(qe=KFC1/ne)Koble-Corriganqe=AkCMe1+BkCMe qm/(mg·g-1)752.05 779.64805.34KL/(L·mg-1)0.9481.2992.765R20.997 80.998 90.998 6χ20.210.130.17KF/(mg·g-1)·(L·mg-1)1/n543.43565.87582.51n16.1716.1917.66R20.799 20.813 80.816 5χ222.3125.3735.60Ak674.351 005.922 207.57Bk0.8991.2912.736M1.061.010.96R20.998 30.998 90.998 9χ20.150.120.14
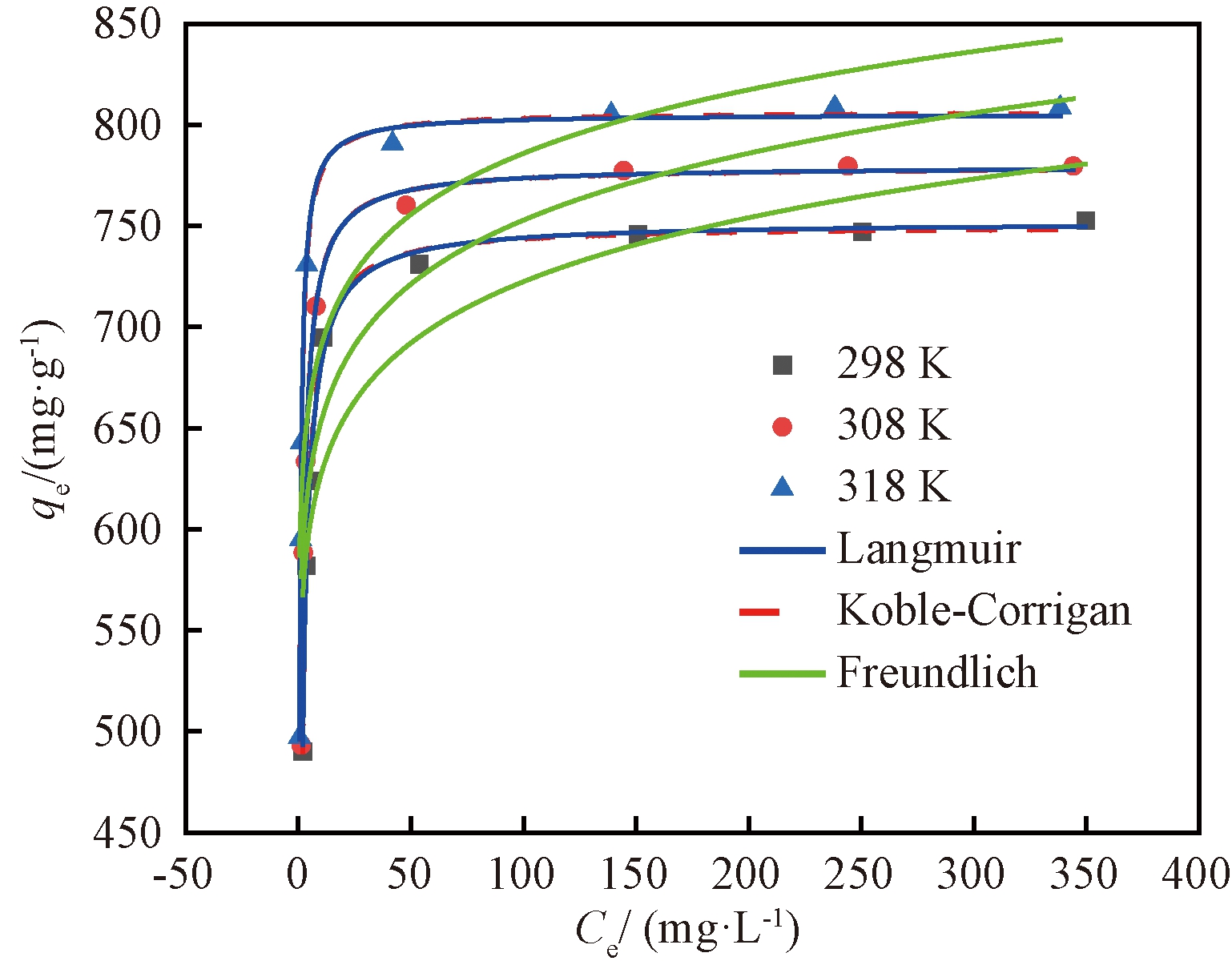
图3 等温模型对实验数据的非线性拟合
Figure 3 Non-linear fitting of experimental data with isotherms models
Koble-Corrigan模型在3个温度下的R2均大于0.99且χ2均小于0.2,Ak、Bk、M随着温度的升高均有规律地变化,说明Koble-Corrigan模型可以很好地描述NAC对CIP的吸附过程。参数M的值在1附近,表明吸附过程符合单分子层吸附的Langmuir模型[6]。在温度为298 K时,NAC的最大单分子层吸附量为752.05 mg/g。
在Freundlich模型中,不同温度下均有0<1/n<1,说明NAC对CIP的吸附非常容易进行,然而其相关系数R2均小于0.9, χ2较大,说明这个模型不能很好地描述NAC对CIP的吸附过程。
各种材料对CIP的吸附能力如表4所示。与其他材料相比,NAC的比表面积更大且具备更丰富的官能团,对CIP具有极其优异的吸附能力。
表4 不同吸附剂对CIP吸附能力比较
Table 4 Comparison of adsorption capacity of CIP onto different adsorbents
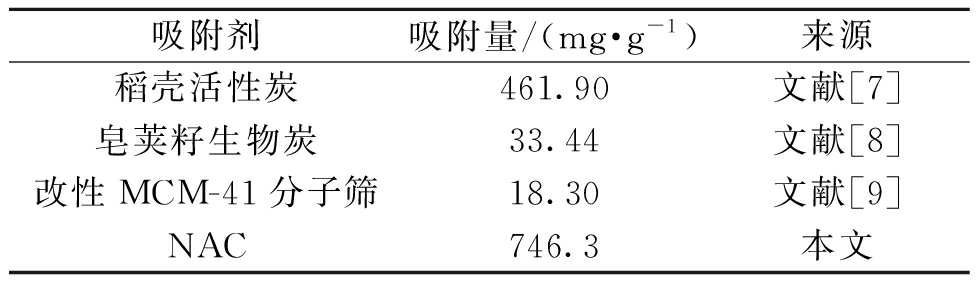
吸附剂吸附量/(mg·g-1)来源稻壳活性炭461.90文献[7]皂荚籽生物炭33.44文献[8]改性MCM-41分子筛18.30文献[9]NAC746.3本文
2.3 热力学参数计算
热力学参数吉布斯自由能变化(ΔG,kJ/mol)、焓变(ΔH,kJ/mol)和熵变(ΔS,kJ/(mol·K))之间的关系[10]为
ΔG=-RTlnKC;
(5)
ΔG=ΔH-TΔS。
(6)
式中:KC为平衡常数(无量纲),KC=106KL;KL为Langmuir平衡常数,L/mg;106为溶液密度(假设纯水密度为1.0 g/mL;T为吸附温度,K;R为通用气体常数,J/(mol·K)。
在298、308和318 K温度下,NAC吸附CIP的ΔG值分别为-28.39、-30.15、-33.12 kJ/mol。不同温度下ΔG的负值表明NAC吸附CIP的吸附过程是自发进行。ΔH为42.29 kJ/mol,表明吸附过程本质上是吸热过程。ΔS为正值(0.23 kJ/(mol·K)),说明该吸附过程为熵增过程。
2.4 吸附动力学分析
为研究吸附量与吸附时间之间的关系,使用准一级、准二级动力学模型和颗粒内扩散模型(式(7)~(9))来拟合吸附数据。
qt=qe(1-e-k1t);
(7)
(8)
qt=ktit1/2+C。
(9)
式中:qt和qe分别为t时刻与平衡时刻的吸附量,mg/g;k1为准一级动力学模型的速率常数,min-1;k2为准二级动力学模型的速率常数,g/(mg·min1/2);kti为粒子内扩散模型的速率常数,mg/(g·min1/2);C为与边界层厚度有关的常数。
选择CIP初始质量浓度200 mg/L,吸附剂用量为0.2 g/L,考察吸附时间以及温度对吸附过程的影响。按式(7)~(9)对实验数据进行拟合,结果见图4及表5。从图4(a)可以看出,在前30 min,NAC对CIP的吸附速率极快,然后随着吸附时间的增加,逐渐趋于平衡。从表5看出,准二级动力学的R2均大于0.99,并且qexp和qcal接近,说明准二级动力学模型可以很好地描述该吸附过程。准二级动力学模型是一个以化学吸附为主的单分子层吸附过程,此结果与热力学结果一致[6]。吸附速率常数k2随着温度的升高而增大,说明升高温度有利于吸附的进行。从图4(b)可以看出,吸附过程可以分为3阶段:①CIP分子从溶液扩散到NAC边界层;②CIP分子从边界层扩散至NAC孔隙结构中;③吸附达到平衡。NAC对CIP的吸附包括多个控制过程,受颗粒内扩散与膜扩散的共同影响。相同温度下,速率常数kt1>kt2>kt3。
表5 吸附动力学参数
Table 5 Parameters of adsorption kinetic models
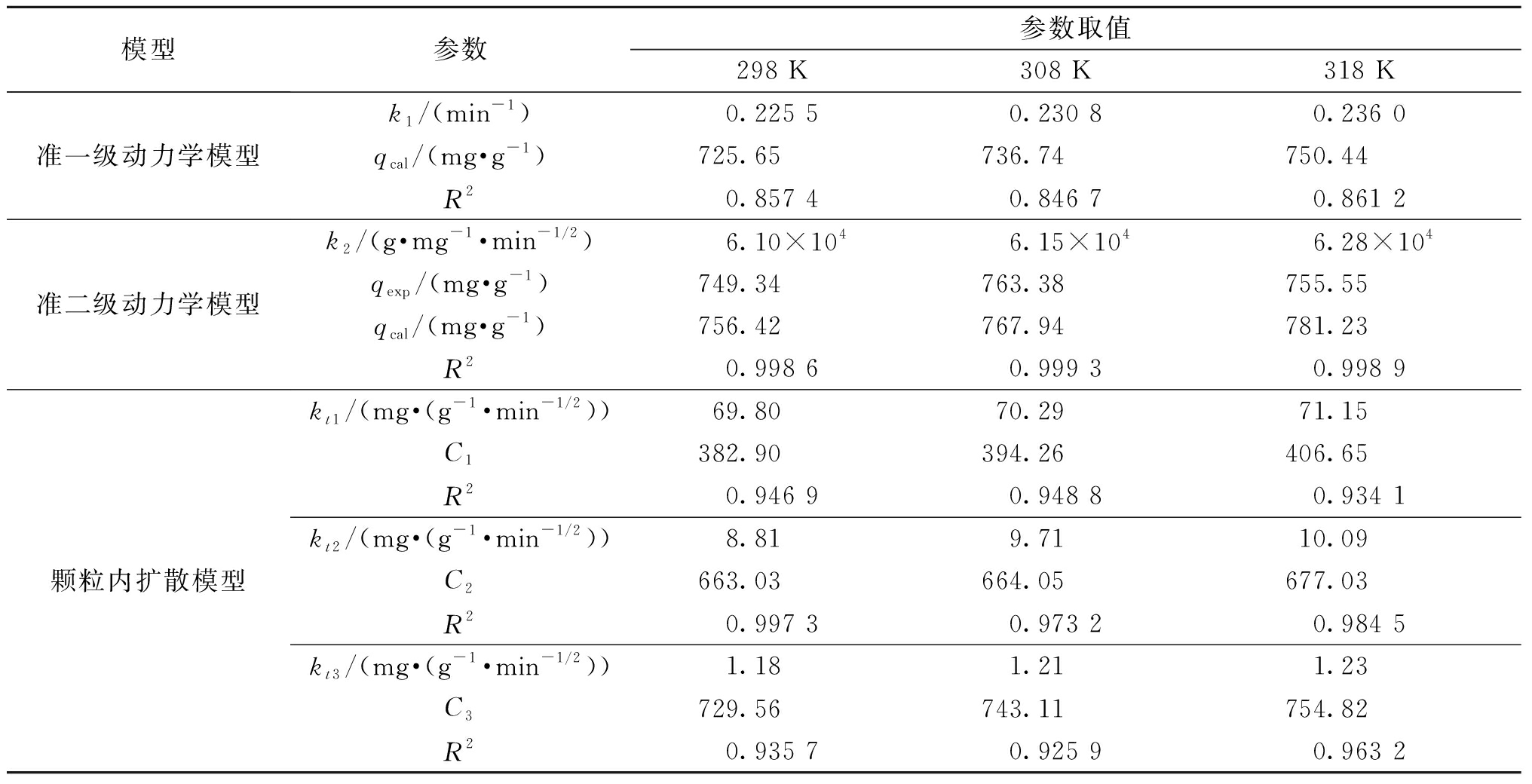
模型参数参数取值298 K308 K318 K准一级动力学模型准二级动力学模型颗粒内扩散模型k1/(min-1)0.225 50.230 80.236 0qcal/(mg·g-1)725.65736.74750.44R20.857 40.846 70.861 2k2/(g·mg-1·min-1/2)6.10×1046.15×1046.28×104qexp/(mg·g-1)749.34763.38755.55qcal/(mg·g-1)756.42767.94781.23R20.998 60.999 30.998 9kt1/(mg·(g-1·min-1/2))69.8070.2971.15C1382.90394.26406.65R20.946 90.948 80.934 1kt2/(mg·(g-1·min-1/2))8.819.7110.09C2663.03664.05677.03R20.997 30.973 20.984 5kt3/(mg·(g-1·min-1/2))1.181.211.23C3729.56743.11754.82R20.935 70.925 90.963 2
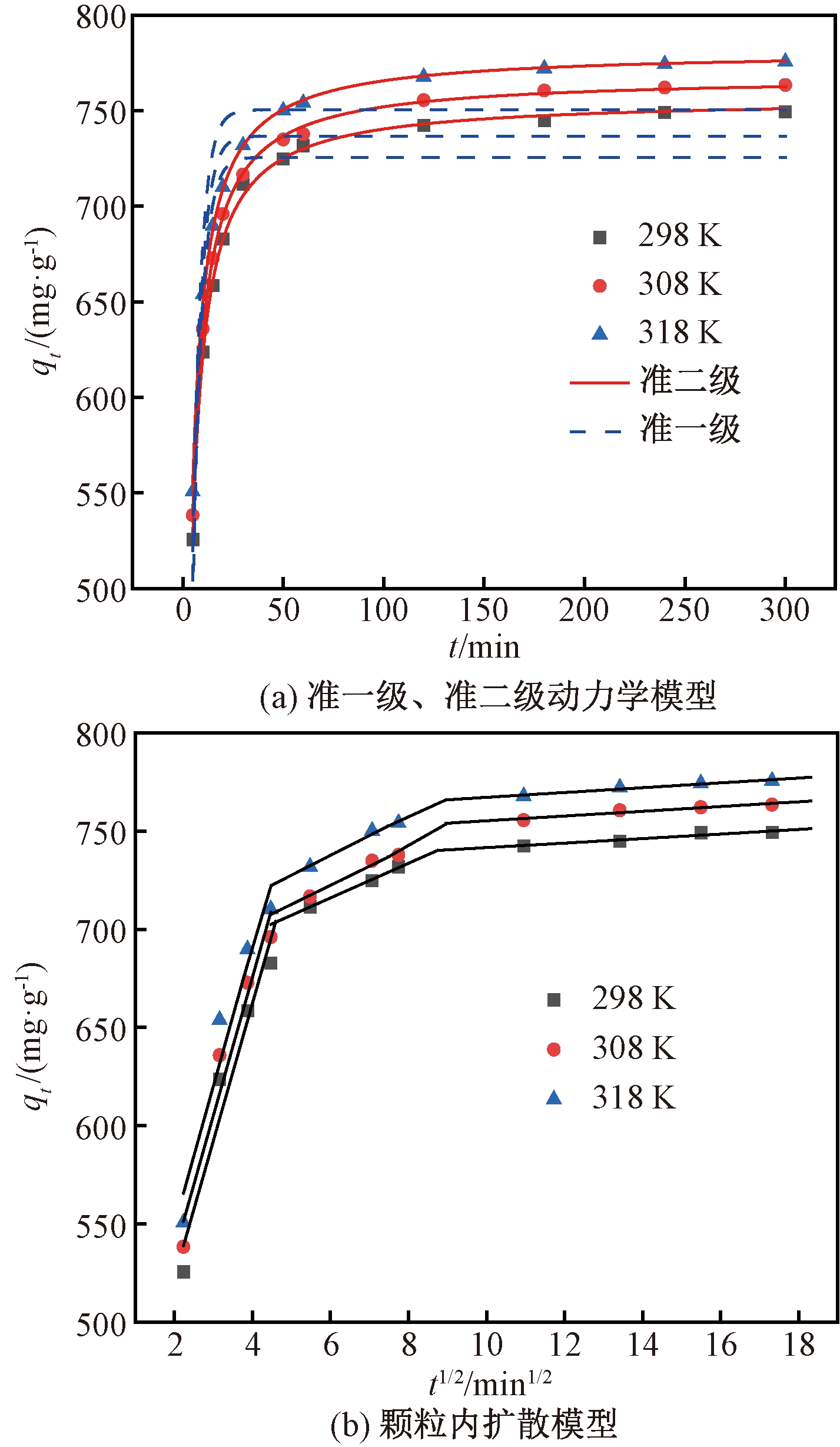
图4 准一级、准二级动力学模型和颗粒内扩散模型对CIP吸附实验数据的回归曲线
Figure 4 Regression curves of experimental data for CIP adsorption with pseudo first-order,pseudo second-order and intra-particle diffusion kinetic models
2.5 红外光谱分析
CIP和NAC吸附CIP前后的FTIR图如图5所示。在3 400 cm-1左右处的特征峰与羟基的伸缩振动有关。在CIP的FTIR图中,1 705 cm-1与1 621 cm-1处的特征峰分别是羰基(ν(C![]() O))和芳香环的特征吸收峰,1 395 cm-1处的波峰则为质子化的氨基的特征峰[11]。
O))和芳香环的特征吸收峰,1 395 cm-1处的波峰则为质子化的氨基的特征峰[11]。
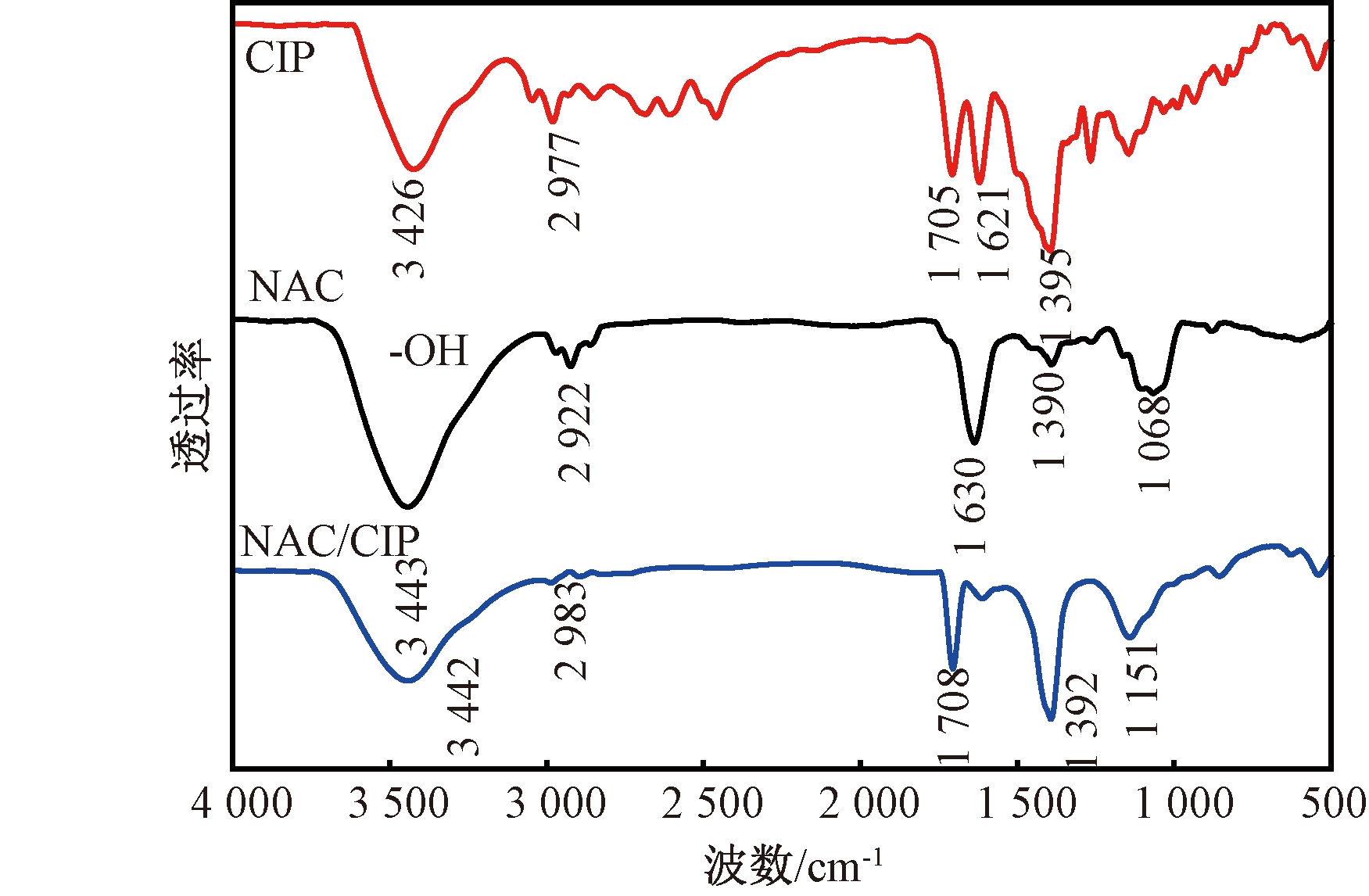
图5 CIP、NAC吸附CIP前后的FTIR图
Figure 5 FTIR spectra of CIP, NAC before and after adsorption CIP
从NAC的FTIR图可以看出,1 630 cm-1、1 390 cm-1以及1 068 cm-1的吸收峰分别为C![]() O、氨基和C—O伸缩振动所致。从NAC吸附CIP前后的FTIR图对比可以看出,吸收峰位置和强度发生了变化。1 708 cm-1处出现的波峰是由CIP上羰基的伸缩振动所致,此外,1 392 cm-1处质子化的氨基的峰的强度明显增加,均表明CIP成功吸附在了NAC的表面。
O、氨基和C—O伸缩振动所致。从NAC吸附CIP前后的FTIR图对比可以看出,吸收峰位置和强度发生了变化。1 708 cm-1处出现的波峰是由CIP上羰基的伸缩振动所致,此外,1 392 cm-1处质子化的氨基的峰的强度明显增加,均表明CIP成功吸附在了NAC的表面。
2.6 SEM分析
NAC的表面形态如图6所示。NAC的表面具有发达的孔隙结构和丰富的微孔结构。这些孔隙增大了NAC的比表面积,为CIP的孔/尺寸选择性吸附提供了更好的条件,提高了CIP吸附量。

图6 NAC的 SEM图
Figure 6 SEM image of NAC
2.7 X射线光电子能谱分析
NAC吸附CIP前后的N1s谱图以及C1s谱图如图7所示。
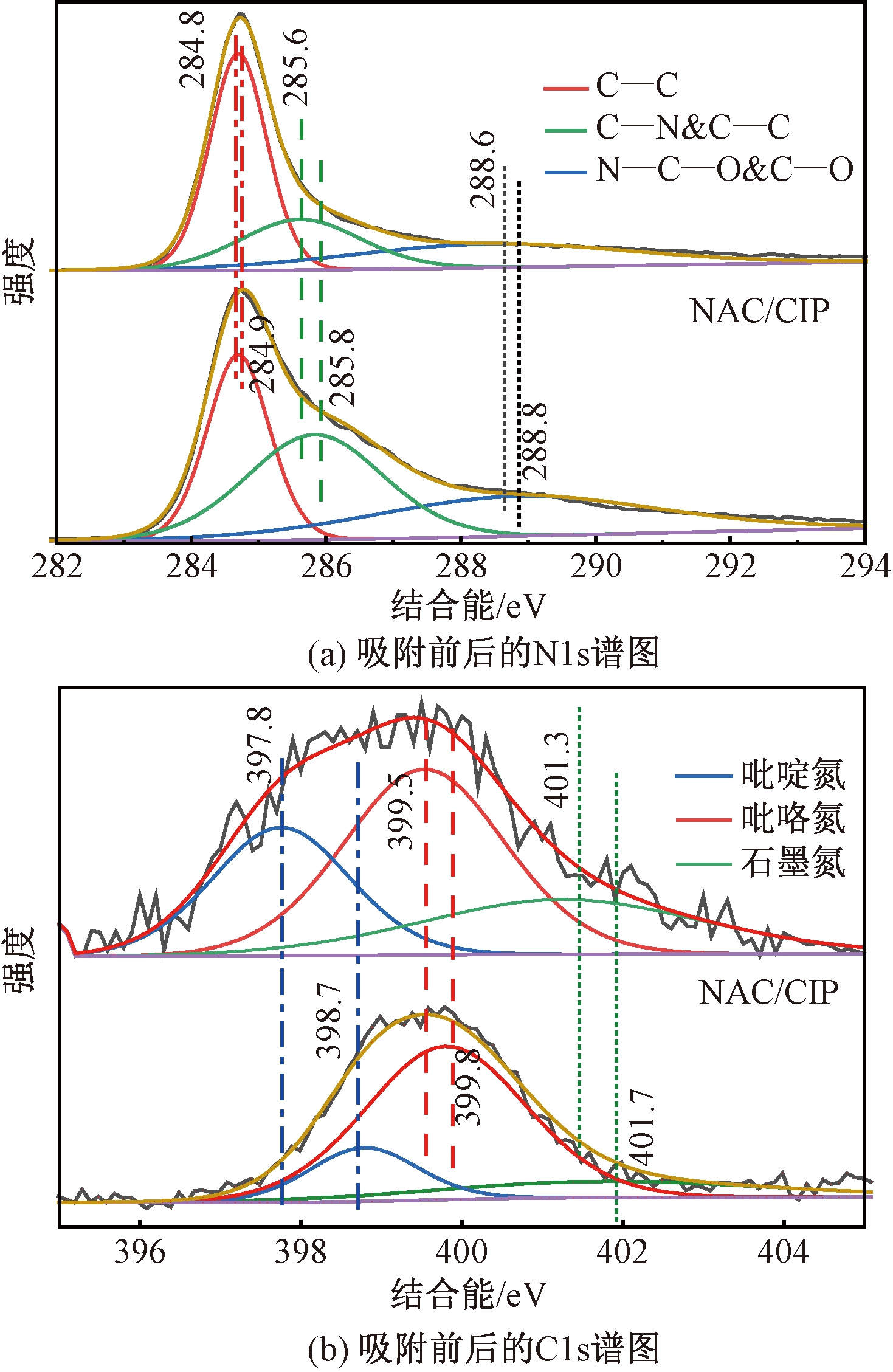
图7 NAC吸附前后的XPS谱图
Figure 7 XPS spectra of NAC before and after adsorption
从图7(a)中可以看出,C1s在284.8、285.6、288.6 eV的特征峰分别为C![]() C、C—N &C—C和N—C—O &C
C、C—N &C—C和N—C—O &C![]() O的特征峰。吸附CIP后O—C—N/C
O的特征峰。吸附CIP后O—C—N/C![]() O的结合能从288.6 eV变化到288.8 eV,这可能是由CIP上的—OH、NH2和—NH—基团与NAC表面的C
O的结合能从288.6 eV变化到288.8 eV,这可能是由CIP上的—OH、NH2和—NH—基团与NAC表面的C![]() O通过氢键相互作用引起的。同样,NAC表面的—OH、—NH—基团与CIP上的C
O通过氢键相互作用引起的。同样,NAC表面的—OH、—NH—基团与CIP上的C![]() O相互作用也会引起O—C—N/C
O相互作用也会引起O—C—N/C![]() O峰的偏移。吸附CIP后,C
O峰的偏移。吸附CIP后,C![]() C峰的结合能从284.8 eV变为284.9 eV,这可能是由于CIP具有很强的电负性作为π-受体与NAC形成π-π相互作用[12]。
C峰的结合能从284.8 eV变为284.9 eV,这可能是由于CIP具有很强的电负性作为π-受体与NAC形成π-π相互作用[12]。
图7(b)为NAC吸附CIP前后N1s的特征峰,N1s在397.8、399.5、401.3 eV处的峰分别为吡啶氮、吡咯氮、石墨氮的特征峰[13]。吸附CIP后,吡啶氮的结合能从397.8 eV移动到398.7 eV,这可能是由于NAC与CIP之间存在疏水作用引起的[14]。NAC吸附CIP后吡咯氮的结合能从399.5 eV移动到399.8 eV。吡咯氮是氮原子结合到杂环中形成的,可以作为路易斯碱位与CIP分子上的路易斯酸位点(—OH)相结合[15]。其中,吸附前后吡啶氮的结合能变化最大,疏水作用可能是吸附过程中的主要原因。
2.8 pH值对吸附的影响和吸附机理探讨
选取NAC对CIP的最佳吸附条件,考察溶液pH值对吸附的影响,结果见图8。从图8看出,当溶液pH值从3升高到10,CIP的吸附量先增加然后逐渐降低。经测定,NAC的等电点(pHpzc)约等于8,即当pH<8时,NAC表面带正电荷;当pH>8时,NAC表面为负电荷。CIP的两个电离常数分别为5.90与8.89,不同pH下CIP的分布系数见图8。当pH

图8 不同pH下CIP的分布系数以及pH对NAC吸附环丙沙星的影响
Figure 8 Distribution coefficient of CIP and effect of pH on the adsorption of ciprofloxacin
NAC对CIP的高吸附量主要取决于氢键、π-π相互作用、疏水作用和路易斯酸碱效应共同影响。此外,静电作用对NAC吸附CIP也有一定影响。当pH
2.9 NAC再生性能研究
吸附材料的再生性能是其重要的性质之一,使用0.1 mol/L的HCl溶液对吸附CIP的NAC进行脱附,再生后的NAC用于下一批次吸附实验,经过5次的吸附-脱附实验,结果如图9所示。
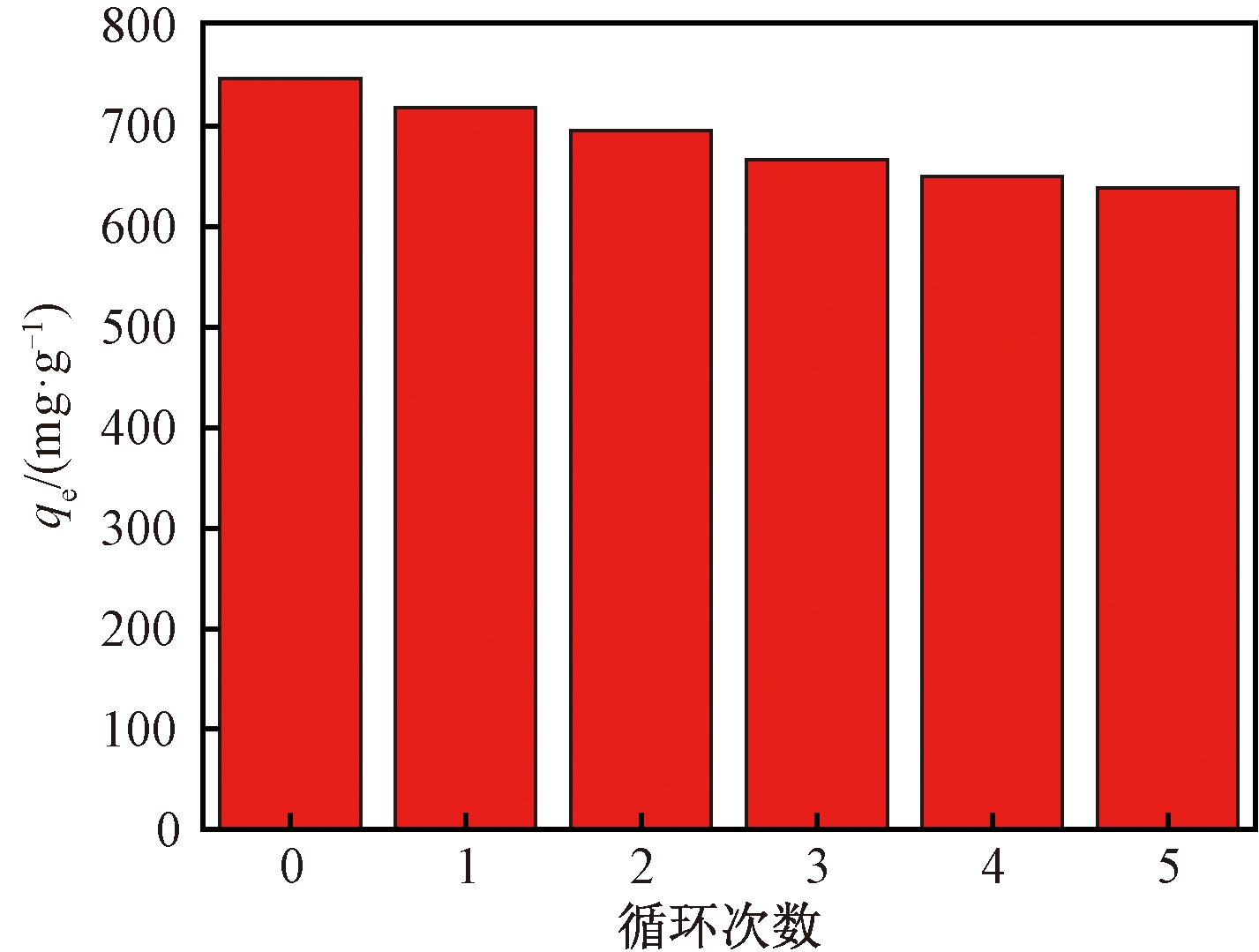
图9 循环次数对NAC吸附能力的影响
Figure 9 Effect of cycle number on the adsorption capacity of NAC
由图9可知,经过5次吸附-脱附实验后,NAC对CIP的吸附量仍可达到638.57 mg/g,说明NAC具备很好的再生性能。
3 结论
以农业废弃物柚子皮为原材料,采用水热碳化和氢氧化钾活化方法制备了高性能的N掺杂活性炭。利用响应面分析方法对吸附条件进行优化,得到最佳吸附条件:吸附时间254.9 min、pH为6.7、CIP初始质量浓度为200 mg/L。热力学研究表明Langmuir和K-C等温模型能够很好地描述NAC吸附CIP的吸附过程。298 K时,NAC的最大单分子层吸附量为752.05 mg/g。动力学数据符合准二级动力学模型;颗粒内扩散模型表明吸附过程受颗粒内扩散和边界层扩散联合控制。制备的氮掺杂活性炭对环丙沙星有较高的吸附性能,为抗生素废水的处理提供了一种新途径。
[1] GITHINJI L J M, MUSEY M K, ANKUMAH R O. Evaluation of the fate of ciprofloxacin and amoxicillin in domestic wastewater[J]. Water, Air, &Soil Pollution, 2011, 219(1/2/3/4): 191-201.
[2] MOVASAGHI Z, YAN B, NIU C. Adsorption of ciprofloxacin from water by pretreated oat hulls: equilibrium, kinetic, and thermodynamic studies[J]. Industrial Crops and Products, 2019, 127: 237-250.
[3] HUANG L H, WANG M, SHI C X, et al. Adsorption of tetracycline and ciprofloxacin on activated carbon prepared from lignin with H3PO4 activation[J]. Desalination and Water Treatment, 2014, 52(13/14/15): 2678-2687.
[4] 炊宁博, 黄佳佳, 原思国, 等. 新型N、S共掺杂微孔碳材料的制备及性能研究[J]. 郑州大学学报(工学版), 2020, 41(5): 21-25, 36.
CHUI N B, HUANG J J, YUAN S G, et al. Preparation and properties of novel N, S-codoped microporous carbon[J]. Journal of Zhengzhou University (Engineering Science), 2020, 41(5): 21-25, 36.
[5] AHMED I, ADHIKARY K K, KIM K, et al. Aqueous adsorption of sulfamethoxazole on an N-doped zeolite beta-templated carbon[J]. Journal of Colloid and Interface Science, 2021, 582: 467-477.
[6] SUN Z Q, ZHAO L, LIU C H, et al. Fast adsorption of BPA with high capacity based on π-π electron donor-acceptor and hydrophobicity mechanism using an in situ sp2 C dominant N-doped carbon[J]. Chemical Engineering Journal, 2020, 381: 122510.
[7] ZHANG B P, HAN X L, GU P J, et al. Response surface methodology approach for optimization of ciprofloxacin adsorption using activated carbon derived from the residue of desilicated rice husk[J]. Journal of Molecular Liquids, 2017, 238: 316-325.
[8] VELUSAMY K, PERIYASAMY S, KUMAR P S, et al. Analysis on the removal of emerging contaminant from aqueous solution using biochar derived from soap nut seeds[J].Environmental Pollution,2021,287:117632.
[9] LU D W, XU S, QIU W, et al. Adsorption and desorption behaviors of antibiotic ciprofloxacin on functionalized spherical MCM-41 for water treatment[J]. Journal of Cleaner Production, 2020, 264: 121644.
[10] TRAN H N, YOU S J, HOSSEINI-BANDEGHARAEI A, et al. Mistakes and inconsistencies regarding adsorption of contaminants from aqueous solutions: a critical review[J]. Water Research, 2017, 120: 88-116.
[11] ROCA JALIL M E, BASCHINI M, SAPAG K. Influence of pH and antibiotic solubility on the removal of ciproflo-xacin from aqueous media using montmorillonite[J]. Applied Clay Science, 2015, 114: 69-76.
[12] YAN B, NIU C H, WANG J. Kinetics, electron-donor-acceptor interactions, and site energy distribution analyses of norfloxacin adsorption on pretreated barley straw[J].Chemical Engineering Journal,2017,330:1211-1221.
[13] 李凌峰. 氮掺杂活性炭表面SO2吸附特性研究[D]. 济南: 山东大学, 2021.
LI L F. Study on SO2 adsorption characteristics on the surface of nitrogen-doped activated carbon[D]. Jinan: Shandong University, 2021.
[14] FANG X, WU S B, WU Y H, et al. High-efficiency adsorption of norfloxacin using octahedral UIO-66-NH2 nanomaterials: dynamics, thermodynamics, and mechanisms[J].Applied Surface Science,2020,518:146226.
[15] WANG L L, ZHU D Q, DUAN L, et al. Adsorption of single-ringed N- and S-heterocyclic aromatics on carbon nanotubes[J]. Carbon, 2010, 48(13): 3906-3915.