世界上每年由于创伤、衰老、感染或肿瘤引起的骨缺损给数以万计的患者带来了巨大的痛苦。由于该类骨科疾病的特殊性,选用合适的材料进行修复或替代是常用的治疗手段。目前治疗骨缺损所用的材料来源有自体移植、异体移植和人工合成生物材料3大类。
自体移植是治疗严重骨缺损的金标准,具有实现骨传导、骨诱导和成骨所需的成分,且不会导致免疫排斥反应,但自体移植存在手术费用昂贵,缺少足够供体供应和会导致供体部位损伤、疾病等问题[1]。异体移植是从活体人类供体、尸体或异种移植物(动物来源)中获取骨骼的骨移植过程[2],与自体移植相比,异体移植解决了供体不足的问题,但同时也带来了不同的重塑动力学、免疫原性反应风险和病毒病理学传播等问题[3]。
相对于自体移植和异体移植材料来源的局限性,人工合成生物材料具有材料来源广泛、生物相容性好、对机体无毒副作用、无免疫排斥反应等优点,为骨缺损治疗带来了新希望[4]。使用人工合成的生物材料作为长期骨替代材料成为一种有广阔前景的治疗手段。
1 骨替代材料的生物和物化性能
理想的骨替代材料需要良好的生物性能,主要包括生物相容性、骨传导性、骨诱导性、骨整合性。骨替代材料需要整合到天然骨中以增强组织修复过程,这就要求其具有高度生物相容性;骨传导性是其为新生血管向内生长和成骨前体细胞浸润提供一种支架或网格,以加快与宿主骨之间的骨整合;骨诱导性是其释放某种因子或物质,刺激骨祖细胞分化为成骨细胞,从而刺激新骨形成;骨整合性是其与骨组织之间呈现无纤维结缔组织界面层直接接触的性能,与天然骨形成骨键合,这是决定骨植入材料修复效果的关键因素之一。
理想的骨替代材料还应具有合适的物理和化学性能。骨替代材料应具有与骨骼相近的弹性模量[5]、优异的硬度、足够的抗压强度、良好的断裂韧性,这不仅能避免应力屏蔽效应、天然骨和骨替代材料之间的磨损,还能避免在新骨形成之前出现骨缺损区塌陷和脆性断裂;骨替代材料应能抵抗人体内环境的腐蚀和溶解,若有轻微的溶解现象发生,则必须证明溶解物对人体无毒害、无致癌作用;此外,骨替代材料还应具有原料易于获取、加工和消毒的优点。
理想的骨替代材料需要满足生物、物化方面众多性能需求(如图1所示),实际使用中人工骨替代材料往往难以同时满足,这可能会导致某些种植体在使用初期由于磨损、感染、弹性模量不匹配、强度低等原因而失效,需要二次手术,增加了手术成本和患者的痛苦[6]。因此,研究和制备理化性能合适、生物性能优异且具有较长使用寿命的骨替代材料是解决问题的关键。
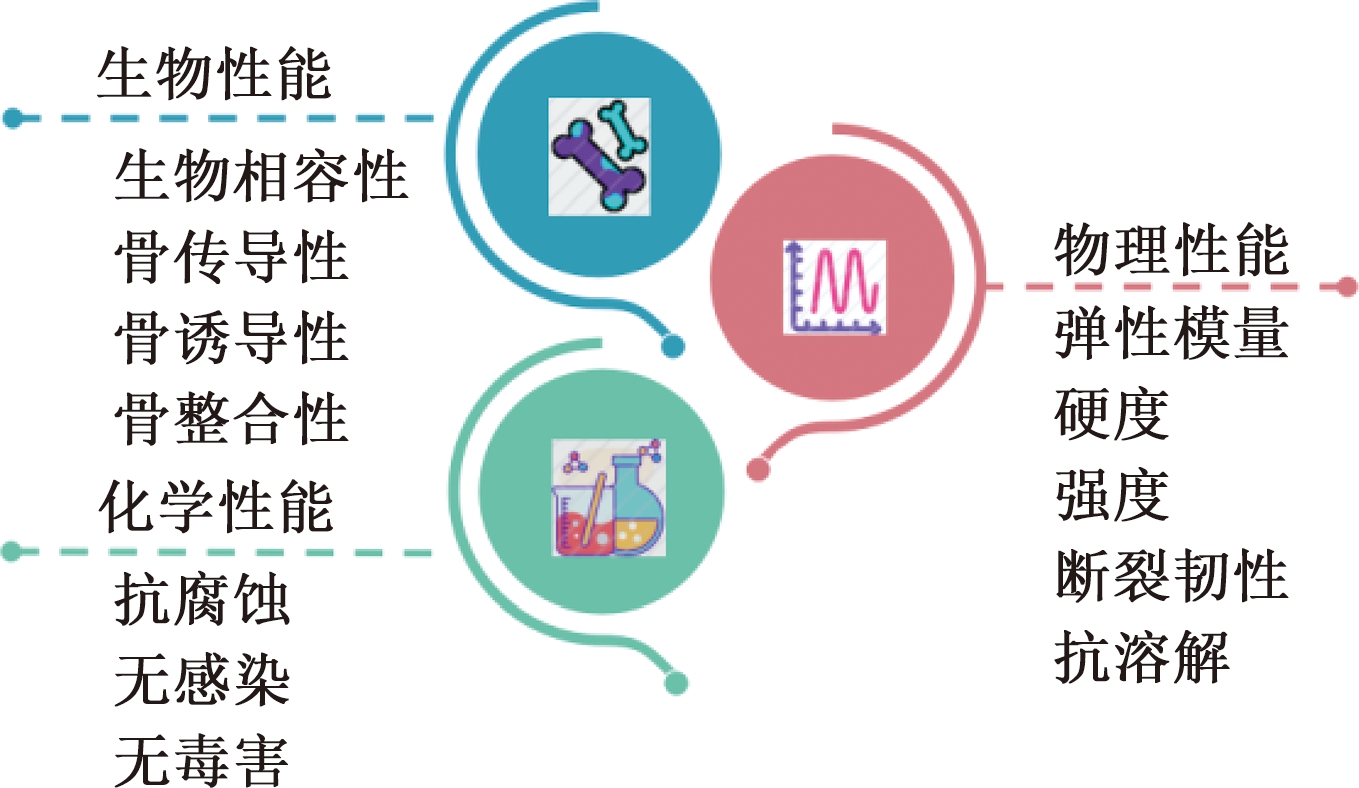
图1 理想骨替代材料所需的性能
Figure 1 Performance required for the ideal bone substitute material
2 骨替代材料的研究现状
高分子材料、金属材料、生物陶瓷及复合材料均是研究和制备人工骨替代材料的候选者。用于人工骨替代材料的天然高分子材料有壳聚糖、胶原蛋白、海藻酸盐、透明质酸等;合成高分子材料主要有聚乳酸、聚己内酯、聚醚醚酮等。虽然高分子材料生物相容性好、安全无毒、形状容易设计,但因其表面易磨损、负重能力差而不能应用到关节和承重部位,故高分子材料主要用于骨组织工程支架材料的制备[7]。金属材料具有较高的强度和断裂韧性,在承载应用中比高分子材料更有优势。不锈钢和钴基合金是传统的骨替代材料,通常用于承载骨科植入物和骨折的固定;钛及钛合金[8]以优异的综合力学性能、无毒、良好的耐腐蚀性在骨科和牙科领域应用广泛;新型的镁和镁合金材料[9]由于具有生物降解性,可避免二次手术,使其在矫形植入材料中受到广泛关注。但金属材料也普遍存在金属疲劳、易腐蚀、应力屏蔽和磨损等问题,导致易发生骨溶解、感染等不良反应。生物陶瓷材料由于其密度和成分与人骨相似、化学性质稳定、机械强度高、耐腐蚀、生物相容性好等优点在医疗行业中的应用广泛[10]。表1列出了6种典型骨替代材料的性能对比。生物陶瓷材料因性能优异,且可通过与陶瓷或与其他种类的复合以改善其综合性能,在当今的骨替代材料中扮演着重要角色。因此,本文将着重论述以磷酸盐、硅酸盐、氧化物和非氧化物为代表的生物陶瓷的研究现状。
表1 6种典型骨替代材料的性能对比
Table 1 Comparison of properties of six typical bone substitute materials

材料生物相容性生物活性耐压强度断裂韧性耐腐蚀性聚乳酸优良良好差良好良好钛合金良好无优良良好差羟基磷灰石优良一般良好差优良硅酸钙优良优良良好差优良氧化铝良好无优良差优良氮化硅良好一般优良一般优良
2.1 磷酸盐生物陶瓷材料
如图2所示,天然骨主要是由I型胶原蛋白有机相和羟基磷灰石晶体无机相以特定的结构排列而成[11]。骨基质中的羟基磷灰石晶体与胶原蛋白相结合而被保护,在人体不会被降解。而人工合成的磷酸盐材料由于缺少I型胶原蛋白的保护,在人体环境中被降解成Ca2+、PO45-或类骨磷灰石微晶,这些释放物可促使骨细胞分化、增殖而形成新的骨骼。因此,磷酸盐生物陶瓷具有良好的生物相容性、骨传导性、生物活性,使其被广泛应用于牙科植入物、骨填充、骨移植、脊柱融合和药物释放系统等领域[12-13]。目前,用于骨修复和骨替代的磷酸盐生物陶瓷的钙磷摩尔比为1.50~1.67,主要包括羟基磷灰石(HAp)、磷酸三钙(TCP)、双相磷酸钙(BCP)、磷酸八钙(OCP)、焦磷酸钙(CPP)、磷酸氢钙(DCP)、磷酸镁等。
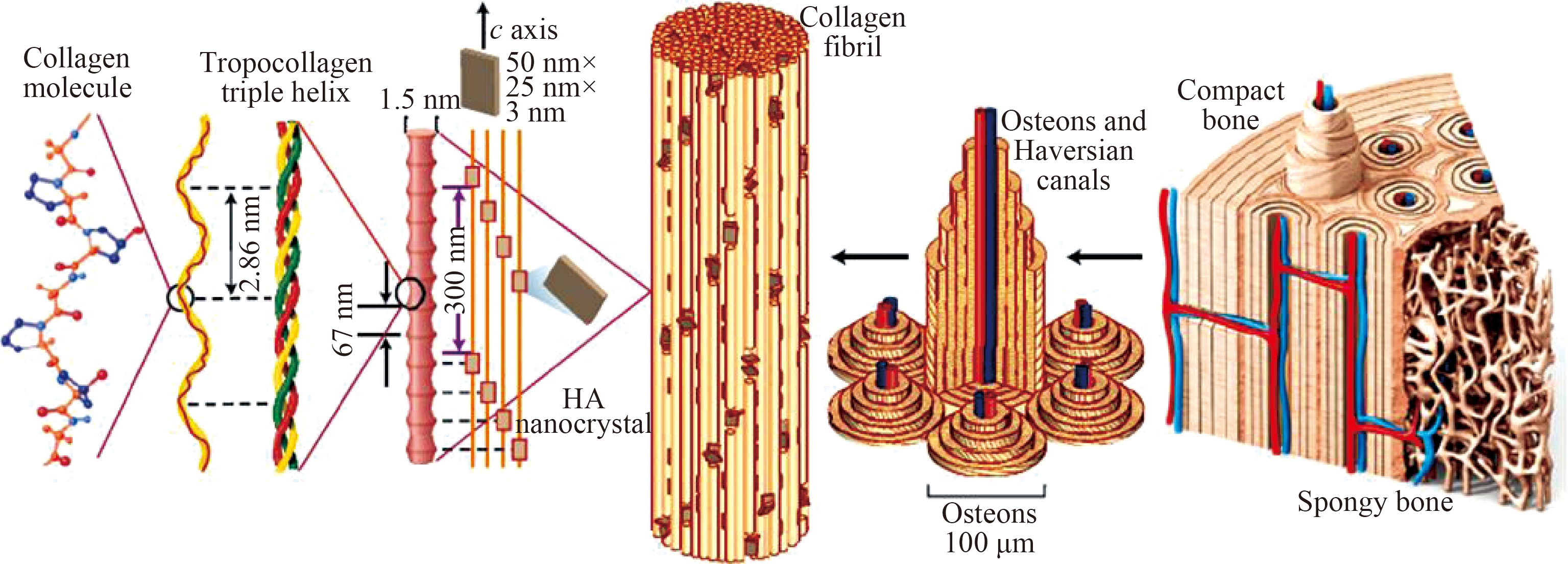
图2 骨的层次结构[11]
Figure 2 Hierarchical structure of bone[11]
羟基磷灰石(HAp)的化学成分和晶体结构与天然骨中无机相一致,是研究最广泛的磷酸钙陶瓷之一。但其断裂韧性差、脆性大,通过对HAp的离子取代或与其他材料复合是改善力学性能、提高生物相容性、骨诱导性,赋予特殊性能的解决方案[14]。其中,通过将HAp与β-TCP生物陶瓷复合制备双相磷酸钙(BCP)[15]是研究的热点之一。BCP陶瓷克服了β-TCP降解速率过快导致与骨的生长速率不匹配的问题,平衡了羟基磷灰石和β-TCP的稳定性,多应用于生物陶瓷支架、治疗骨或牙本质缺损等领域,但BCP生物陶瓷同样存在容易脆性断裂的问题。OCP和CPP等磷酸盐尽管具有优异的生物活性和可降解性,可用于制备成多孔的支架材料、诱导组织与血管的再生,但因其固有的脆性,易断裂,同时存在降解速率与骨生长速率不匹配等问题在骨替代领域应用受限。
通常将磷酸盐生物陶瓷材料用于金属基底等材料的涂层来提高材料的生物活性,但由于金属材料和无机材料化学键性质差别较大,二者难以形成牢固的化学键合,故存在涂层容易脱落、界面不稳定、两者热膨胀系数不匹配等问题。
2.2 硅酸盐生物陶瓷材料
磷酸盐材料通常不具有骨诱导性,而硅酸盐材料中Si4+可促进骨形成、参与骨基质的早期矿化,并在促进骨形成的代谢中发挥重要作用[16],同时可能影响蛋白质分泌、细胞存活、凋亡,对成骨细胞和细胞外基质有刺激作用[17]。鉴于这些特点,硅酸盐生物陶瓷已被广泛用于诱导骨再生的骨修复材料。常用的硅酸盐生物陶瓷有硅酸钙(CaSiO3)、透辉石(CaMgSi2O6)、镁黄长石(Ca2MgSi2O7)、闪锌矿(Ca7MgSi4O16)、硬石膏(Ca2ZnSi2O7)、镁橄榄石(Mg2SiO4)等。
硅酸钙通常用于制备骨组织工程支架材料。研究表明,该类支架释放的硅钙离子刺激人脐静脉内皮细胞和血红蛋白间充质干细胞产生生长因子、骨形态发生蛋白、相关酶,进而促进血管生成和成骨分化[18],可修复骨缺损(如图3所示)。
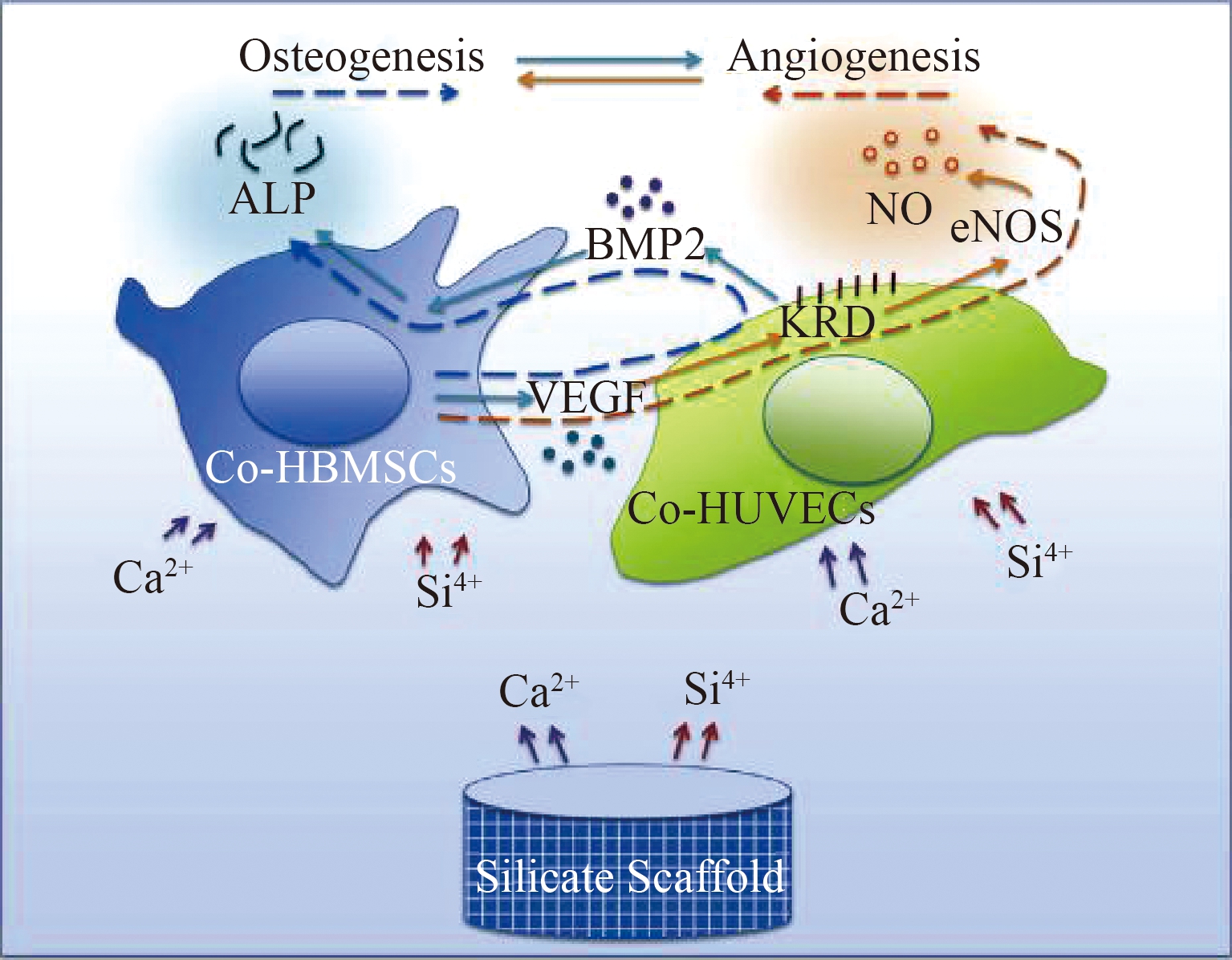
图3 硅酸钙支架与细胞之间的作用过程[18]
Figure 3 Interaction between calcium silicate scaffold and cells[18]
硅酸盐陶瓷主要应用于非承重部位:CaMgSi2O6用于眼眶重建植入物;Ca2MgSi2O7和Ca7MgSi4O16主要应用于骨组织工程的支架材料;Ca2ZnSi2O7与HAp和CaSiO3相比,具有更好的生物相容性、弯曲强度和断裂韧性,是骨再生支架、生物活性涂层的合适候选材料;Mg2SiO4[19]与其他硅酸盐生物陶瓷相比降解率较低,力学性能优于HAp和CaSiO3,良好的生物活性、生物相容性和力学性能使其可成为修复骨缺损的理想材料,未来有望成为骨替代领域的承载材料。
除硅酸盐陶瓷之外,生物活性玻璃(BG)也是可用于生物材料中的硅酸盐材料。BG在体液中可溶出Na+,表面能生成富SiO2凝胶层,形成碳酸羟基磷灰石(HCA)层,可吸附较多的生物活性蛋白,具有较高的生物活性,常制成支架材料用于骨缺损的修复。但是BG存在脆性高、弯曲强度高、难以成型的问题,只能应用于非承重领域,常作为无机颗粒增强相掺入有机材料中。
硅酸盐生物陶瓷具有优异的骨诱导性和生物活性,但力学性能较差、脆性大,通常以多孔陶瓷支架的形式应用于骨组织工程,进一步降低了其力学性能,这限制了硅酸盐生物陶瓷在骨修复中承重部位的应用;较快的降解速率导致其在宿主体内不能长期稳定地存在,故难以成为长期骨替代的理想材料。
2.3 氧化物生物陶瓷材料
氧化物生物陶瓷(如氧化铝陶瓷和氧化锆陶瓷)的优势在于机械强度高、耐磨性好、物理化学性质稳定,临床上通常用于承重人工骨,如髋关节、膝关节(图4)和牙齿等部位。氧化铝陶瓷具有高强度、优异的耐腐蚀性和耐磨性,但Al2O3和组织之间缺乏化学键合,存在生物活性差和断裂韧性差的问题。可通过形成高度多孔结构[22]改善氧化铝陶瓷的生物相容性和生物活性,或通过纳米尺度的第二陶瓷相的分散来增强断裂韧性和弯曲强度。四方氧化锆陶瓷(TZP)具有优异的生物相容性、美学性能、高断裂韧性、高弯曲强度和压缩强度。耐磨性差和老化现象严重损害了ZrO2陶瓷在临床应用中的长期稳定性。可通过减少晶粒尺寸[23]、降低孔隙率[24]、减少团聚体来提高材料的耐磨性和抗老化性。同时,氧化锆增韧氧化铝陶瓷(ZTA)[25]也具有优异的抗老化性能和综合机械性能,在生物医学应用中已被用作单斜氧化锆陶瓷的替代品。由于氧化物生物陶瓷稳定的化学性质导致其难以与宿主骨形成化学键合,生物活性差,限制了其在骨替代领域中的应用。

图4 氧化锆材料的应用实例
Figure 4 Application examples of zirconia materials
2.4 非氧化物生物陶瓷材料
2.4.1 β-Si3N4生物陶瓷材料
β-Si3N4具有高强度和断裂韧性、物相稳定性、低磨损性、生物相容性、亲水性、良好的射线成像和抗细菌黏附性等材料性能。氮化硅曾被划分为生物惰性陶瓷一类,而近期一些研究表明β-Si3N4具有活性表面化学成分,可以保护、刺激并最终促进组织愈合[26]。与氧化物陶瓷不同,β-Si3N4的表面化学和表面形貌可以通过工程设计来满足体内的潜在需求,如图5所示,当浸入水环境中时,硅和氮从其表面缓慢洗脱,在人体内弱碱条件下以NH4+的形式存在,能够促进骨组织愈合、改善细胞代谢和增强骨形成[28]。氮化硅不仅可以产生纤维互锁的完全致密的结构,满足全关节置换术中所要求的耐磨性、弯曲强度和断裂韧性等性能[29],还可以制成多孔植入物,应用于骨支架、脊柱融合和颌面部重建。Bal等[30]通过在β-Si3N4粉中添加Y2O3和Al2O3制备出接近理论密度的坚韧复合材料,用于全髋关节置换(THA)轴承。Bodišov 等[31]以聚氨酯海绵作为模板,采用空气烧结氮化硅和反应烧结氮化硅两种方法制得多孔氮化硅陶瓷,其微观结构和力学性能与骨小梁相似而且无生物毒性。Kersten等[32]比较聚醚醚酮笼和氮化硅笼在有症状的退行性腰椎间盘疾病患者中的临床疗效和融合率,结果显示,β-Si3N4制成的陶瓷植入物有更好的生物相容性和骨传导性。
等[31]以聚氨酯海绵作为模板,采用空气烧结氮化硅和反应烧结氮化硅两种方法制得多孔氮化硅陶瓷,其微观结构和力学性能与骨小梁相似而且无生物毒性。Kersten等[32]比较聚醚醚酮笼和氮化硅笼在有症状的退行性腰椎间盘疾病患者中的临床疗效和融合率,结果显示,β-Si3N4制成的陶瓷植入物有更好的生物相容性和骨传导性。
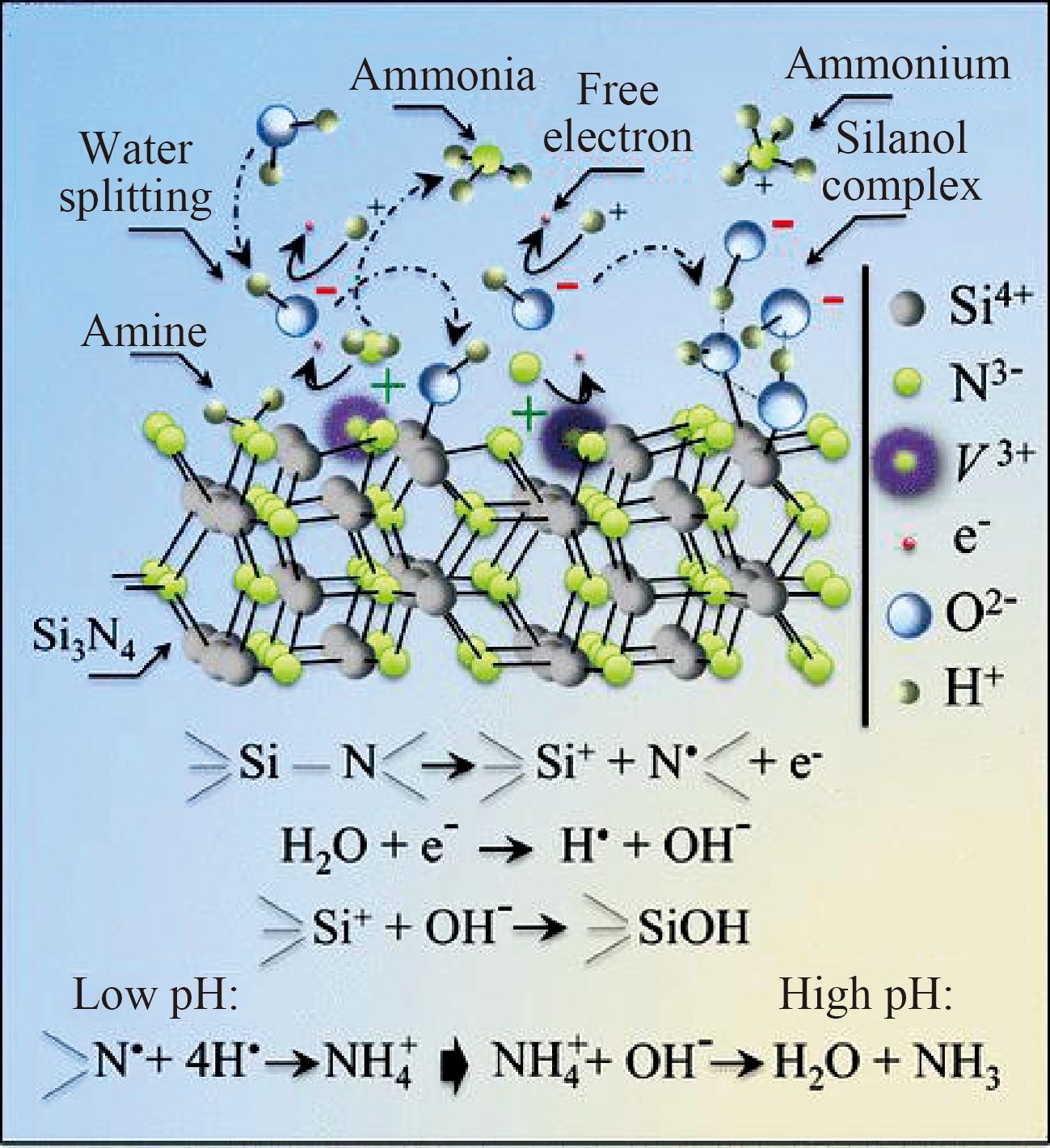
图5 Si3N4表面暴露于水溶液的示意图[27]
Figure 5 Schematic diagram of Si3N4 surface exposed to aqueous solution[27]
氮化硅陶瓷中的Si—N键为强共价键,使氮化硅材料不仅强度高、断裂韧性好,而且植入机体内化学性质比较稳定。但正是因为高强度的共价键,导致其体积扩散和晶界扩散速率很低,难以通过低温固相自烧结,制备相对困难。
2.4.2 β-SiAlON生物陶瓷材料
β-SiAlON(化学式为Si6-ZAlZOZN8-Z,其中Z的取值为0~4.2)是由部分Al—O键取代了Si—N键而得到的β-Si3N4的固溶体,Z值的大小代表固溶度。这种局部化学键的取代使得二者晶体结构相似、力学性能相近,但也使得β-SiAlON的无序度增加,Si—N键的力学常数降低,在烧结过程中易产生大量瞬时液相,大幅改善烧结性能,解决了β-Si3N4不易烧结的问题。通过调节Z值,还能调控β-SiAlON的物相、晶体形貌和理化性能,同时Li等[33]通过细胞培养结果发现,β-SiAlON在人体环境中不存在毒性,并具有骨诱导性能。此外,β-SiAlON可通过与其他材料复合,如β-SiAlON-Si3N4[34]、β-SiAlON-Al2O3[35]、β-SiAlON-ZrO2[36],不仅能克服β-SiAlON的制备困难问题,还能进一步提高β-SiAlON的力学性能,改善其生物性能,使得β-SiAlON在生物陶瓷领域中有望成为β-Si3N4的替代物,成为最具潜力的骨替代生物陶瓷材料之一。
2.4.3 SiC生物陶瓷材料
碳化硅具有优异的力学性能,耐磨性好,具有一定的生物相容性。Luo等[37]通过模板法将SiC制备成多孔生物陶瓷支架,在制备过程中利用孔壁上残留的Si与N2反应生成纤维状β-Si3N4,改善了SiC材料的机械性能和抗氧化性。这种β-Si3N4/SiC复合材料可应用于骨科和牙科植入物领域。González等[38]通过ArF激光器,在SiC陶瓷表面镀上一层均匀的SiO2生物活性玻璃薄膜,提高了SiC材料的生物活性。但由于SiC生物陶瓷本身具有生物惰性,其表面还未发现更有利于骨替代的特殊表面化学性质,所以目前对于SiC生物陶瓷做骨替代材料的研究较少。
2.5 复合材料
综上所述,由于理想骨替代材料需要优异的物理、化学和生物性能,单一的材料往往难以同时满足这些性能的需求。近些年关于骨替代复合材料的研究主要集中在3个方向。
一是金属与生物陶瓷的复合。在金属表面制备陶瓷涂层,增加金属材料的生物活性和其他性能,以实现其在承载领域更好的应用。在钛基底上形成不同结构的涂层材料,如HAp、CaP、Ca3ZrSi2O、CaTiO3涂层或复合涂层TiO2/HA、钛酸钙/TiO2、HA/Ti等。Furko等[39]通过脉冲电流沉积将磷酸钙层涂覆在钛合金材料(Ti6Al4V)上,随后用含有银、锌、镁和锶成分的溶液进行处理,增加了材料生物活性和抗菌性。Melero等[40]用高速氧燃料喷涂法取代等离子喷涂法在Ti6Al4V合金上制备了HAp-TiO2复合涂层,在TiO2的机械性能和HAp的生物学性能之间找到了一个折中方案。此外,还有一些金属材料如不锈钢316 L(SS)[41]、锆、银、铋、铜等,也可以在其表面制备单一相的陶瓷涂层或复合涂层。
二是在不同生物陶瓷之间的复合。在生物活性较差的陶瓷表面形成生物活性较好的陶瓷涂层,如氧化锆、氧化铝、氮化硅[42]以及SiAlON等。在这些生物活性较差的陶瓷表面制备具有良好骨黏合能力的、生物活性较好的陶瓷涂层,是一种用于改善植入物骨整合的策略,可以实现良好的机械性能与生物活性的整合。Stefanic等[43]在四方氧化锆圆盘上合成了β-磷酸三钙(β-TCP)涂层,分析了加热温度对β-TCP涂层与氧化锆的结合强度的影响。Baino等[44]在氧化铝基材上制备了含硅灰石的玻璃陶瓷涂料,获得厚度均匀、附着力强的涂层足以用于生物医学应用。
三是高分子材料与生物陶瓷的复合。天然骨是胶原蛋白纤维与羟基磷灰石晶体的结合,其中由I型胶原蛋白构成的网络支架提供弹性和韧性,羟基磷灰石晶体提供硬度和强度。根据仿生学的原理,可制备出高分子材料与生物陶瓷相结合的复合材料,高分子材料的加入可以提高生物陶瓷的断裂韧性。Torres等[45]在β-磷酸三钙/HA支架表面涂覆藻酸盐,其抗压强度得以改善,且具有与天然骨的相似的断裂韧性和弹性模量。
3 结语
尽管可用于骨替代的材料种类繁多,但根据骨科疾病发生部位的特殊性,应选用不同的骨替代材料,发挥材料的自身优势。例如,若发生非承重部位小范围的骨缺损,采用磷酸盐、硅酸盐等多孔生物陶瓷支架材料进行骨修复,诱导新骨形成是较优的解决方案;若发生在承重部位,骨水泥用于骨修复或许是更好的方式;如果骨缺损部位较大,处于关节部位和承重部位,则耐磨性优异、机械性能良好的氧化物、非氧化物生物陶瓷及合金材料是较好的选择。
生物陶瓷材料有着优良的性能,随着研究的深入,会有更广阔的发展前景和研究空间。
(1)由于单一材料无法完全满足骨替代材料的要求,而复合材料可以在一定程度上克服单一材料的缺陷,考虑到天然骨是由羟基磷灰石晶体和胶原蛋白组成,将高分子材料与生物陶瓷材料复合,是骨替代材料未来较具潜力的研究方向。
(2)生物陶瓷的多功能化是一个新的研究方向,对于治疗骨肿瘤引起的骨缺损时,要求植入的材料既要替代骨缺失部分又要预防肿瘤的再发展,这就需要骨替代材料从负载药物、表面修饰、磁性热疗方面来实现。
(3)感染是骨替代手术中严重的并发症,骨替代材料的抗菌性能是非常重要的。相关研究表明,抗菌性能与压电性相关,如带正电的羟基磷灰石钛酸钡复合材料对细菌有明显的抑菌圈。因此,研究具备压电性的骨替代材料对抑菌的影响机理是迫切需要的。
(4)免疫反应对骨替代材料植入人体后骨组织功能及骨组织再生具有重要的调节作用。因此,设计和开发具有骨免疫调节性能的材料,诱导巨噬细胞极化来减少宿主对材料的炎症反应是至关重要的。相关研究发现,硅酸钙生物陶瓷具有该性能,研究骨免疫调节机制、设计更优的骨免疫调节性能材料、提高骨替代材料成骨能力并减少免疫反应是一重要发展方向。
[1] D′ALESSANDRO D, RICCI C, MILAZZO M, et al. Piezoelectric signals in vascularized bone regeneration[J]. Biomolecules, 2021, 11(11): 1731.
[2] SALGADO A J, COUTINHO O P, REIS R L. Bone tissue engineering: state of the art and future trends[J]. Macromolecular Bioscience, 2004, 4(8): 743-765.
[3] SRINATH P, ABDUL AZEEM P, VENUGOPAL REDDY K. Review on calcium silicate-based bioceramics in bone tissue engineering[J]. International Journal of Applied Ceramic Technology, 2020, 17(5): 2450-2464.
[4] TOMMASI G, PERNI S, PROKOPOVICH P. An injectable hydrogel as bone graft material with added antimicrobial properties[J]. Tissue Engineering Part A, 2016, 22(11/12): 862-872.
[5] 李少鹏, 陈豪杰, 杨帆, 等. 可降解镁金属在骨科中的应用[J]. 生物骨科材料与临床研究, 2021, 18(4): 92-96.
LI S P, CHEN H J, YANG F, et al. Application of degradable magnesium metal in orthopaedics[J]. Orthopaedic Biomechanics Materials and Clinical Study, 2021, 18(4): 92-96.
[6] SHEKHAWAT D, SINGH A, BANERJEE M K, et al. Bioceramic composites for orthopaedic applications: a comprehensive review of mechanical, biological, and microstructural properties[J]. Ceramics International, 2021, 47(3): 3013-3030.
[7] SHUAI C J, YU L, FENG P, et al. Interfacial reinforcement in bioceramic/biopolymer composite bone scaffold: the role of coupling agent[J]. Colloids and Surfaces B: Biointerfaces, 2020, 193: 111083.
[8] BIASETTO L, BERTOLINI R, ELSAYED H, et al. Use of cryogenic machining to improve the adhesion of sphene bioceramic coatings on titanium substrates for dental and orthopaedic applications[J]. Ceramics International, 2019, 45(5): 5941-5951.
[9] 邹云, 王起龙, 李阳, 等. 基于超声纳米表面改性的镁锂合金强化研究[J]. 郑州大学学报(工学版), 2020, 41(5): 26-30.
ZOU Y, WANG Q L, LI Y, et al. Strengthening research of Mg-Li alloy based on ultrasonic nanocrystal surface modification[J]. Journal of Zhengzhou University (Engineering Science), 2020, 41(5): 26-30.
[10] DE JONG W F. La substance minérale dans les os[J]. Recueil des Travaux Chimiques des Pays-Bas, 1926, 45(6): 445-448.
[11] LIU Y, LUO D, WANG T. Hierarchical structures of bone and bioinspired bone tissue engineering[J]. Small, 2016, 12(34): 4611-4632.
[12]  UPOV
UPOV M. Substituted hydroxyapatites for biomedical applications: a review[J]. Ceramics International, 2015, 41(8): 9203-9231.
M. Substituted hydroxyapatites for biomedical applications: a review[J]. Ceramics International, 2015, 41(8): 9203-9231.
[13] SADAT-SHOJAI M, KHORASANI M T, DINPANAH-KHOSHDARGI E, et al. Synthesis methods for nanosized hydroxyapatite with diverse structures[J]. Acta Biomaterialia, 2013, 9(8): 7591-7621.
[14] ULLAH I, GLORIA A, ZHANG W C, et al. Synthesis and characterization of sintered Sr/Fe-modified hydroxyapatite bioceramics for bone tissue engineering applications[J]. ACS Biomaterials Science &Engineering, 2020, 6(1): 375-388.
[15] ZHOU T Y, ZHANG L, YAO Q, et al. SLA 3D printing of high quality spine shaped β-TCP bioceramics for the hard tissue repair applications[J]. Ceramics International, 2020, 46(6): 7609-7614.
[16] AZEENA S, SUBHAPRADHA N, SELVAMURUGAN N, et al. Antibacterial activity of agricultural waste derived wollastonite doped with copper for bone tissue engineering[J]. Materials Science and Engineering: C, 2017, 71: 1156-1165.
[17] ROS-T RRAGA P, MAZ
RRAGA P, MAZ N P, REVILLA-NUIN B, et al. High temperature CaSiO3-Ca3(PO4)2 ceramic promotes osteogenic differentiation in adult human mesenchymal stem cells[J]. Materials Science and Engineering: C, 2020, 107: 110355.
N P, REVILLA-NUIN B, et al. High temperature CaSiO3-Ca3(PO4)2 ceramic promotes osteogenic differentiation in adult human mesenchymal stem cells[J]. Materials Science and Engineering: C, 2020, 107: 110355.
[18] LI H Y, XUE K, KONG N, et al. Silicate bioceramics enhanced vascularization and osteogenesis through stimulating interactions between endothelia cells and bone marrow stromal cells[J]. Biomaterials, 2014, 35(12): 3803-3818.
[19] CHOUDHARY R, CHATTERJEE A, VENKATRAMAN S K, et al. Antibacterial forsterite (Mg2SiO4) scaffold: a promising bioceramic for load bearing applications[J]. Bioactive Materials, 2018, 3(3): 218-224.
[20] BHASKAR N, SARKAR D, BASU B. Probing cytocompatibility, hemocompatibility, and quantitative inflammatory response in Mus musculus toward oxide bioceramic wear particulates and a comparison with CoCr[J]. ACS Biomaterials Science &Engineering, 2018, 4(9): 3194-3210.
[21] SHI Y L, WANG W Q. 3D inkjet printing of the zirconia ceramic implanted teeth[J]. Materials Letters, 2020, 261: 127131.
[22] ATE S, BARAN E, YAZICI B. The nanoporous anodic alumina oxide formed by two-step anodization[J]. Thin Solid Films, 2018, 648: 94-102.
S, BARAN E, YAZICI B. The nanoporous anodic alumina oxide formed by two-step anodization[J]. Thin Solid Films, 2018, 648: 94-102.
[23] LUCAS T J, LAWSON N C, JANOWSKI G M, et al. Effect of grain size on the monoclinic transformation, hardness, roughness, and modulus of aged partially stabilized zirconia[J]. Dental Materials, 2015, 31(12): 1487-1492.
[24] SANON C, CHEVALIER J, DOUILLARD T, et al. A new testing protocol for zirconia dental implants[J]. Dental Materials, 2015, 31(1): 15-25.
[25] 卢红霞, 高凯, 李明亮, 等. 以高炉渣为助烧剂制备ZTA/TiC复合陶瓷及其性能研究[J]. 郑州大学学报(工学版), 2020, 41(5): 8-14.
LU H X, GAO K, LI M L, et al. Preparation of ZTA/TiC composite ceramics using blast furnace slag as sintering aid[J]. Journal of Zhengzhou University (Engineering Science), 2020, 41(5): 8-14.
[26] GINEBRA M P, ESPANOL M, MAAZOUZ Y, et al. Bioceramics and bone healing[J]. EFORT Open Reviews, 2018, 3(5): 173-183.
[27] PEZZOTTI G. Silicon nitride: a bioceramic with a gift[J]. ACS Applied Materials &Interfaces, 2019, 11(30): 26619-26636.
[28] PEZZOTTI G, BOCK R M, ADACHI T, et al. Silicon nitride surface chemistry: a potent regulator of mesenchymal progenitor cell activity in bone formation[J]. Applied Materials Today, 2017, 9: 82-95.
[29] LANGE F F. The sophistication of ceramic science through silicon nitride studies[J]. Journal of the Ceramic Society of Japan, 2006, 114(11): 873-879.
[30] BAL B S, KHANDKAR A, LAKSHMINARAYANAN R, et al. Fabrication and testing of silicon nitride bearings in total hip arthroplasty: winner of the 2007 “HAP” Paul Award[J]. The Journal of Arthroplasty, 2009, 24(1): 110-116.
[31] BODI OV
OV K, KA
K, KA IAROV
IAROV M, DOMANICK
M, DOMANICK M, et al. Porous silicon nitride ceramics designed for bone substitute applications[J]. Ceramics International, 2013, 39(7): 8355-8362.
M, et al. Porous silicon nitride ceramics designed for bone substitute applications[J]. Ceramics International, 2013, 39(7): 8355-8362.
[32] KERSTEN R F M R, VAN GAALEN S M, ARTS M P, et al. The SNAP trial: a double blind multi-center randomized controlled trial of a silicon nitride versus a PEEK cage in transforaminal lumbar interbody fusion in patients with symptomatic degenerative lumbar disc disorders: study protocol[J]. BMC Musculoskeletal Disorders, 2014, 15: 57.
[33] LI M, ZHANG L G, ZHANG C, et al. Effect of Y2O3 on the physical properties and biocompatibility of β-SiAlON ceramics[J]. Ceramics International, 2020, 46(15): 23427-23432.
[34] ZHANG L G, LIU X J, LI M, et al. Feasibility of SiAlON-Si3N4 composite ceramic as a potential bone repairing material[J]. Ceramics International, 2020, 46(2): 1760-1765.
[35] XIE H X, ZHANG L G, XU E X, et al. SiAlON-Al2O3 ceramics as potential biomaterials[J]. Ceramics International, 2019, 45(14): 16809-16813.
[36] ZHANG L G, ZHANG C, XU E X, et al. Effect of ZrO2 on the physicochemical properties and biological properties of β-SiAlON-ZrO2 composite ceramics[J]. Ceramics International, 2021, 47(1): 1244-1252.
[37] LUO M, HOU G Y, YANG J F, et al. Manufacture of fibrous β-Si3N4-reinforced biomorphic SiC matrix composites for bioceramic scaffold applications[J]. Materials Science and Engineering: C, 2009, 29(4): 1422-1427.
[38] GONZ LEZ P, SERRA J, LISTE S, et al. New biomorphic SiC ceramics coated with bioactive glass for biomedical applications[J]. Biomaterials, 2003, 24(26): 4827-4832.
LEZ P, SERRA J, LISTE S, et al. New biomorphic SiC ceramics coated with bioactive glass for biomedical applications[J]. Biomaterials, 2003, 24(26): 4827-4832.
[39] FURKO M, BELLA E D, FINI M, et al. Corrosion and biocompatibility examination of multi-element modified calcium phosphate bioceramic layers[J]. Materials Science and Engineering: C, 2019, 95: 381-388.
[40] MELERO H, FARGAS G, GARCIA-GIRALT N, et al. Mechanical performance of bioceramic coatings obtained by high-velocity oxy-fuel spray for biomedical purposes[J]. Surface and Coatings Technology, 2014, 242: 92-99.
[41] CHEN Q Y, ZOU Y L, FU W, et al. Wear behavior of plasma sprayed hydroxyapatite bioceramic coating in simulated body fluid[J]. Ceramics International, 2019, 45(4): 4526-4534.
[42] PEZZOTTI G, MCENTIRE B J, BOCK R, et al. In situ spectroscopic screening of osteosarcoma living cells on stoichiometry-modulated silicon nitride bioceramic surfaces[J]. ACS Biomaterials Science &Engineering, 2016, 2(7): 1121-1134.
[43] STEFANIC M, KOSMA T. β-TCP coatings on zirconia bioceramics: the importance of heating temperature on the bond strength and the substrate/coating interface[J]. Journal of the European Ceramic Society, 2018, 38(15): 5264-5269.
T. β-TCP coatings on zirconia bioceramics: the importance of heating temperature on the bond strength and the substrate/coating interface[J]. Journal of the European Ceramic Society, 2018, 38(15): 5264-5269.
[44] BAINO F, VITALE-BROVARONE C. Wollastonite-containing bioceramic coatings on alumina substrates: design considerations and mechanical modelling[J]. Ceramics International, 2015, 41(9): 11464-11470.
[45] TORRES A L, GASPAR V M, SERRA I R, et al. Bioactive polymeric-ceramic hybrid 3D scaffold for application in bone tissue regeneration[J]. Materials Science and Engineering: C, 2013, 33(7): 4460-4469.