0 引言
近年来,针对肿瘤治疗的研究,出现了许多肿瘤治疗新技术,其中脉冲电场电穿孔技术在肿瘤治疗中已经取得了卓越成效,是目前肿瘤治疗的研究热点[1-3]。所谓电穿孔(electroporation,EP)是指当细胞置于高压脉冲电场时,细胞膜的通透性瞬间提高,平时不能通过完整细胞膜的外源分子能够轻易地进入细胞内部,在生物医学领域中分为可逆电穿孔(reversible electroporation,RE)与不可逆电穿孔(irreversible electroporation,IRE)。可逆电穿孔是指脉冲电场撤去后,细胞膜通透性逐渐恢复,细胞的正常生理活动未受影响[4]。当脉冲场强足够高或者作用时间足够长时,细胞膜的通透性在脉冲电场撤去后不能恢复,从而诱导细胞死亡,这种现象叫做不可逆电穿孔[5]。
基于可逆电穿孔的原理,微秒脉冲电场(mirosecond pulsed electric fields,μsPEF)已成功应用于肿瘤的化学药物治疗。μsPEF具有靶向作用于细胞膜的特点,被用来提高很难渗透进细胞的药物在癌症组织中的浓度,具有局部增强的细胞毒性效应[6],可有效减少抗肿瘤药物的使用剂量从而降低毒副作用。当前可逆电穿孔电化学疗法多与传统化疗药物联合使用,但是传统化疗药物会对人体正常组织无差别杀伤,使人体产生多种不良反应并且价格昂贵[7]。
近年来中医药在改善肺癌术后、放化疗后的不良反应以及抗肿瘤生长方面发挥着越来越重要的作用[8]。二十碳五烯酸(eicosapentaenoic acid, EPA)是中药黄芪的主要挥发性成分,具有抗肿瘤、抗炎、抗氧化应激等作用,是重要的辅助治疗药物和保健品原料。研究证实,EPA对不同类型的癌细胞具有细胞活性抑制或诱导凋亡的作用,能抑制肿瘤的生长、侵袭及转移[9]。并且研究显示,EPA在对肺癌A-549细胞发挥特异性毒性的同时,合适剂量下对正常人体细胞无毒性[10]。但是单独使用EPA对癌细胞的杀伤效果较弱,多与其他药物联合使用[11]。
为了探究μsPEF是否对EPA的药效具有促进作用,本文通过筛选合适的药物浓度及电场强度参数,研究μsPEF产生的可逆电穿孔对EPA药效的促进作用,为后续电化学疗法中药物的选用提供新思路,并且为后续中药成分干预癌症的治疗提供了重要的促进手段。
1 材料与方法
1.1 实验材料与仪器
人肺癌细胞株A-549(ProcellCL-0016)、EPA(纯度>99%,Sigma-Alidrich)、全自动酶标仪(SIGMA960)、1640培养基(索莱宝)、胎牛血清(索莱宝)、胰蛋白酶(索莱宝)、CCK-8试剂盒(索莱宝)、碘化丙啶(MedChemExpress)、无水乙醇(索莱宝)、电极杯(BTX)、脉冲发生设备(课题组自行研制)。
1.2 细胞培养
人肺癌A-549细胞培养传代,待细胞融合度达到80%以上时,取对数生长期的细胞,制备单细胞悬液以备实验。
1.3 EPA毒性效果检测
采用CCK-8法检测细胞活性,取培养完成的细胞消化离心,调整细胞数密度为4×105 mL-1。各组分别加入不同EPA浓度的含药培养基,置于培养箱培育24 h,然后加入10 μL的CCK-8试剂,继续孵育1.5 h。全自动酶标仪检测各实验组在450 nm波长的OD值,每组测5次,实验重复3次,取均值,计算细胞活性。
1.4 脉冲发生设备
实验装置如图1所示,微秒脉冲发生设备为实验室自制,通过控制全固态绝缘栅双极型晶体管(IGBT)开关的开断来产生高压脉冲电场。装置产生的电压:幅值0~3 kV可调,脉冲宽度1 μs~1 ms可调,频率0.1~100 Hz可调。
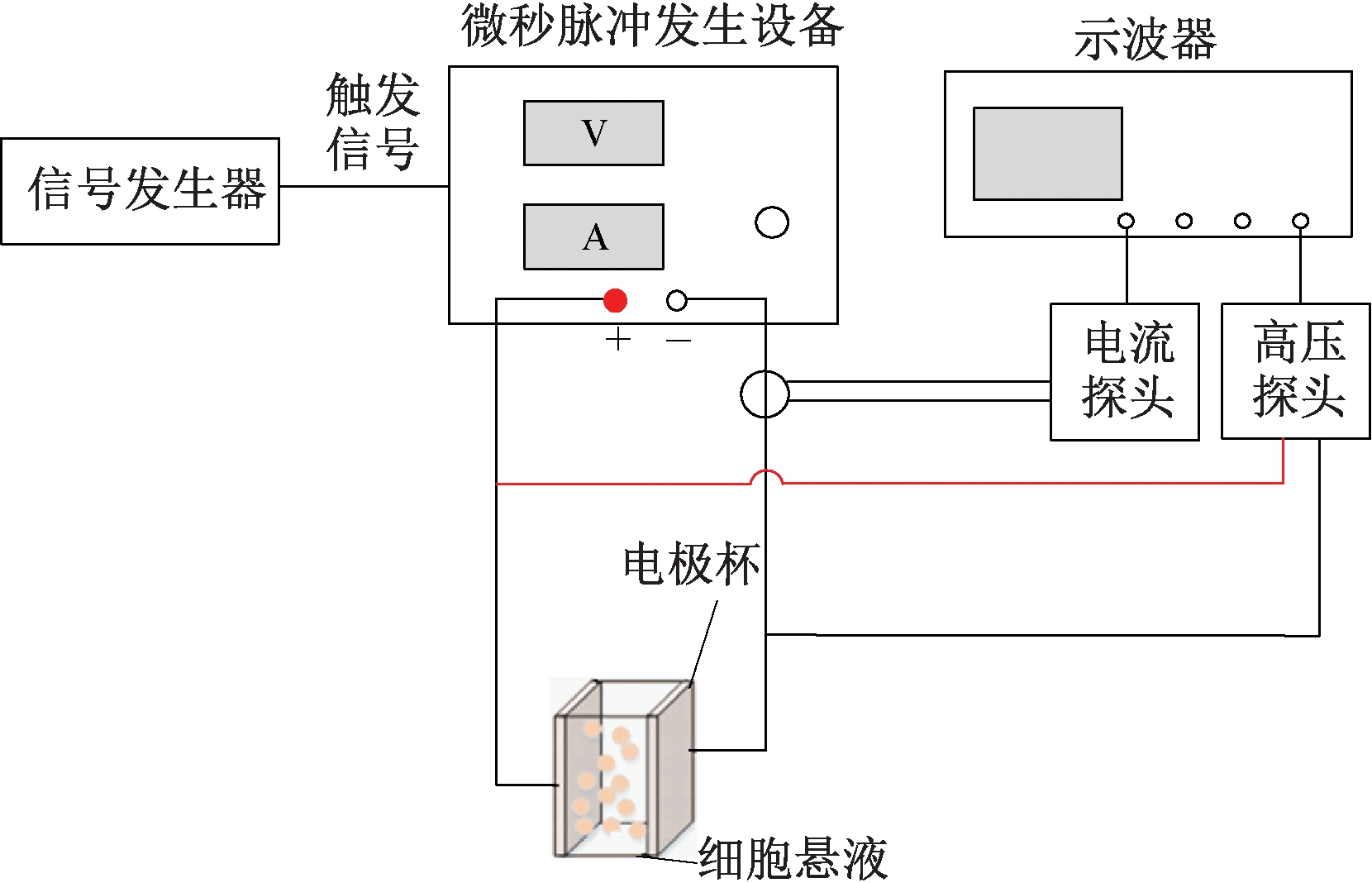
图1 高压脉冲装置示意图
Figure 1 Schematic diagram of high voltage pulse device
1.5 细胞膜通透性检测
使用荧光染料碘化丙啶(PI)染色的方法检测细胞膜穿孔率。PI是一种细胞核染色试剂,PI不能通过活细胞膜,但却能穿过破损的细胞膜而对细胞核染色。对细胞进行μsPEF处理后,细胞膜表面形成电穿孔,使PI能够进入细胞对细胞核进行染色。
1.6 μsPEF处理细胞实验
对于电场杀伤实验,培养完成的细胞消化离心后重悬,调整细胞数量浓度为4×105 mL-1,取120 μL细胞悬液放入电极杯中(电极间距0.4 cm),用电场强度为750~2 000 V/cm(场强间隔为250 V/cm),频率为1 Hz,脉宽100 μs,个数10个的μsPEF处理,培养一定时间后用CCK-8法检测细胞活性。
对于细胞通透性检测实验,培养完成的细胞消化离心后重悬,调整细胞数量浓度为4×107 mL-1。取10 μL细胞悬液加入50 μL的PBS以及6 μL浓度为1.5 mmol/L的PI,静置3 min充分混匀后用μsPEF处理。然后从电极杯中取出50 μL细胞悬液放入EP管中避光3 min,再加入500 μL的PBS,对照组不进行脉冲电场处理,其他操作与实验组完全相同。避光放置10 min后用流式细胞仪检测PI染色率。
对于电场联合药物实验,培养完成的细胞消化离心后,分别加入含EPA以及不含EPA的培养基重悬,调整细胞数量浓度为4×105 mL-1。设置实验分组:①μsPEF+EPA实验组;②EPA组;③μsPEF组;④空白对照组。细胞重悬后立刻取120 μL细胞悬液放入电极杯中进行μsPEF处理,空白对照组为相同体积不加EPA并且不经过μsPEF处理的细胞悬液。处理后以每孔取20 μL(细胞数量8 000个)的体积,加入96孔板各个复孔中,再加入各实验组相同药物浓度的含药培养基补充体积至每孔100 μL,培养24 h(48 h)后用CCK-8法检测细胞活性。
1.7 统计学分析
所有实验至少重复3次,数据均进行齐性检验和正态检验,以均数±标准差表示。采用SPSS23.0软件进行分析。同一时间点的比较采用独立样本t检验或方差分析。P<0.05时有统计学意义。
2 结果
2.1 EPA对A-549细胞的毒性效果
A-549细胞活性与EPA浓度的关系如图2所示,随着EPA浓度的提高,A-549细胞活性呈逐渐下降的趋势,并且与对照组相比,实验组都有统计学差异。当EPA浓度小于100 μmol/L时,对A-549细胞的活性影响很微弱,当EPA浓度大于500 μmol/L时对A-549细胞的毒性过强。后续实验所用EPA浓度区间选择100~400 μmol/L。
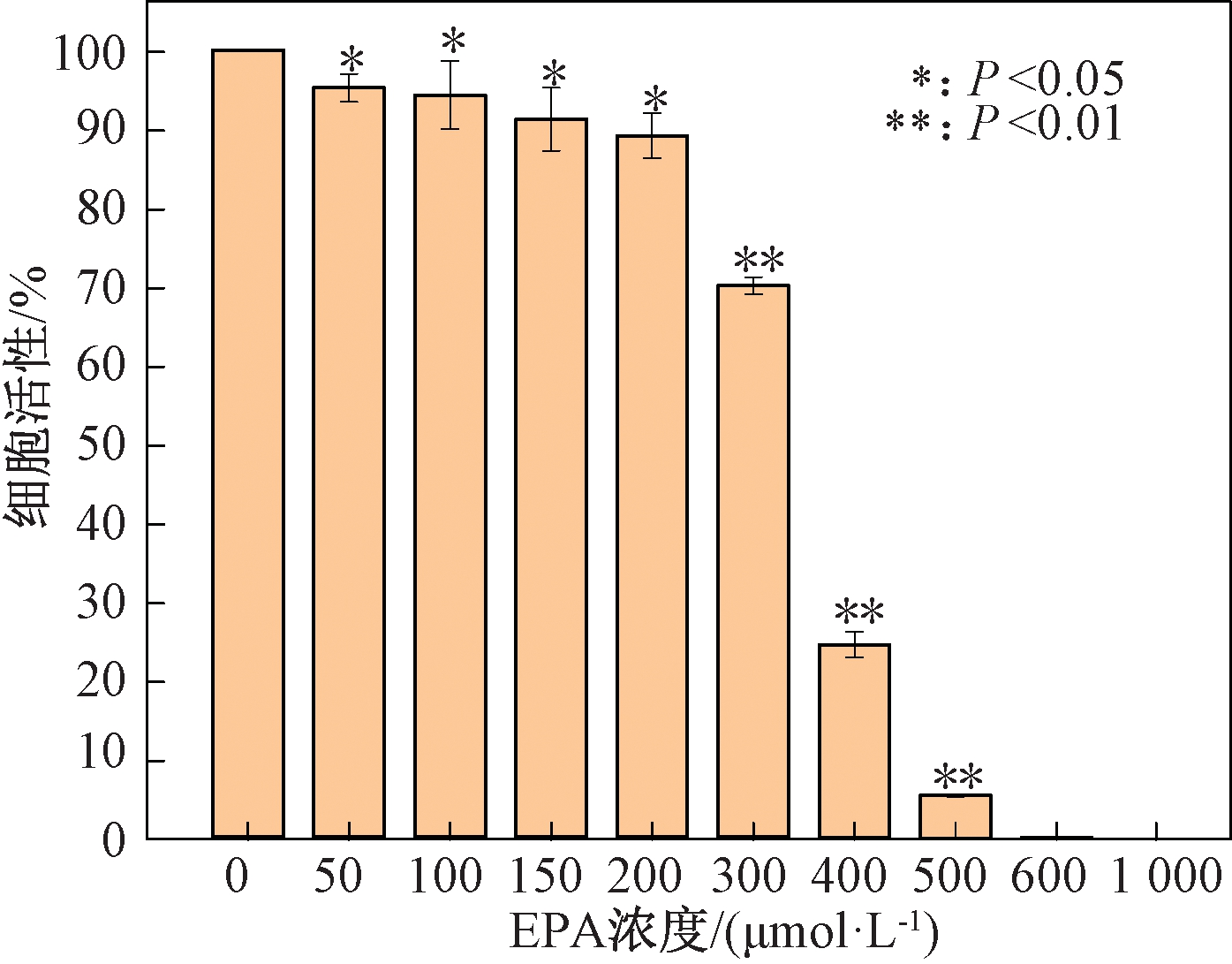
图2 EPA对肺癌A-549细胞的毒性效果
Figure 2 Toxic effect of EPA on lung cancer A-549 cells
2.2 细胞膜通透性
图3为微秒脉冲电场作用下细胞膜穿孔率数据统计图。细胞穿孔率随电场强度的升高而升高,当场强达到1 000 V/cm时,细胞穿孔率显著增高;而场强高于1 000 V/cm时,穿孔率提高的趋势减缓;场强达到1 500 V/cm时,穿孔率已经达到90%以上,此时大部分细胞都已经发生了电穿孔。
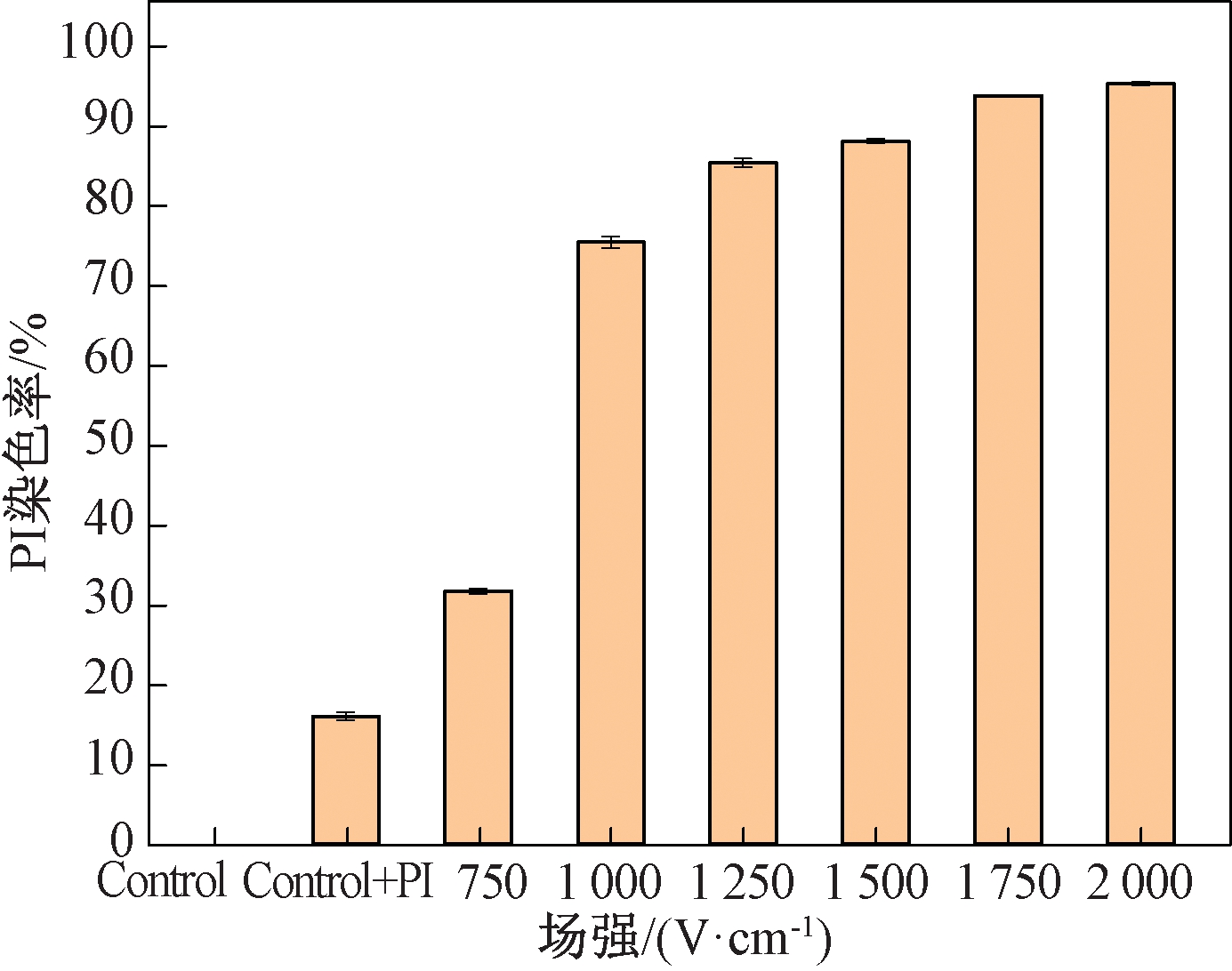
图3 不同场强处理下PI染色率
Figure 3 PI dyeing rate under different electric field intensity
2.3 细胞活性检测结果
μsPEF对细胞活性的影响如图4所示,随着电场强度的升高,A-549细胞活性逐渐减弱。场强低于1 500 V/cm时A-549细胞能够维持较高的细胞活性;场强高于1 500 V/cm时,细胞活性明显降低;场强为1 750 V/cm和2 000 V/cm时,培养24 h细胞活性就已经降低至80%以下。综合考虑穿孔率和细胞活性,选择高穿孔率、低杀伤率的场强参数用于后续实验,尽可能降低脉冲电场本身对细胞的影响,脉冲场强范围选择1 000~1 500 V/cm。
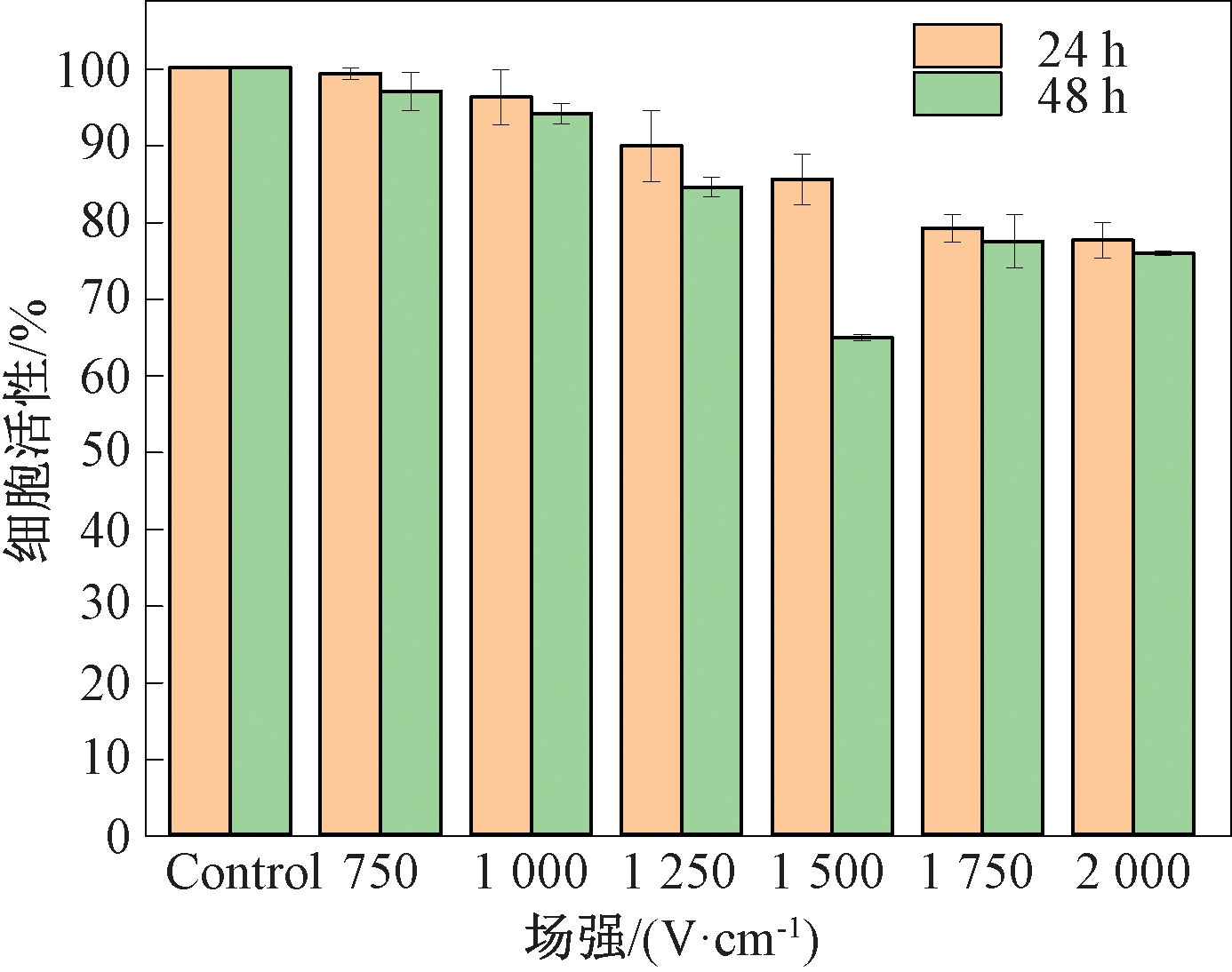
图4 不同场强的μsPEF对细胞活性的影响
Figure 4 Effect of μsPEF with different electric field strength on cell viability
图5~7分别是电场强度为1 000 V/cm、1 250 V/cm和1 500 V/cm的μsPEF联合EPA作用对A-549细胞活性的影响。在不同场强的μsPEF作用下,细胞活性的整体变化趋势基本相同。同一电场强度条件下,随着EPA浓度的增加,细胞活性逐渐减弱,并且培养48 h比培养24 h时细胞活性更低,具有显著性差异(P<0.05)。μsPEF联合EPA共同作用与单独施加EPA时相比,细胞活性明显降低,说明外加μsPEF能够显著增强EPA对A-549细胞的毒性效果。
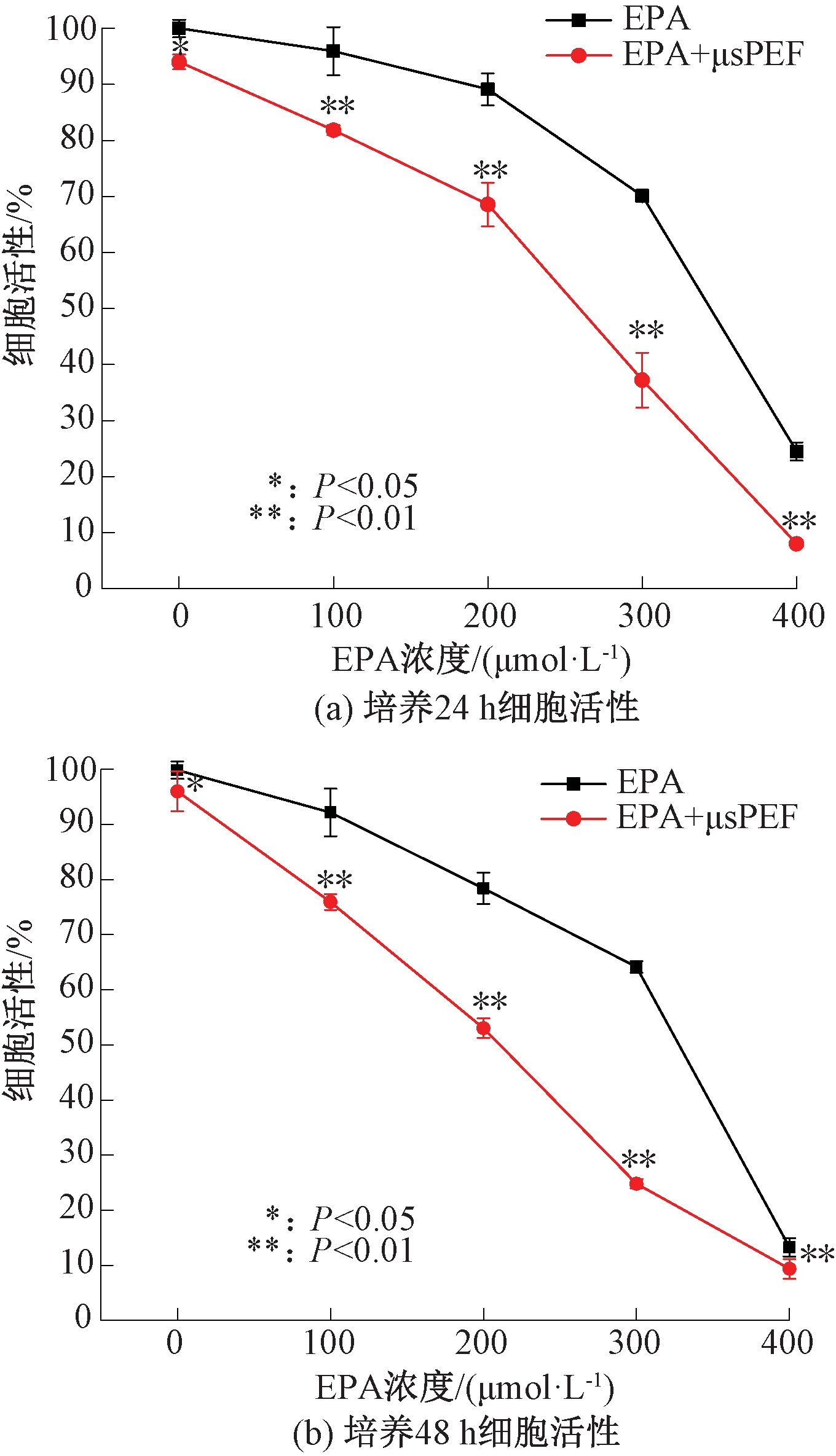
图5 1 000 V/cm的μsPEF联合EPA
对A-549细胞活性的影响
Figure 5 Effect of 1 000 V/cm μsPEF combined with EPA on the viability of A-549 cells
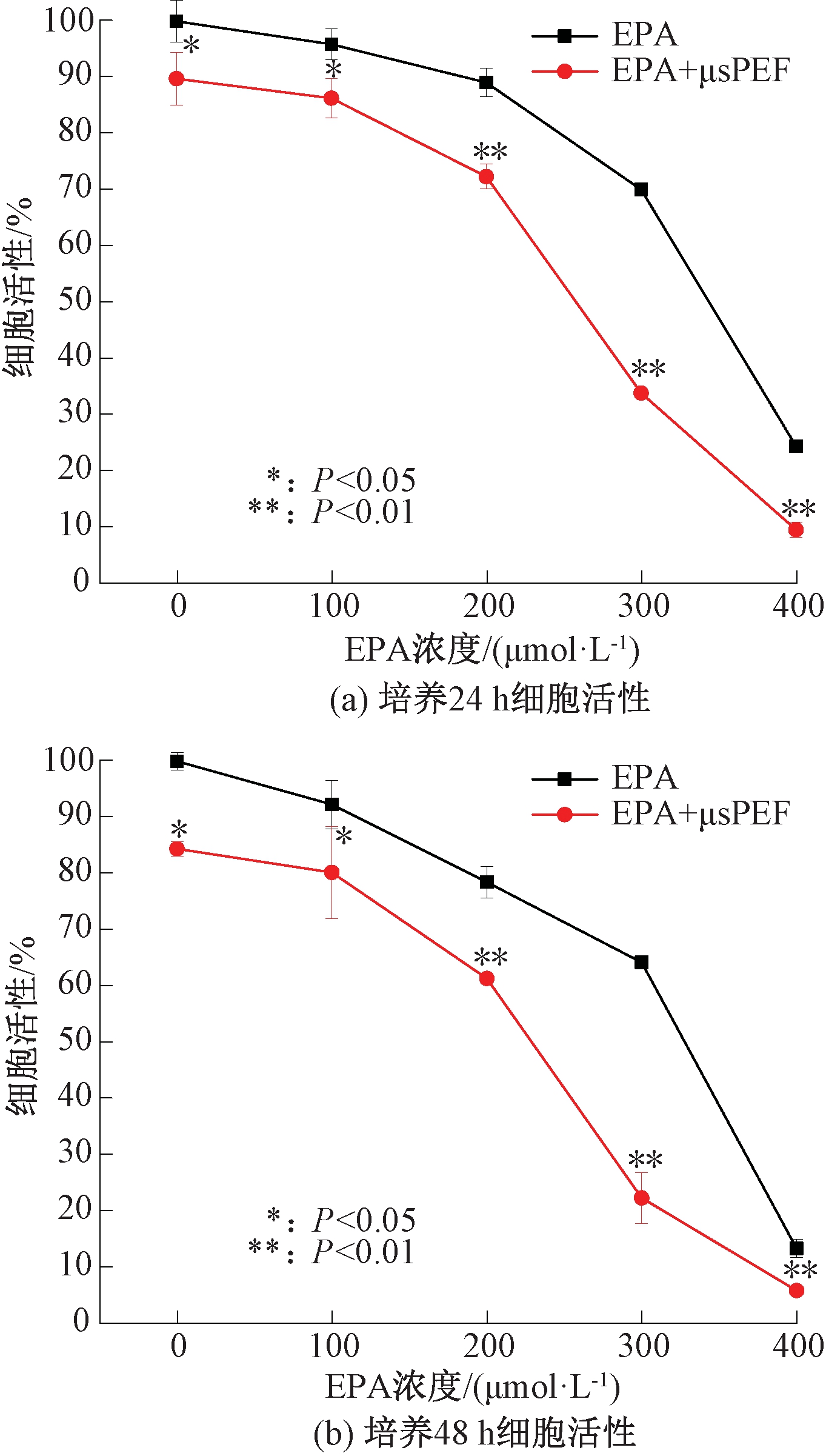
图6 1 250 V/cm的μsPEF联合EPA
对A-549细胞活性的影响
Figure 6 Effect of 1 250 V/cm μsPEF combined with EPA on the viability of A-549 cells
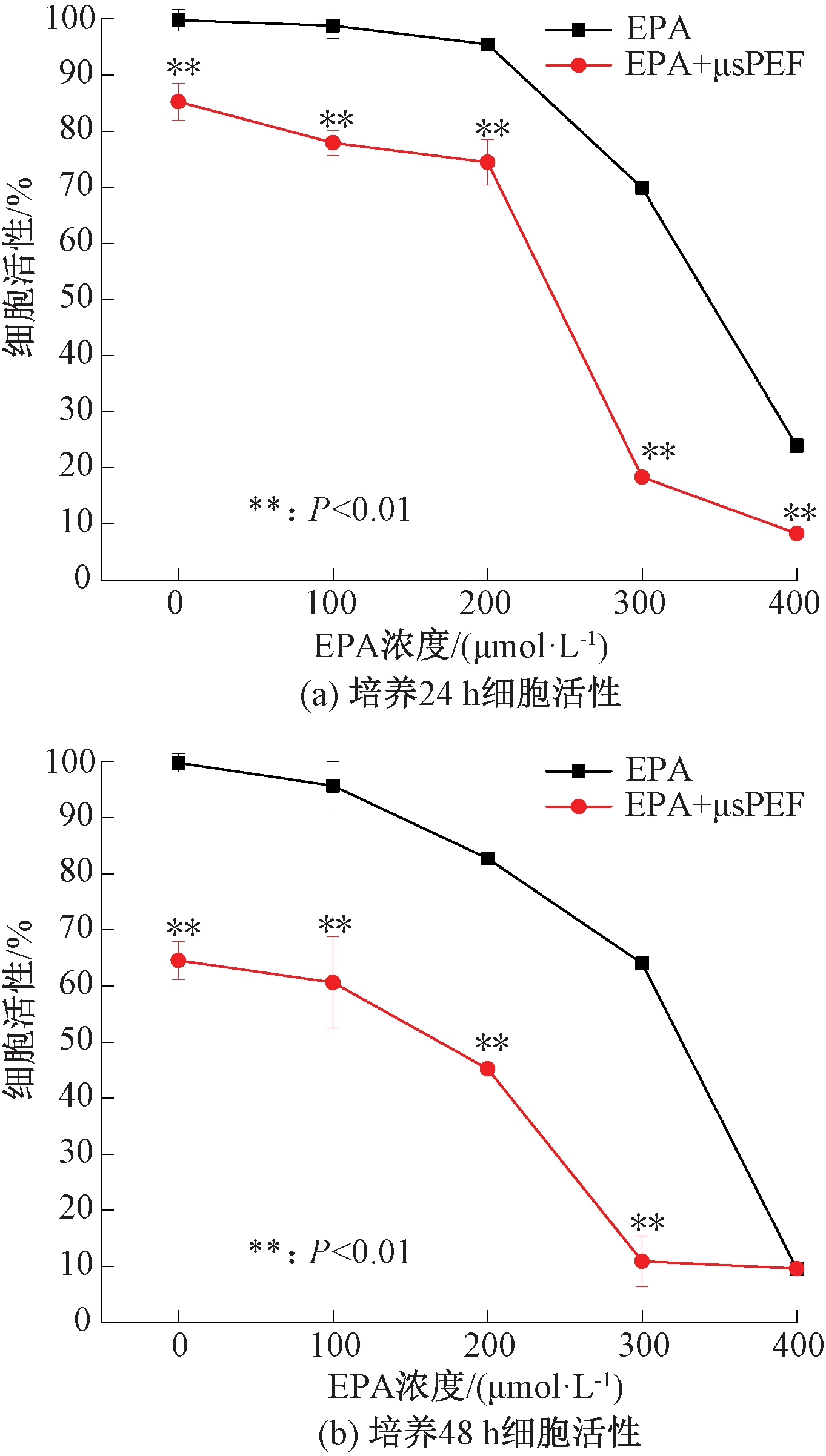
图7 1 500 V/cm的μsPEF联合EPA对A-549细胞活性的影响
Figure 7 Effect of 1 500 V/cm μsPEF combined with EPA on the viability of A-549 cells
从μsPEF对EPA毒性效果的提升程度来看,EPA浓度为300 μmol/L时,外加μsPEF对EPA细胞毒性效果提升程度最显著。以EPA浓度300 μmol/L时为例,场强为1 000 V/cm时,μsPEF与EPA联合作用下A-549细胞活性比单独施加EPA时降低了32.77%(24 h)和39.35%(48 h);场强为1 250 V/cm时,细胞活性降分别降低了36.17%(24 h)和41.86%(48 h);场强为1 500 V/cm时,细胞活性分别降低了51.52%(24 h)和53.08%(48 h)。这也表明,在EPA浓度相同时,随着电场强度的升高,μsPEF与EPA的联合作用效果也越强。
但值得注意的是,场强为1 500 V/cm的μsPEF单独处理细胞后培养48 h,细胞活性就已经下降到65%左右,此时脉冲电场本身就对细胞有较强的活性抑制效果,所以此参数下细胞活性减弱的主要原因可能是脉冲电场本身。
3 讨论
有研究表明,μsPEF诱导细胞膜的电穿孔效应与细胞尺寸大小相关,细胞半径越大,在外加电场作用下形成的跨膜电位就越大,就更容易达到穿孔阈值[12]。本文所用A-549细胞直径大约在15 μm,根据PI染色实验结果可知:场强为750 V/cm时,A-549细胞已出现了电穿孔,但是电穿孔率低;当电场强度高于1 000 V/cm时,PI染色率显著增加。以上表明,在μsPEF作用下,细胞膜表面形成孔洞,使细胞膜通透性增加;并且细胞活性检测结果显示,μsPEF对细胞的杀伤效果不强,没有影响细胞的正常生理活性,即细胞膜表面出现了可逆电穿孔。
EPA是n-3多不饱和脂肪酸之一,人体自身不能合成,只能从食物中摄取。目前研究认为,EPA有预防肿瘤的发生、抑制肿瘤生长的作用。本研究结果显示,EPA对A-549的细胞毒性始终呈现出剂量和时间依赖性:浓度越高,细胞毒性越强;并且在相同EPA浓度下,培养48 h要比培养24 h时对细胞毒性更强。有研究表明,不饱和脂肪酸可以对包括肺癌在内的各种癌细胞产生选择性细胞毒性,不会对正常细胞产生不良影响[13],EPA能诱导剂量和时间依赖性的细胞死亡[14],并且能够抑制肺癌A-549肿瘤细胞的增殖活性[15],这与本文的EPA毒性实验结果一致。
综合来看,脉冲电场作用后培养24 h和48 h,μsPEF都能够显著增强EPA对A-549细胞的毒性效果,并且其联合作用效果(μsPEF对EPA抑制A-549细胞活性效果的促进作用)并不是完全与EPA浓度和电场强度呈正相关。当EPA浓度为300 μmol/L时联合效果最佳,当EPA浓度<300 μmol/L,其联合作用效果与EPA浓度和电场强度呈正相关;当EPA浓度>300 μmol/L,联合作用效果随EPA浓度升高和场强增加而逐渐减弱。
需要注意的是,相同EPA浓度下,电场强度越高,对EPA抑制A-549细胞活性效果的促进作用也越强,不同场强的脉冲电场本身对细胞活性有不同程度的影响。进一步对比分析可知,场强为1 250 V/cm时联合作用效果比1 000 V/cm时略强,然而1 250 V/cm的μsPEF本身对细胞的杀伤作用也比1 000 V/cm时略强,故其联合作用效果与1 000V/cm相比无显著性差别。场强为1 500 V/cm时,脉冲电场本身对细胞具有较强的杀伤作用,所以有更强的联合作用效果,考虑到此时电场本身对细胞的强杀伤,综合分析联合作用效果不如场强为1 000 V/cm和1 250 V/cm时的作用效果。
4 结论
(1)EPA对A-549细胞的杀伤效果具有时间和浓度依赖性。
(2)μsPEF能够增强A-549细胞膜通透性。随着电场强度的增加,细胞通透性增强,细胞活性减弱。当电场强度为1 000 V/cm和1 250 V/cm时,能够保证对细胞的低杀伤率和高穿孔率,有利于药物分子进入细胞。
(3)μsPEF能有效增强EPA对A-549细胞的毒性效果。μsPEF联合EPA处理A-549细胞后培养24 h和48 h,都是在EPA浓度为300 μmol/L时,μsPEF与EPA的联合作用效果最佳,μsPEF能使EPA毒性效果提升40%以上。
[1] DAVALOS R V, MIR L M, RUBINSKY B. Tissue ablation with irreversible electroporation[J]. Annals of biomedical engineering, 2005, 33(2): 223-231.
[2] 卢强, 闫小龙, 黄立军, 等. 高压电场不可逆电穿孔诱发A549肺癌细胞凋亡的实验研究[J]. 现代生物医学进展, 2014, 14(3): 425-428, 556.
LU Q, YAN X L, HUANG L J, et al. Empirical study of A549 lung cancer cells apoptosis induced by irreversible electroporation of high voltage electric field[J]. Progress in modern biomedicine, 2014, 14(3): 425-428, 556.
[3] 张涛, 郭一民, 李卓扬, 等. 碳量子点诱导人体肝癌细胞凋亡的研究[J]. 郑州大学学报(工学版), 2020, 41(5): 1-7.
ZHANG T, GUO Y M, LI Z Y, et al. Carbon quantum dots as potent agent to induce apoptosis of human hepatoma cells[J]. Journal of Zhengzhou university (engineering science), 2020, 41(5): 1-7.
[4] WEAVER J C. Electroporation of biological membranes from multicellular to nano scales[J]. IEEE transactions on dielectrics and electrical insulation, 2003, 10(5): 754-768.
[5] MCBRIDE S, AVAZZADEH S, WHEATLEY A M, et al. Ablation modalities for therapeutic intervention in arrhythmia-related cardiovascular disease: focus on electroporation[J].Journal of clinical medicine, 2021, 10(12): 2657.
[6] MIR L M. Bases and rationale of the electrochemotherapy[J]. European journal of cancer supplements, 2006, 4(11): 38-44.
[7] ZHANG L Z, GAO S G, HE J. The role of maintenance therapy in the treatment of elderly non-small-cell lung cancer patients: a meta-analysis of randomized controlled trials[J]. Drug design, development and therapy, 2017, 11: 3435-3440.
[8] 杨曦月, 杜小波. 晚期非小细胞肺癌治疗方案的研究进展及三线治疗探索[J]. 保健医学研究与实践, 2021, 18(4): 137-143.
YANG X Y, DU X B. Research progress of treatment options for advanced non-small cell lung cancer and exploration of third-line treatment[J]. Health medicine research and practice, 2021, 18(4): 137-143.
[9] 玄永哲, 南昶辉, 马刘江, 等. 二十碳五烯酸协同长春瑞滨对人肺癌A-549细胞的作用[J]. 延边大学医学学报, 2012, 35(3): 210-214.
XUAN Y Z, NAN C H, MA L J, et al. Effects of eicosapentaenoic acid and its synergistic effects with vinorelbine on A-549 human lung cancer cell line[J]. Journal of medical science Yanbian university, 2012, 35(3): 210-214.
[10] BERQUIN I M, EDWARDS I J, CHEN Y Q. Multi-targeted therapy of cancer by omega-3 fatty acids[J]. Cancer letters, 2008, 269(2): 363-377.
[11] OGO A, MIYAKE S, KUBOTA H, et al. The mechanism of the synergistic anticancer effect of CDDP and EPA in the TE1 cell line[J]. Anticancer research, 2021, 41(4): 1771-1778.
[12] 姚陈果, 宁郡怡, 刘红梅, 等. 微/纳秒脉冲电场靶向不同尺寸肿瘤细胞内外膜电穿孔效应研究[J]. 电工技术学报, 2020, 35(1): 115-124.
YAO C G, NING J Y, LIU H M, et al. Study of electroporation effect of different size tumor cells targeted by micro-nanosecond pulsed electric field[J]. Transactions of China electrotechnical society, 2020, 35(1): 115-124.
[13] ZAJDEL A, WILCZOK A, TARKOWSKI M. Toxic effects of n-3 polyunsaturated fatty acids in human lung A549 cells[J]. Toxicology in vitro, 2015, 30(1): 486-491.
[14] MORTAZ E, MOLOUDIZARGARI M, KHOSRAVI A, et al. EPA and DHA have selective toxicity for PBMCs from multiple myeloma patients in a partly caspase-dependent manner[J]. Clinical nutrition, 2020, 39(7): 2137-2143.
[15] OONO K, OHTAKE K, WATANABE C, et al. Contribution of Pyk2 pathway and reactive oxygen species (ROS) to the anti-cancer effects of eicosapentaenoic acid (EPA) in PC3 prostate cancer cells[J]. Lipids in health and disease, 2020, 19(1): 15-22.