0 引言
纳米材料在癌症治疗中越来越受到重视,但在提高治疗效果和减少副作用方面仍面临巨大挑战[1-11]。其中,碳纳米材料因其独特的物理化学结构和性质引起了人们极大的兴趣[3-6]。碳量子点(CQDs)是继富勒烯、碳纳米管和石墨烯之后的新型碳纳米材料。碳量子点具有强荧光、宽波长连续激发光、发射光可调的优良电子受体和给体、良好的水溶性、低生物毒性等特点[12-17],因此,碳量子点被认为是一种理想的生物医学材料,在生物医学和细胞成像领域具有广阔的应用前景[12]。除了进一步推进碳量子点的现有应用外,探索其新的应用领域同样具有重要意义。
由于碳量子点具有很强的荧光特性,在肿瘤研究领域,它主要被应用于生物标记、细胞成像等方面。例如,人类乳腺癌细胞可以用碳量子点标记。不同粒径的碳量子点可以到达细胞内不同的位置,因此不同粒径的碳量子点可以标记细胞的不同部位。近年来,碳量子点已被用作肿瘤治疗的药物载体[18],然而关于碳量子点如何直接影响肿瘤细胞的报道却很少。富勒烯衍生物的抗肿瘤特性已被报道,尽管它们对正常人体细胞仍具有一定的细胞毒性[19-20],但据此也可以期望碳量子点可能会对肿瘤细胞产生一些影响。本研究的目的是制备一种稳定的碳量子点溶胶,该溶胶能诱导癌细胞凋亡,但对正常的人体细胞几乎无损伤。本文研究认为碳量子点的尺寸和表面特性在抗肿瘤中起着重要的作用。据报道,合成具有不同粒径、性质的稳定碳量子点溶胶有多种方法[21-25],在这些方法中,石墨脉冲电解法是一种有效的方法。
肝癌位居全球常见癌症第6位,55%患者是中国人,但肝癌药物治疗的临床疗效还不尽人意,寻找能有效诱导肝癌细胞凋亡的药物迫在眉睫[26-28]。正因此,本文首先考虑以人体肝癌细胞作为对象验证碳量子点溶胶的抗肿瘤效果。采用脉冲电解法成功制备了稳定的碳量子点溶胶,并首次报道了其对人体肝癌细胞(HepG2细胞)的生物毒性。利用Cell Counting Kit-8(CCK-8)和流式细胞仪,通过体外细胞实验对肿瘤细胞的凋亡进行检测以确定其抗肿瘤效果。用透射电子显微镜观察了HepG2细胞对碳量子点的内吞作用。同时,通过体外实验检测碳量子点对人体淋巴细胞的影响以研究其免疫毒性。除了体外试验外,活体动物实验也证实了碳量子点的抗肿瘤作用,这部分结果将在其他地方讨论。简言之,本文所描述的实验结果为碳量子点的进一步生物应用提供了重要的参考信息。
1 试验方案
1.1 试验材料
胎牛血清、Dulbecco改良eagle培养基(DMEM,high glucose containing sugar L-glutamine)、胰蛋白酶-EDTA消化液(trypsin-EDTA digestion,0.25%)、青霉素-链霉素溶液(penicillin-streptomycin solution,100×)和磷酸盐缓冲液(phosphate buffer solution,PBS)购自美国的Sigma-Aldrich公司。CCK-8和Annexin V-FITC/DAPI双染色细胞凋亡检测试剂盒从中国凯基生物有限公司购买。Triton X-100和人体外周血液淋巴细胞分离培养基购自美国的Invitrogen公司。其他化学试剂为分析纯。石墨板(100 mm×30 mm×5 mm,纯度(质量分数)为99.9%)购自北京吉星盛安有限公司(中国)。新鲜人体外周血淋巴细胞采集于某医院门诊患者。
1.2 碳量子点溶胶的制备与表征
石墨板(100 mm×30 mm×5 mm,纯度(质量分数)99.9%)作为制备该溶胶的碳源。采用脉冲电解法制备碳量子点溶胶。具体电解方法为:将2块石墨板平行放置于水槽(150 mm×80 mm×60 mm)中,板间距为10 mm,然后注入500 mL去离子水,接着将2块石墨板分别连接单极脉冲电源(京新电源设备有限公司,中国)的正、负极,通电电解(电压为5 V,频率为20 kHz)一定时间后即可制备出该碳量子点溶胶。为了获得更细的颗粒,在150 MPa压力下对该原始胶体进行均化处理,每个样品处理15次。
将溶胶滴到硅片上,在空气中干燥,制备出用于X射线衍射仪(XRD,D/max 2500)检测的样品。将碳量子点溶胶滴到孔径48 μm的铜微栅上(Ted Pella),待其在空气中干燥后,在200 kV下使用透射电子显微镜(TEM,JEM-2100F)观察样品。利用Image J软件对TEM图像进行分析,从而确定其尺寸。
1.3 细胞培养
人体肝癌细胞(HepG2细胞)购自American Type Culture Collection公司。HepG2细胞于DMEM培养基(混入体积分数为10%的热灭活胎牛血清和100 μg/mL的青霉素-链霉素溶液)中进行培养,培养时温度为37 ℃,CO2体积分数为5%。选择对数生长期细胞(logarithmic growth phase cells)制备成细胞悬液,然后将悬液随机分为4组,接种于96孔培养板(culture plate)中直至贴壁,培养板每孔体积为100 μL(1×105个细胞/孔)。从外周血液中分离出淋巴细胞,并用上述方法进行培养。
1.4 碳量子点溶胶对HepG2细胞毒性的体外研究
用CCK-8检测碳量子点溶胶对HepG2细胞的毒性。简单地说,HepG2细胞(1×105个细胞/孔)在96孔培养板中,于37 ℃、体积分数为5%的CO2环境下用100 μL的新鲜培养液培养。培养24 h后,用不同质量浓度的碳量子点溶胶(C1=69 μg/mL,C2=138 μg/mL,C3=276 μg/mL)处理HepG2细胞24、48、72 h,然后加入10 μL的CCK-8溶液(2 mg/mL)。孵化2 h后,用微型读板器(Bio-Rad,CA,美国)在450 nm的测试波长和630 nm的参考波长下测量吸光度(OD值)。试验重复进行3次。用光学显微镜进一步观察经浓度分别为C2和C3的碳量子点溶胶处理72 h后的细胞形态学变化。取未经碳量子点溶胶处理的样品作为对照组。
1.5 HepG2细胞凋亡检测
选用Annexin V-FITC/DAPI双染法检测HepG2细胞的凋亡情况。Annexin V-FITC凋亡检测试剂盒(apoptosis detection kit)是通过检测细胞表面磷脂酰丝氨酸来检测早期细胞凋亡的敏感指标之一。DAPI作为一种核酸染料,只能染红中晚期的凋亡细胞和死亡细胞。在96孔板上培养细胞,然后用不同质量浓度(C1=69 μg/mL,C2=138 μg/mL,C3=276 μg/mL)的碳量子点溶胶对细胞进行处理。孵化48 h和72 h后,除去胰酶消化液的EDTA,收集细胞。随后,离心弃上清,用PBS漂洗2遍,收集到流式管(flow tube)中。然后,加入500 μL的缓冲液(binding buffer)使细胞悬浮。加入50 μL Annexin V-FITC/DAPI染料,室温避光孵育15 min。最后,立即使用流式细胞仪(flow cytometry,BD FACSCantoTM II,San Jose,CA)分析。
1.6 细胞形态学观察
将HepG2细胞以1×105个细胞/孔的密度在24孔培养板中培养过夜,然后用C3质量浓度的碳量子点溶胶处理72 h,最后用透射电子显微镜观察处理组和对照组的HepG2细胞形态及碳量子点在HepG2细胞内的分布。
1.7 碳量子点溶胶对淋巴细胞毒性的体外研究
简言之,淋巴细胞(1×105个细胞/孔)在96孔板中,用100 μL新鲜培养液在37 ℃、体积分数为5%的CO2环境下进行培养。培养24 h后,用不同质量浓度(C1、C2、C3)的碳量子点溶胶处理淋巴细胞24、48和72 h,然后加入10 μL的CCK-8溶液(2 mg/mL)。孵化2 h后,用微型读板器(Bio-Rad,CA,美国)在450 nm的测试波长和630 nm的参考波长条件下测量吸光度。试验重复进行3次。取未经碳量子点溶胶处理的样品作为对照组。
1.8 统计分析方法
用IBM SPSS Statistics 20进行统计分析。采用Wilcoxon检测法研究处理组和对照组在细胞存活率上的差异。数据以平均数±标准差(SD)表示。当P < 0.05时,认为具有统计学意义上的显著差异。
2 分析与讨论
本文研究了脉冲电解法制备的碳量子点溶胶的性质和抗肿瘤效果。一般来说,纳米颗粒的形状和尺寸与其在人体内的毒性和生物分布直接相关,因此,利用TEM对制备的碳量子点的形貌和尺寸进行了表征。图1(a)和1(b)展示了碳量子点的TEM图像。很明显,碳量子点呈近似球形,粒径为3.73~10.19 nm,平均粒径为6.93 nm,如图1(c)所示。结果表明,这些碳量子点能很好地分散在水中形成稳定的胶体溶液。在高分辨率TEM图像(图1(b))中标注的0.205 nm的晶格间距对应于石墨的(101)面。如图1(d)所示,碳量子点的XRD谱图展现出一个漫散射峰,为典型的非晶态结构,这可能是由于制备的碳量子点尺寸过小和一些碳量子点中原子的不规则排列造成的。采用傅里叶变换红外光谱(FT-IR)检测来识别碳量子点表面的官能团,如图1(e)所示。3 436 cm-1附近的宽峰对应于C—OH的拉伸振动。C—H(2 925 cm-1)和C![]() O(1 711 cm-1)的拉伸振动表明烷基官能团的存在。1 237 cm-1处的吸收峰表明C—O官能团的存在。红外光谱分析表明,碳量子点表面含有多种含氧官能团,这可能是碳量子点具有抗肿瘤作用的关键。碳量子点的光致发光光谱表明这些碳量子点具有荧光性质,如图1(f)所示。
O(1 711 cm-1)的拉伸振动表明烷基官能团的存在。1 237 cm-1处的吸收峰表明C—O官能团的存在。红外光谱分析表明,碳量子点表面含有多种含氧官能团,这可能是碳量子点具有抗肿瘤作用的关键。碳量子点的光致发光光谱表明这些碳量子点具有荧光性质,如图1(f)所示。
采用CCK-8评价碳量子点对HepG2细胞的毒性(图2)。数据表明,细胞活性受到了抑制,并且溶胶浓度和时间会对这种抑制效果产生影响。在处理72 h后,C2组和C3组展现出高于其他组的细胞毒性,而低浓度组(C1组)在测试期内展现的毒性不显著。结果表明,C2和C3处理72 h条件下碳量子点溶胶对肿瘤细胞具有显著的毒性。光学显微镜观测结果进一步验证了溶胶浓度对细胞毒性的影响(图3)。
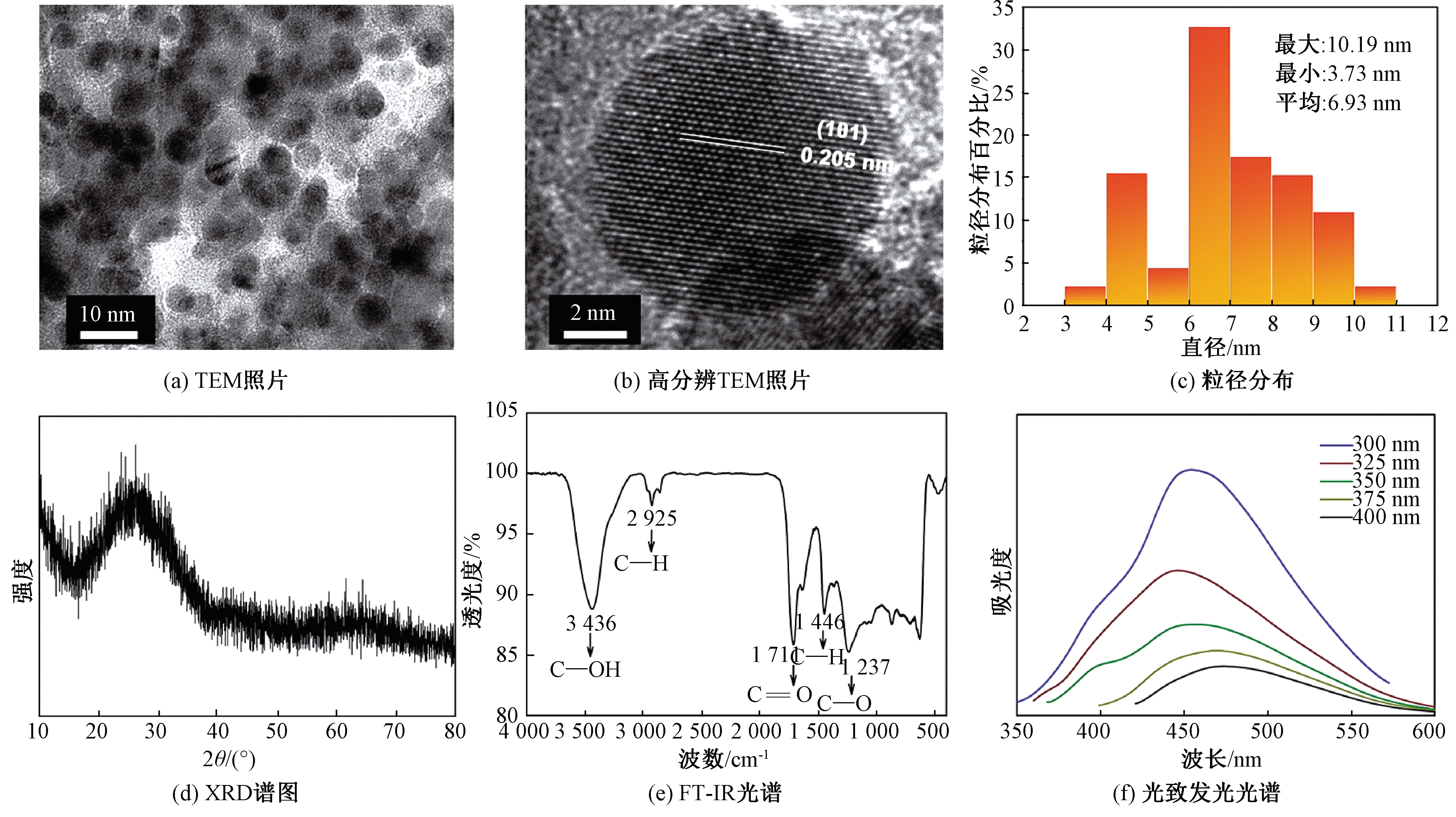
图1 碳量子点溶胶的材料学表征
Figure 1 The material characterization of the as-prepared CQDs
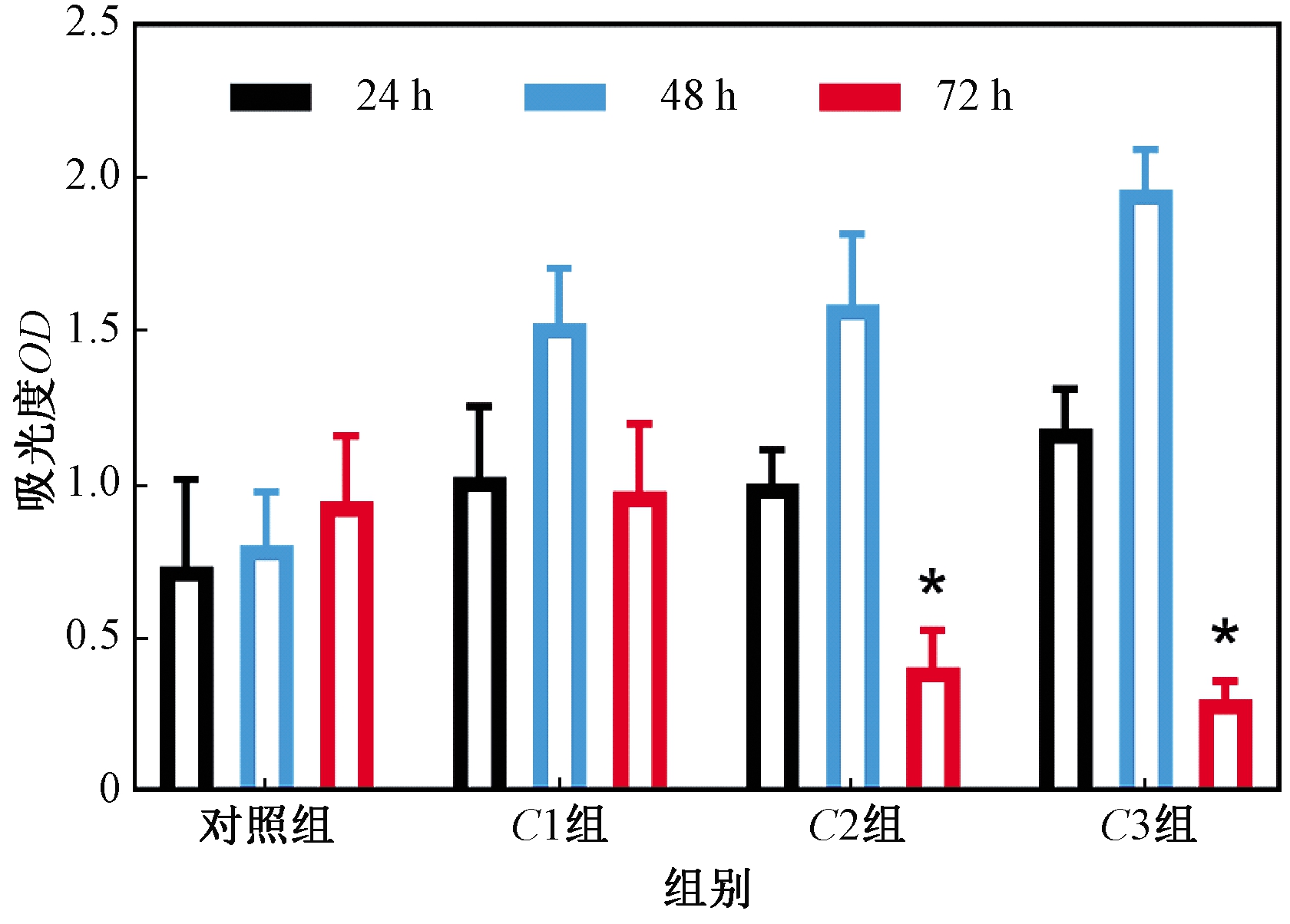
图2 碳量子点溶胶的质量浓度对HepG2细胞的体外细胞毒性的影响(误差棒指标准偏差(n=3))
Figure 2 In vitro cytotoxicity of CQDs on HepG2 cells(Error bars indicate SD (n=3))
采用Annexin V-FITC/DAPI双染法研究碳量子点溶胶的细胞凋亡诱导能力。基于联合染色法,利用流式细胞仪可区分早期凋亡细胞和晚期凋亡细胞。流式细胞分析结果(图4)显示,经碳量子点溶胶处理72 h后的HepG2细胞,C1、C2和C3对应的总凋亡率分别为19.38%、22.86%和28.73%。C2、C3组细胞凋亡率明显高于对照组(16.68%,P<0.05),与细胞毒性试验结果一致(图2)。该部分结果表明,碳量子点溶胶是一种有效的抗肿瘤药物,可诱导HepG2细胞凋亡。
通过TEM观察碳量子点与在C3质量浓度下孵化72 h后的HepG2细胞之间的相互作用,以检测它们可能的内吞现象(图5)。未经碳量子点溶胶处理的细胞未见异常。但是对于处理后的细胞,可以看到,碳量子点被HepG2细胞摄取并积累在细胞质内,说明细胞成功摄取了碳量子点。碳量子点的目标似乎是细胞的线粒体。从图5中可以看出,HepG2细胞的线粒体有明显肿胀,冠(crests)消失。这些结果表明,碳量子点可能对线粒体有害,从而诱导HepG2细胞凋亡。碳量子点在HepG2细胞线粒体中积累的趋势被认为与活性氧的产生有关,活性氧可导致氧化应激反应,具体相关机理可参考Ag-NPs的有关报道[29]。然而,碳量子点在线粒体中的沉积机制尚不清楚。因此,需要进一步研究碳量子点溶胶对线粒体的影响,以及碳量子点的内吞途径。

图3 在不同浓度碳量子点溶胶中培养72 h后HepG2细胞的代表性光学显微照片
Figure 3 Representative optical microscopy images of HepG2 cells incubated with CQDs of different concentrations for 72 h
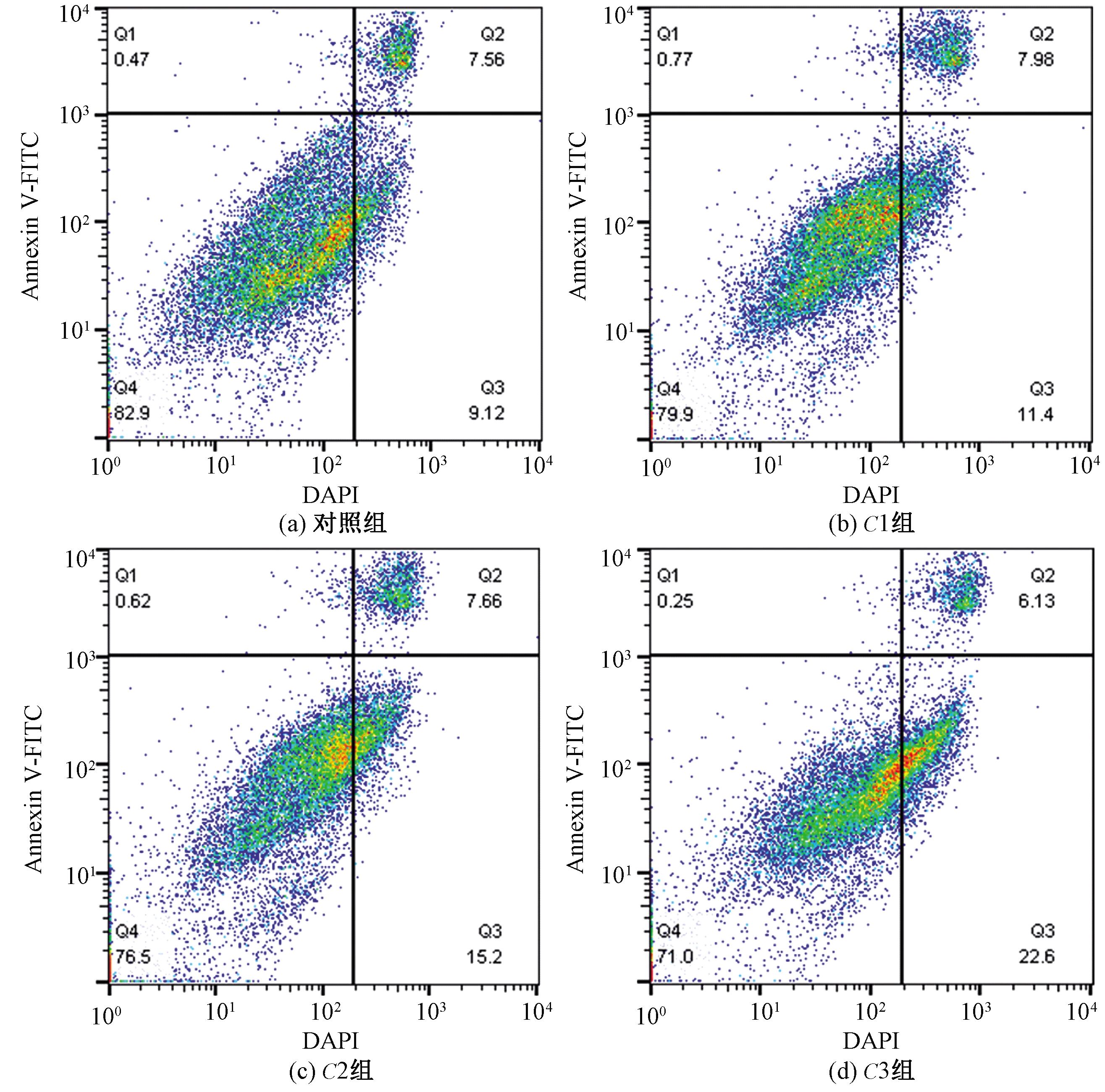
图4 经过不同浓度的碳量子点溶胶处理72 h后HepG2细胞凋亡的流式细胞仪分析结果
Figure 4 Flow cytometry analysis of HepG2 cells’ apoptosis after treatment with CQDs of different concentrations for 72 h
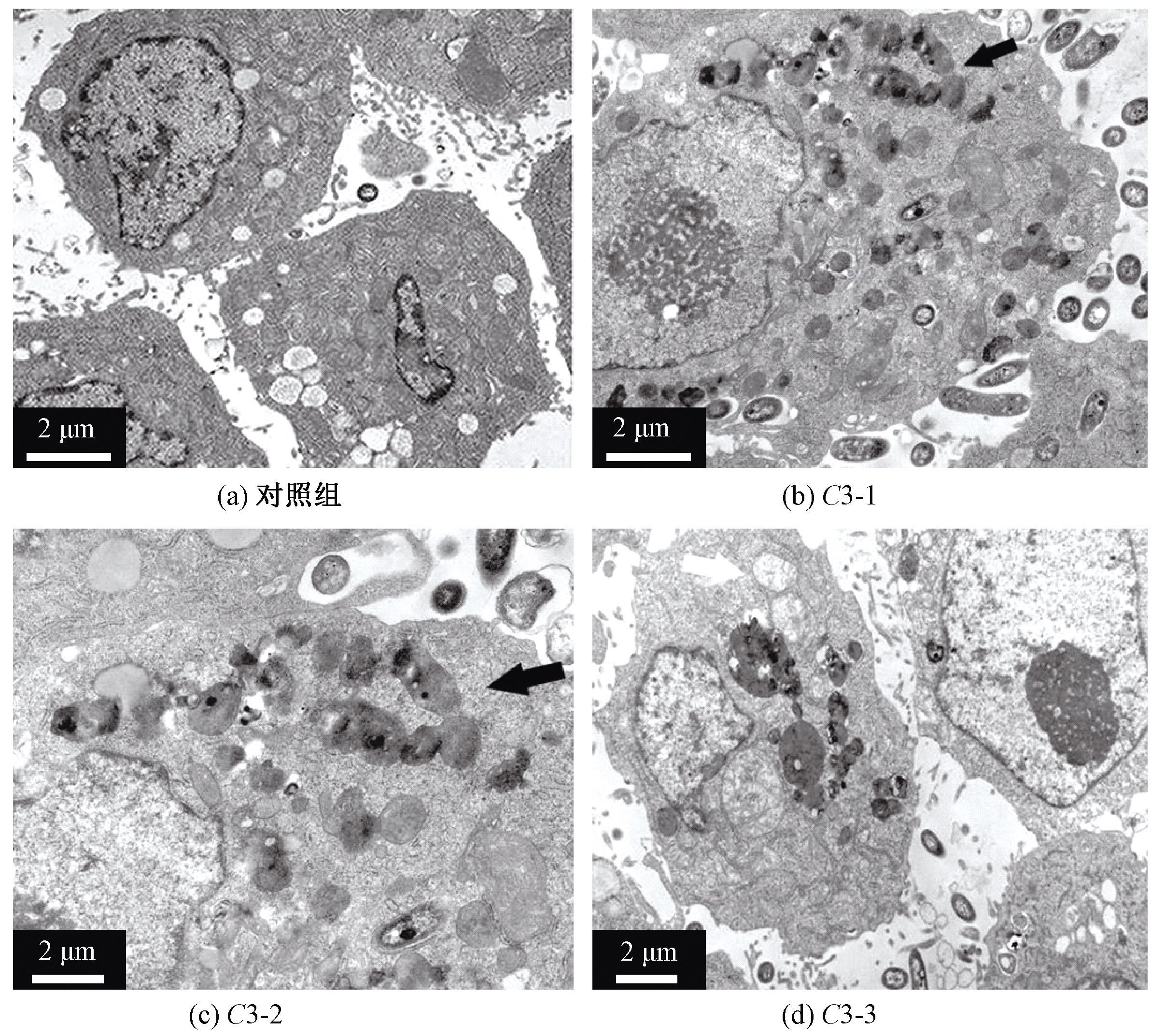
图5 经碳量子点溶胶处理72 h后的HepG2细胞的TEM照片(黑色箭头表示细胞内部的碳量子点,白色箭头表示线粒体)
Figure 5 TEM images of HepG2 cells after incubation with CQDs for 72 h(The black arrow denotes the CQDs inside cells, and the white arrow shows the mitochondrion of HepG2 cells)
以上结果一致表明碳量子点溶胶对HepG2细胞具有较强的细胞毒性。显然,应当考虑碳量子点溶胶对正常人体细胞可能产生的毒性,因此本文采用CCK-8来研究碳量子点溶胶对人体淋巴细胞的毒性。如图6所示,与HepG2细胞相比,在不同的质量浓度和时间条件下经碳量子点溶胶处理后,淋巴细胞的活性均无明显变化。综合以上结果,可发现本文制备的碳量子点溶胶对HepG2细胞具有显著的靶向攻击能力,对淋巴细胞并没有显示出明显的毒性。
3 结论
采用石墨脉冲电解法制备了稳定的碳量子点溶胶。对碳量子点溶胶的基本性质进行了系统研究。碳量子点呈近似球形,粒径范围及平均粒径分别为3.73~10.19 nm和6.93 nm。红外光谱分析及光致发光光谱表明碳量子点表面含有多种含氧官能并具有荧光特性。碳量子点溶胶可诱导肝癌细胞的凋亡,但对人体淋巴细胞无明显影响。透射电子显微镜观察结果显示碳量子点通过对线粒体产生损伤从而诱导人体肝癌细胞凋亡。虽然诱导凋亡的机制是由基因表达引起的还是代谢活动的结果还不能确定并有待于进一步研究,但是具有选择性诱导癌细胞凋亡作用的碳量子点溶胶有望成为新型无毒副作用的抗癌药物。
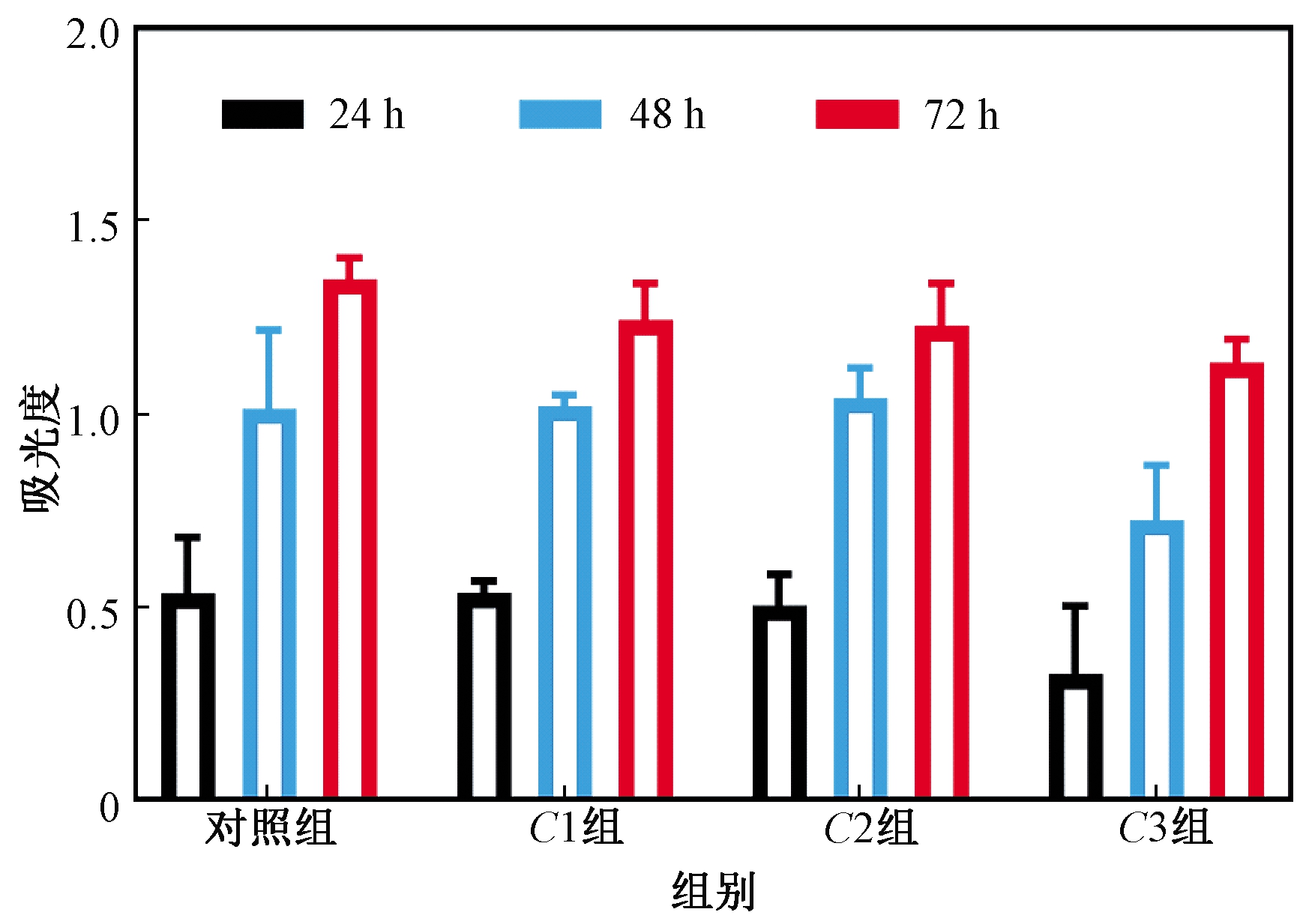
图6 碳量子点溶胶的浓度(C1、C2、C3)和处理时间
(24、48、72 h)对人体淋巴细胞的体外细胞毒性的
影响(误差线表示标准偏差(n=3))
Figure 6 In vitro cytotoxicity of CQDs on human lymphocytes at C1, C2, C3 for 24, 48 and 72 h (Error bars indicate SD (n=3))
[1] VANKAYALA R, HWANG K C. Near-infrared-light-activatable nanomaterial-mediated phototheranostic nanomedicines: an emerging paradigm for cancer treatment[J]. Advanced materials, 2018, 30(23): 1706320.
[2] SANG W, ZHANG Z, DAI Y L, et al. Recent advances in nanomaterial-based synergistic combin-ation cancer immunotherapy[J]. Chemical society reviews, 2019, 48(14): 3771-3810.
[3] DE S, PATRA K, GHOSH D, et al. Tailoring the efficacy of multifunctional biopolymeric-graphene oxide quantum dot based nanomaterial as nanocargo in cancer therapeutic application[J]. ACS biomaterials science and engineering, 2018, 4(2): 514-531.
[4] LI H T, KANG Z H, LIU Y, et al. Carbon nanodots: synthesis, properties and applications[J]. Journal of materials chemistry, 2012, 22(46): 24230-24253.
[5] ZHU Y, LI J, LI W X, et al. The biocompatibility of nanodiamonds and their application in drug delivery systems[J]. Theranostics, 2012, 2(3): 302-312.
[6] TOLKACHOV M, SOKOLOVA V, LOZA K, et al. Study of biocompatibility effect of nanocarbon particles on various cell types in vitro[J]. Materialwissenschaft und werkstofftechnik, 2016, 47(2/3): 216-221.
[7] CHAN W C W, MAXWELL D J, GAO X H, et al. Luminescent quantum dots for multiplexed biological detection and imaging[J]. Current opinion biotechno-logy, 2002, 13(1): 40-46.
[8] CHONG S X, JIN Y X, AU-YEUNG S C F, et al. New Pt-NNSO core anticancer agents: structural optimization and investigation of their anticancer activity[J]. Journal of inorganic biochemistry, 2017, 170: 34-45.
[9] WANG X P, GUO Q L, TAO L, et al. E platinum, a newly synthesized platinum compound, induces apoptosis through ROS-triggered ER stress in gastric carcinoma cells[J]. Molecular carcinogenesis, 2017, 56(1): 218-231.
[10] SINGH R, NALWA H S. Medical applications of nanoparticles in biological imaging, cell labeling, antimicrobial agents, and anticancer nanodrugs[J]. Journal of biomedical nanotechnology, 2011, 7(4): 489-503.
[11] ABU-SURRAH A S, KETTUNEN M. Platinum group antitumor chemistry: design and development of new anticancer drugs complementary to cisplatin[J]. Current medicinal chemistry, 2006, 13(11): 1337-1357.
[12] KUMARI A, KUMAR A, SAHU S K, et al. Synthesis of green fluorescent carbon quantum dots using waste polyolefins residue for Cu2+ ion sensing and live cell imaging[J]. Sensors and actuators B: chemical, 2018, 254: 197-205.
[13] SINGH V K, SINGH V, YADAV P K, et al. Nitrogen doped fluorescent carbon quantum dots for on-off-on detection of Hg2+ and glutathione in aqueous medium: live cell imaging and IMPLICATION logic gate operation[J]. Journal of photochemistry and photobiology A: chemistry, 2019, 384: 112042.
[14] ZHOU L F, QIAO M, ZHANG L, et al. Green and efficient synthesis of carbon quantum dots and their luminescent properties[J]. Journal of luminescence, 2019, 206: 158-163.
[15] LI J Z, LIU K, XUE J L, et al. CQDs preluded carbon-incorporated 3D burger-like hybrid ZnO enhanced visible-light-driven photocatalytic activity and mechanism implication[J]. Journal of catalysis, 2019, 369: 450-461.
[16] SU A Q, CHEN M K, FU Z H, et al. Hybridizing engineering strategy of non-lacunary (nBu4N)4W10O32 by carbon quantum dot with remarkably enhanced visible-light-catalytic oxidation performance[J]. Applied catalysis A: general, 2019, 587: 117261.
[17] CUI B, FENG X T, ZHANG F, et al. The use of carbon quantum dots as fluorescent materials in white LEDs[J]. New carbon materials, 2017, 32(5): 385-401.
[18] WANG H, DI J, SUN Y B, et al. Biocompatible PEG-Chitosan@Carbon dots hybrid nanogels for two-photon fluorescence imaging, near-infrared light/pH dual-responsive drug carrier, and synergistic therapy[J]. Advanced functional materials, 2015, 25(34): 5537-5547.
[19] ZHANG Y, SHU C Y, ZHEN M M, et al. A novel bone marrow targeted gadofullerene agent protect against oxidative injury in chemotherapy[J]. Science China materials, 2017, 60(9): 866-880.
[20] ZHOU Y, ZHEN M M, GUAN M R, et al. Amino acid modified [70] fullerene derivatives with high radical scavenging activity as promising bodyguards for chemotherapy protection[J]. Scientific reports , 2018, 8: 16573.
[21] BAKER S N, BAKER G A. Luminescent carbon nanodots: emergent nanolights[J]. Angewandte chemie international edition, 2010, 49(38): 6726-6744.
[22] SUN Y P, ZHOU B, LIN Y, et al. Quantum-sized carbon dots for bright and colorful photoluminescence[J]. Journal of the American chemical society, 2006, 128(24): 7756-7757.
[23] BOURLINOS A B, STASSINOPOULOS A, ANGLOS D, et al. Photoluminescent carbogenic dots[J]. Chemistry of materials, 2008, 20(14): 4539-4541.
[24] ZHAO Q L, ZHANG Z L, HUANG B H, et al. Facile preparation of low cytotoxicity fluorescent carbon nanocrystals by electrooxidation of graphite[J]. Chemical communications, 2008,44(41): 5116-5118.
[25] LIU H P, YE T, MAO C D. Fluorescent carbon nanoparticles derived from candle soot[J]. Angewandte chemie international edition, 2007, 46(34): 6473-6475.
[26] 周军民,廖端芳,杨小平,等. Manunycin对人肝癌HepG2细胞的生长抑制作用与Ras通路的关系[J]. 癌症, 2002, 21(4): 364-368.
[27] 陈建国,宋新明. 中国肝癌发病水平的估算及分析[J]. 中国肿瘤, 2005, 14(1): 28-31.
[28] 张茜,芮瑞,李佩佩,等. 草乌多糖金属配合物的制备、表征与抗癌活性研究[J]. 郑州大学学报(工学版), 2016,37 (3): 36-39.
[29] ASHARANI P V, MUN G L K, HANDE M P, et al. Cytotoxicity and genotoxicity of silver nanoparticles in human cells[J]. ACS nano, 2009, 3(2): 279-290.