0 引言
众所周知,界面在催化和电催化中广泛发挥作用[1]。在各种界面成分中,金属氧化物起着重要作用[2],其形成界面方法有电沉积[3],共沉淀[4]等。金属氧化物电沉积便宜且操作简单,但当通过电沉积构建金属氧化物与金属间界面时,若金属氧化物导电性差则有可能覆盖金属组分,从而减少活性位数量。共沉淀是制备大多数金属氧化物的简单湿化学方法,但是将金属氧化物与金属组分通过沉淀法构筑界面,尚无成熟的方法。
Pd在乙醇[5]和甲酸盐[6]电氧化催化中广泛应用,其与金属氧化物间界面可提高催化剂抗中毒性能[7-8]、活性和耐久性[2]。SnO2[9]是广泛使用且有适当导电性的非碳质金属氧化物,可同时增强Pd活性、稳定性和耐久性。与SnO2相似,CeO2[10]也被广泛用作Pd的助催化组分。与SnO2比,CeO2导电性差,不可避免地限制了其在电催化中的应用。因此,在构筑Pd和CeO2之间界面时,如何既发挥CeO2的积极作用又能避免其不良导电性影响,值得探索。
本研究中,提出一种湿化学方法构筑Pd/CeO2界面,并比较了Pd/CeO2和Pd/SnO2对乙醇和甲酸盐电氧化的催化性能,表明构筑方法可行且Pd/CeO2活性更高。本研究提出并采用的湿化学法可扩展于引入其他金属氧化物与Pd等活性组分构筑界面。
1 实验
1.1 Sn(OH)4和Pd-Sn(OH)4吸附Ce3+的分析方法
本研究通过将Pd沉积在Sn(OH)2部分表面,然后将Sn(OH)2转化为稳定Sn(OH)4,利用其表面OH-对Ce3+的富集和沉淀构筑Pd/CeO2界面,为此需探究Sn(OH)4表面OH-1及Pd对Ce3+的吸附情况。采用重量法进行分析。首先制备Sn(OH)4及饱和沉积Pd的Pd-Sn(OH)4对Ce3+吸附,吸附后溶液中Ce3+转化为草酸铈沉淀、称重并与空白条件下沉淀质量比较。
以Sn(OH)4吸附Ce3+为例:将0.723 7 g SnCl2·2H2O溶于稀HCl溶液中,在搅拌下滴加NaOH溶液至pH值为7。添加约3 mL质量分数为30%的H2O2溶液,将Sn(OH)2氧化为Sn(OH)4,以避免Sn(OH)2存在时发生副反应而改变表面结构。过滤后,将Sn(OH)4滤饼分散于30 mL 9.186×10-3 mol/L的Ce(NO3)3·6H2O溶液中进行1 h吸附实验,抽滤。分别移取8 mL滤液置于两支离心管中,滴加约2 mL 0.179 5 mol/L的Na2C2O4溶液生成草酸铈沉淀,离心沉淀,移走上清液,90 ℃干燥至质量不再变化,记录草酸铈质量。另按以上流程获得无Sn(OH)4吸附时对应的草酸铈质量,根据两次质量差推算Ce3+吸附量。
Pd-Sn(OH)4吸附Ce3+及分析流程参照Sn(OH)4的吸附。Pd-Sn(OH)4的制备方法为:将含0.723 7 g SnCl2·2H2O的稀HCl溶液与NaOH溶液反应制得Sn(OH)2。滴加28 mmol的Na2PdCl4溶液约29 mL至刚检出PdCl42-,继续滴加约3 mL质量分数为30% H2O2溶液,将Sn(OH)2氧化为Sn(OH)4,形成Pd沉积饱和的Pd-Sn(OH)4。Sn(OH)4和Pd-Sn(OH)4吸附Ce3+分析过程如图1所示。
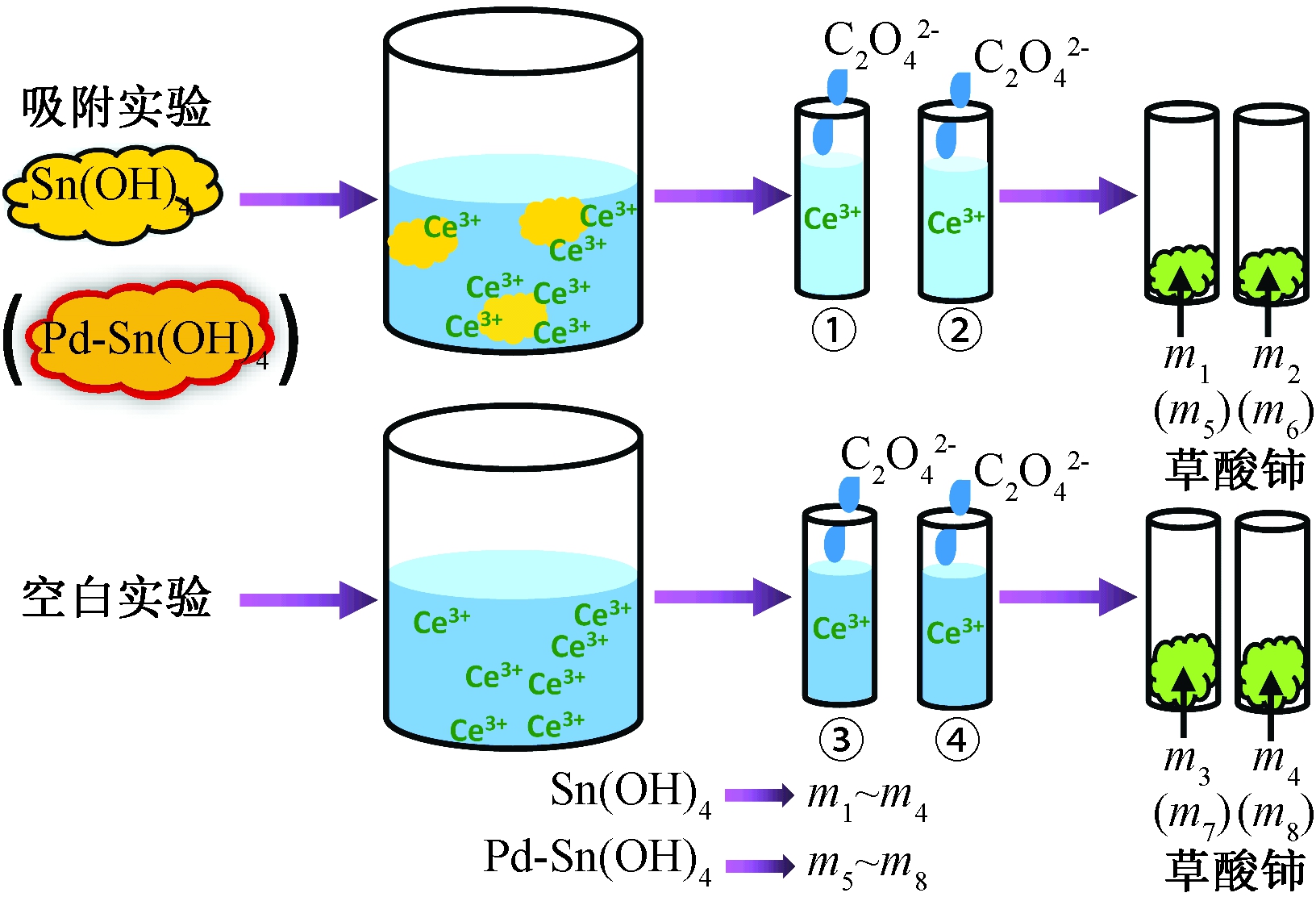
图1 Sn(OH)4和Pd-Sn(OH)4吸附Ce3+分析过程示意图
Figure 1 Schematic diagram of Ce3+analysis process
for Sn(OH)4 and Pd-Sn(OH)4 adsorption.
1.2 Pd/SnO2和Pd/CeO2界面的构筑
为考察Sn(OH)2表面沉积Pd所需Na2PdCl4最大物质的量,将含0.287 5 g SnCl2·2H2O的稀HCl溶液与含0.191 6 g CNTs的均匀分散液在烧杯中混合,搅拌并滴加NaOH溶液至pH值为7,理论形成0.386 2 g Sn(OH)2/CNTs。继续滴加Na2PdCl4溶液使其与Sn(OH)2发生原位氧化还原反应,至溶液中刚检出PdCl42-时停止滴加,此时推得Pd/Sn的最大原子比约为1∶3.78。
Pd/SnO2和Pd/CeO2界面的构筑过程如图2所示。首先利用Sn(OH)2的还原作用沉积Pd,其Pd/Sn原子比约为0.38∶3.78。具体操作为:将含0.287 5 g SnCl2·2H2O的稀HCl溶液与含0.191 6 g CNTs的均匀分散液在烧杯中混合,搅拌下滴加NaOH溶液至pH值为7,继续滴加约4.56 mL 28 mmol的Na2PdCl4溶液,即得约0.4 g Pd/Sn(OH)2/CNTs。抽滤、洗涤、干燥后,将Pd/Sn(OH)2/CNTs粉末于管式炉中空气条件下250 ℃焙烧2.5 h,所得催化剂记为Pd/SnO2/CNTs,使用电感耦合等离子体发射光谱仪(ICP)测其Pd和SnO2的质量分数分别为3.4%和48.3%。
为构筑Pd/CeO2界面,首先制得Pd/Sn原子比为0.38∶3.78的Pd/Sn(OH)2/CNTs 0.4 g,将其分散于水中,磁力搅拌下滴加1.3 mL质量分数为30% H2O2溶液,持续搅拌10 min使Sn(OH)2氧化为Sn(OH)4,再加入0.057 7 g Ce(NO3)3·6H2O搅拌1 h,使Ce3+在Sn(OH)4表面吸附。然后加入0.069 g尿素,将混合物在磁力搅拌下通过75 ℃水浴加热,直到无Ce3+检出。抽滤、洗涤、干燥后,将所得Pd/CeO2(Sn(OH)4)/CNTs粉末在管式炉中空气条件下250 ℃焙烧2.5 h,所得催化剂记为Pd/CeO2(SnO2)/CNTs,使用ICP测其Pd、CeO2和SnO2的质量分数分别为3.2%、5.4%和45.7%。
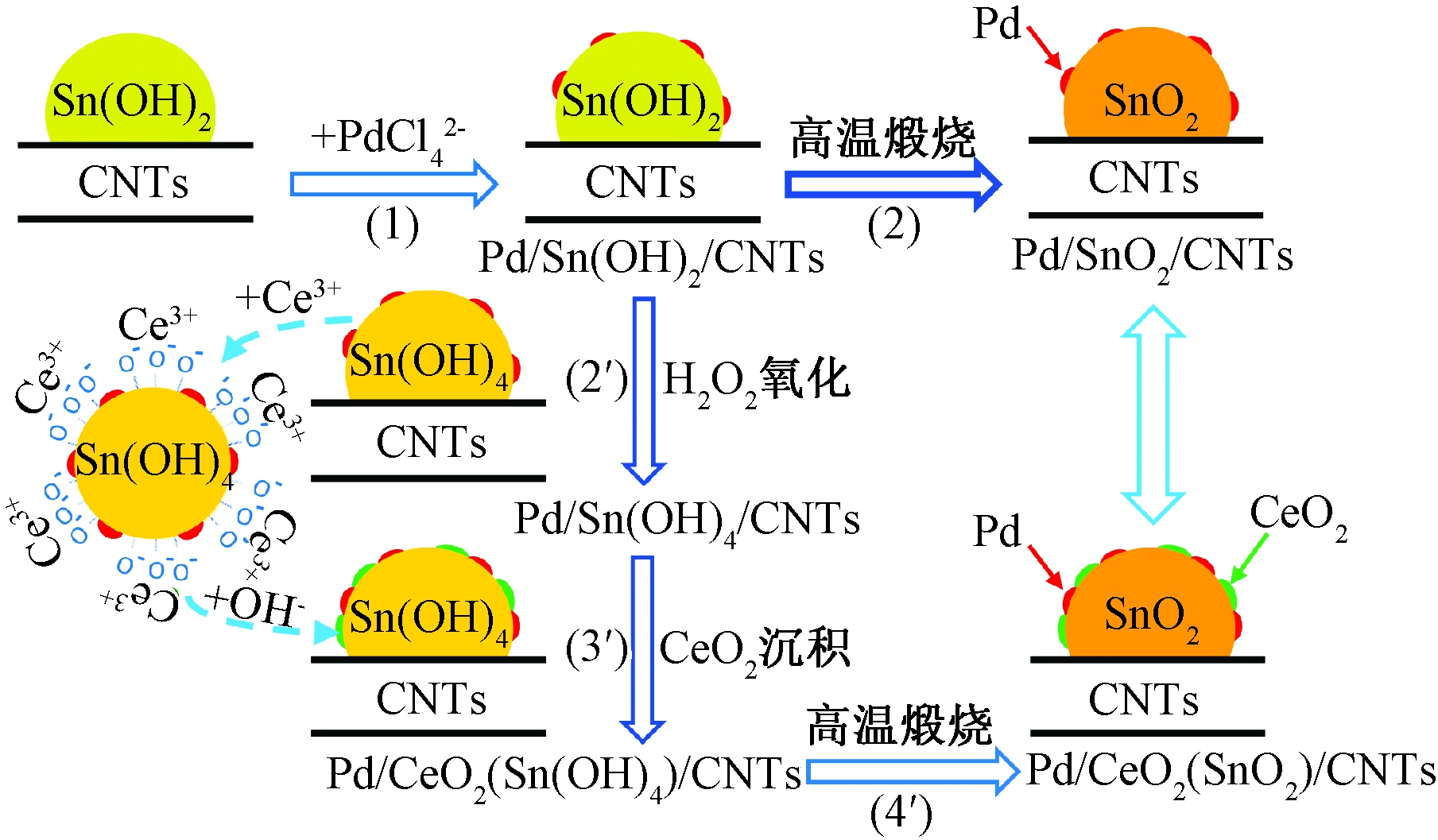
图2 Pd/SnO2/CNTs和Pd/CeO2(SnO2)/CNTs
制备示意图
Figure 2 Illustration for preparing Pd/SnO2/CNTs
and Pd/CeO2(SnO2)/CNTs
1.3 催化剂的物理表征和电化学表征方法
用配有能量色散光谱仪(EDS)的聚焦离子束扫描电子显微镜(SEM)(Auriga FIB SEM)观察形态并检测元素。用X射线光电子能谱(XPS)(*/AXIS Supra)分析表面元素化学状态,将284.6 eV处的C 1 s峰用作内标。
催化剂的电化学测试:用三电极体系在电化学工作站(Zahner Zennium,德国)对催化剂进行电化学表征。涂有催化剂的玻碳电极(GC,Φ=3 mm)为工作电极,铂丝电极作对电极,Hg/HgO电极作参比电极。本文所有电极电势均相对于Hg/HgO参比电极,CV扫描电压为-0.8~0.4 V,扫速为50 mV/s,电流-时间曲线扫描时间为0~3 600 s。
浆料的配制:按催化剂与Nafion固含比为4∶1配制浆料。取1.0 mg催化剂加入含5.0% Nafion的100 μL无水乙醇溶液中,超声分散30 min。用移液枪取催化剂浆料约10 μL,滴涂在玻碳电极表面,自然晾干。
2 结果与分析
2.1 Sn(OH)4和Pd-Sn(OH)4吸附Ce3+的分析结果
表1为Sn(OH)4和Pd-Sn(OH)4吸附Ce3+的分析结果。表1中m1~m8是相应Ce2(C2O4)3·xH2O的净质量。![]() 和
和![]() 为两次空白实验中8 mL 9.186 mmol·L-1的Ce(NO3)3·6H2O溶液与Na2C2O4溶液反应所得Ce2(C2O4)3·xH2O的质量(0.026 0 g),根据应得到Ce2(C2O4)3的理论质量(0.020 0 g)与Ce2(C2O4)3·xH2O的质量差,可推得Ce2(C2O4)3·xH2O中结晶水数x为
为两次空白实验中8 mL 9.186 mmol·L-1的Ce(NO3)3·6H2O溶液与Na2C2O4溶液反应所得Ce2(C2O4)3·xH2O的质量(0.026 0 g),根据应得到Ce2(C2O4)3的理论质量(0.020 0 g)与Ce2(C2O4)3·xH2O的质量差,可推得Ce2(C2O4)3·xH2O中结晶水数x为![]() 和
和![]() 分别对应Sn(OH)4和Pd-Sn(OH)4吸附Ce3+后8 mL溶液中Ce3+转化为Ce2(C2O4)3·9H2O的质量。比较
分别对应Sn(OH)4和Pd-Sn(OH)4吸附Ce3+后8 mL溶液中Ce3+转化为Ce2(C2O4)3·9H2O的质量。比较![]() 和
和![]() 可知,Sn(OH)4吸附引起溶液中Ce3+减少程度比Pd-Sn(OH)4显著,因此Pd对Ce3+的吸附相对于Sn(OH)4表面OH-对Ce3+吸附相对较低。为进一步理论分析OH-对Ce3+的富集作用,根据0.723 7 g SnCl2·2H2O形成Sn(OH)4的理论量(0.598 6 g)和Sn(OH)4的大致质量比表面积[11](450 m2/g)推算Sn(OH)4表面积,再假定Ce3+富集液膜厚度为2 nm,则可计算Sn(OH)4表面液膜中Ce3+浓度约为7.687×10-2 mol/L,是体相溶液Ce3+浓度(9.186×10-3 mol/L)的8.4倍。按此估算方法,Pd-Sn(OH)4表面液膜中Ce3+浓度(1.397×10-2 mol/L)为体相溶液Ce3+浓度1.5倍。该理论分析表明,Sn(OH)4吸附Ce3+能力远大于Pd,因此Pd-Sn(OH)4富集Ce3+不在Pd表面进行,转化为CeO2几乎不会覆盖Pd。
可知,Sn(OH)4吸附引起溶液中Ce3+减少程度比Pd-Sn(OH)4显著,因此Pd对Ce3+的吸附相对于Sn(OH)4表面OH-对Ce3+吸附相对较低。为进一步理论分析OH-对Ce3+的富集作用,根据0.723 7 g SnCl2·2H2O形成Sn(OH)4的理论量(0.598 6 g)和Sn(OH)4的大致质量比表面积[11](450 m2/g)推算Sn(OH)4表面积,再假定Ce3+富集液膜厚度为2 nm,则可计算Sn(OH)4表面液膜中Ce3+浓度约为7.687×10-2 mol/L,是体相溶液Ce3+浓度(9.186×10-3 mol/L)的8.4倍。按此估算方法,Pd-Sn(OH)4表面液膜中Ce3+浓度(1.397×10-2 mol/L)为体相溶液Ce3+浓度1.5倍。该理论分析表明,Sn(OH)4吸附Ce3+能力远大于Pd,因此Pd-Sn(OH)4富集Ce3+不在Pd表面进行,转化为CeO2几乎不会覆盖Pd。
2.2 催化剂物理表征
Pd/CeO2(SnO2)/CNTs的SEM和元素面扫图如图3所示。由图3(a)可知,颗粒在CNTs表面分布均匀,内插图为Pd/CeO2(SnO2)/CNTs的EDS能谱图,表明Pd元素和Ce元素引入成功。图3(b)元素面扫图中,Pd、Sn、Ce等元素信号均有显示,其中Pd和Ce信号出现位置高度贴合,间接证明Pd/CeO2界面形成。
为进一步验证Pd/CeO2界面的存在,采集了Pd/SnO2/CNTs和Pd/CeO2(SnO2)/CNTs的X射线光电子能谱(XPS),如图4所示。图4(a)内插图为Ce 3 d区域的光谱图,证实了Ce元素引入成功。Pd/SnO2/CNTs和Pd/CeO2(SnO2)/CNTs的高分辨率Pd 3 d光谱如图4(b)所示,3对峰分别对应于Pd0、Pd2+和Pd4+物种。与Pd/SnO2/CNTs相比,Pd/CeO2(SnO2)/CNTs的所有峰结合能(BE)都较低,表明CeO2与Pd之间存在电子效应[7],进一步证实了Pd/CeO2界面形成。另外,比例最高的物种是Pd2+,这可能是由于Pd/SnO2/CNTs和Pd/CeO2(SnO2)/CNTs中Pd颗粒尺寸较小,高温处理时,小颗粒Pd在空气中被氧化所导致。价态分布随环境而变。在甲酸盐或乙醇电氧化时,Pd作为催化剂处于还原环境,发挥作用的是Pd0。
表1 对Sn(OH)4和Pd-Sn(OH)4吸附Ce3+的质量分析
Table 1 Mass analysis of Ce3+ adsorbed by Sn(OH)4and Pd-Sn(OH)4

Sn(OH)4Pd-Sn(OH)4吸附实验空白实验吸附实验空白实验m10.022 3 gm30.026 0 gm50.025 7 gm70.026 3 gm20.021 9 gm40.025 9 gm60.024 8 gm80.025 7 gm1+m20.022 1 gm3+m40.026 0 gm5+m60.025 3 gm7+m80.026 0 g
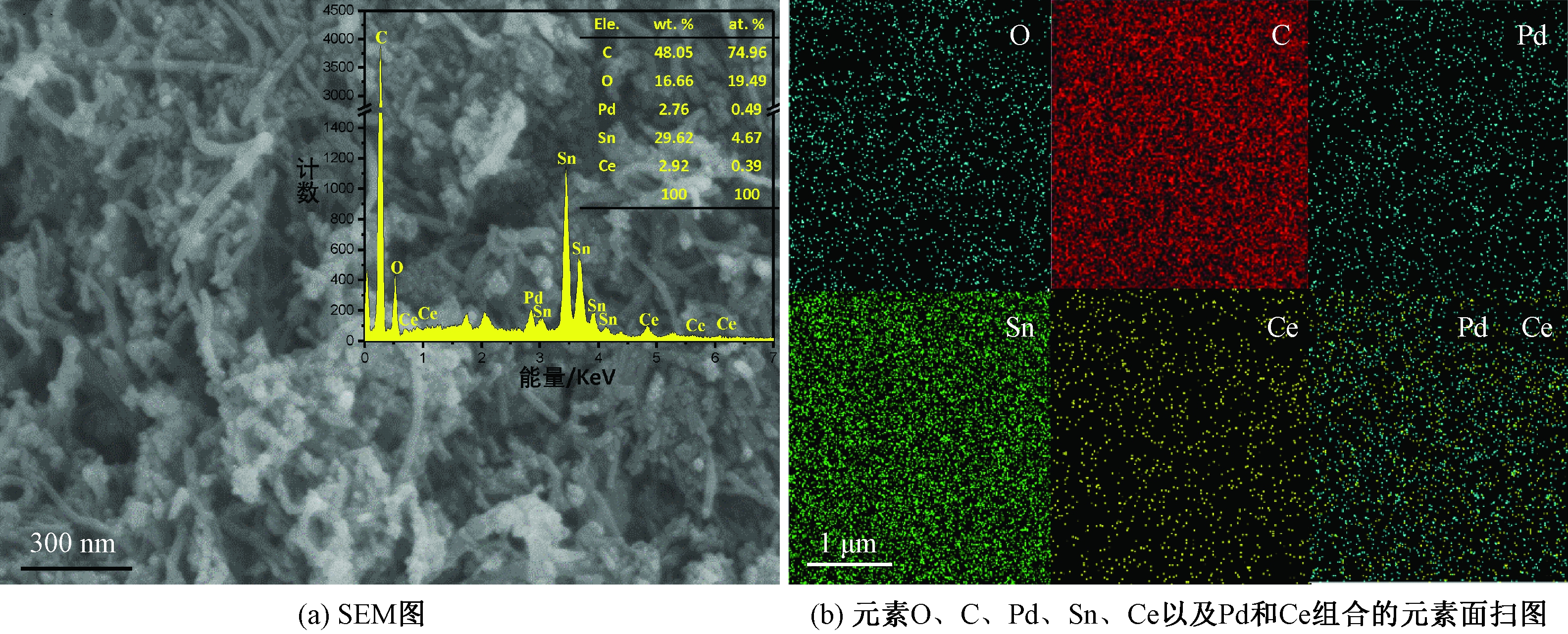
图3 Pd/CeO2(SnO2)/CNTs的SEM和元素面扫图
Figure 3 SEM graphand and elemental mapping results of Pd/CeO2(SnO2)/CNTs
2.3 催化剂对甲酸盐和乙醇电氧化催化性能
催化剂Pd/SnO2/CNTs和Pd/CeO2(SnO2)/CNTs在1 mol KOH 中CV图和CO溶出图如图5所示,实线和虚线分别表示第一圈和第二圈,扫描速度为50 mV/s。图5(a)中-0.8~-0.3 V对应H区,Pd/CeO2(SnO2)/CNTs比Pd/SnO2/CNTs区域面积大,这可能是CeO2参与了Pd对H吸附/解吸过程[12-14],间接证明CeO2成功引入。-0.26 V处对应于两催化剂中PdO的还原,两催化剂峰面积相似,表明电化学活性面积相近。以375 μC cmPd-2为转换系数[15],用PdO还原峰对应电量(C)计算两催化剂电化学活性面积知,Pd/SnO2/CNTs和Pd/CeO2(SnO2)/CNTs的电化学活性面积分别为157 cm2/mg和160 cm2/mg,表明引入CeO2未影响Pd电化学活性面积。
为比较Pd/SnO2和Pd/CeO2界面的电化学行为,对两种催化剂进行了CO溶出实验,如图5(b)所示。Pd/SnO2/CNTs曲线中-0.32 V和0 V处的两个CO氧化峰可归于Pd/SnO2界面和单独Pd对CO的吸附。引入CeO2后,-0.32 V处峰消失,CO氧化峰的总面积减小,而H吸附/脱附区面积增大,表明覆盖在SnO2表面的CeO2与Pd形成界面并替代原Pd/SnO2界面,并且Pd/CeO2界面较强Had吸附能力抑制了CO吸附。虽然Pd/SnO2/CNTs的CO氧化峰起始电位比Pd/CeO2(SnO2)/CNTs低,但由于Pd/CeO2界面阻止了CO的吸附,所以没有机会出现第1个氧化峰,故不能根据Pd/SnO2/CNTs较低起始电位判定其CO在其表面易脱附,仍需认定Pd/CeO2比Pd/SnO2界面抗CO中毒性好。

图4 Pd/SnO2/CNTs(黑线)和Pd/CeO2(SnO2)/CNTs XPS(红线)的XPS光谱图
Figure 4 XPS spectrum of Pd/SnO2/CNTs (in black) and Pd/CeO2(SnO2)/CNTs (in red)
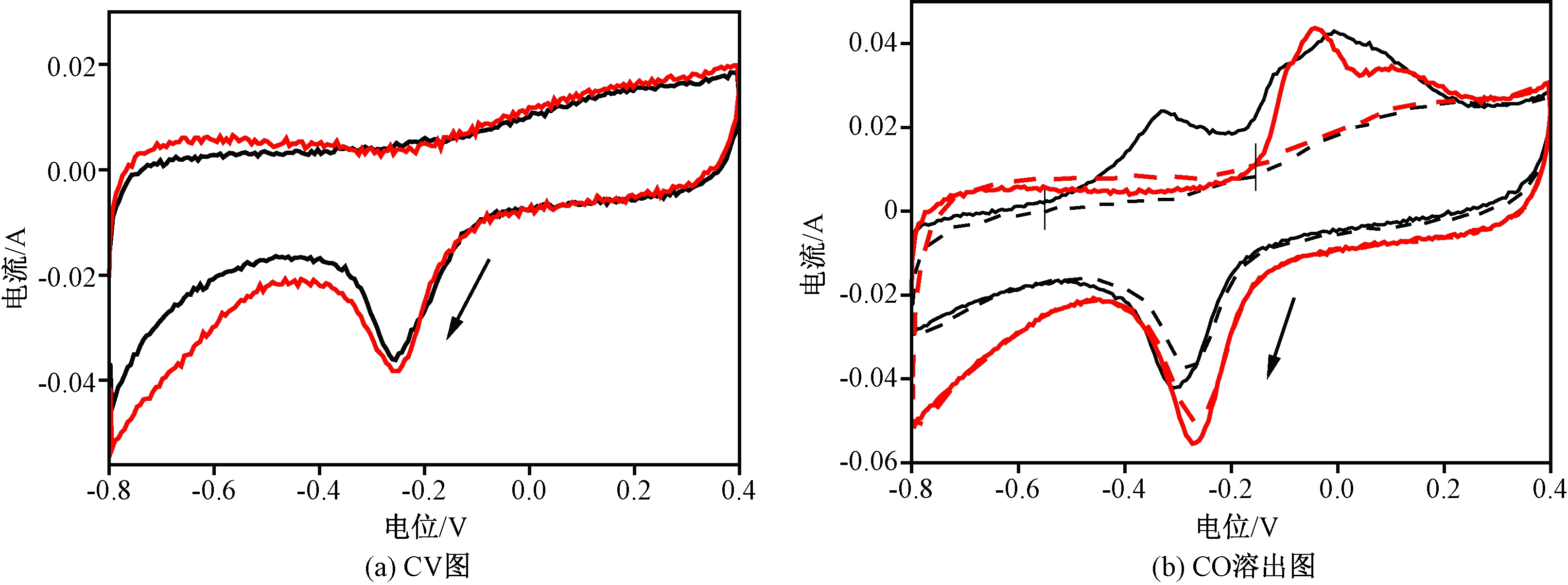
图5 催化剂Pd/SnO2/CNTs(黑线)和Pd/CeO2(SnO2)/CNTs(红线)CV图和CO溶出曲线
Figure 5 CVs and CO stripping diagrams of Pd/SnO2/CNTs (in black) and Pd/CeO2(SnO2)/CNTs (in red)
Pd/SnO2/CNTs和Pd/CeO2(SnO2)/CNTs的甲酸盐和乙醇电氧化CV图如图6所示。图6(a)中Pd/CeO2(SnO2)/CNTs(黑线)峰电流(文中所有电流均折算为每毫克Pd所对应的电流)在误差范围内可认为比Pd/SnO2/CNTs(红线)峰电流无显著优势。但在-0.55~-0.35 V处,Pd/CeO2(SnO2)/CNTs对应电流明显比Pd/SnO2/CNTs大。比如在-0.4 V处,Pd/CeO2(SnO2)/CNTs的甲酸盐氧化电流为0.27 A,比Pd/SnO2/CNTs对应电流(0.18 A)高1.5倍,表明Pd/CeO2(SnO2)/CNTs比Pd/SnO2/CNT对甲酸盐电氧化活性更高。结合图5(b),Pd/SnO2/CNTs在-0.55~-0.35 V存在CO吸附而Pd/CeO2(SnO2)/CNTs则无CO 吸附,表明Pd/CeO2(SnO2)/CNTs对甲酸盐的较高氧化活性可能源于Pd/CeO2对CO吸附的抑制作用。图6(b)比较了两催化剂对乙醇电氧化的活性,Pd/CeO2(SnO2)/CNTs对乙醇电氧化峰电流为0.36 A,比Pd/SnO2/CNTs(0.23 A)高1.6倍,表明Pd/CeO2界面由于其较强的抗CO中毒性能对乙醇电氧化的活性高于Pd/SnO2。
Pd/SnO2/CNTs和Pd/CeO2(SnO2)/CNTs的甲酸盐和乙醇电氧化电流-时间图如图7所示。图7(a)中,Pd/CeO2(SnO2)/CNTs的末端电流明显高于Pd/SnO2/CNTs,与图6(a)的结果一致,进一步证明Pd/CeO2优于Pd/SnO2。但图7(b)中Pd/CeO2(SnO2)/CNTs与Pd/SnO2/CNTs的末端电流均很低且差距不大,这可能是因乙醇在碱性条件下中间氧化产物缩聚使催化剂逐渐失活[16]。

图6 催化剂Pd/SnO2/CNTs(黑线)和Pd/CeO2(SnO2)/CNTs(红线)的甲酸盐和乙醇电氧化CV图
Figure 6 CV diagrams of formate and ethanol electrooxidation ofPd/SnO2/CNTs (in black) and
Pd/CeO2(SnO2)/CNTs (in red)
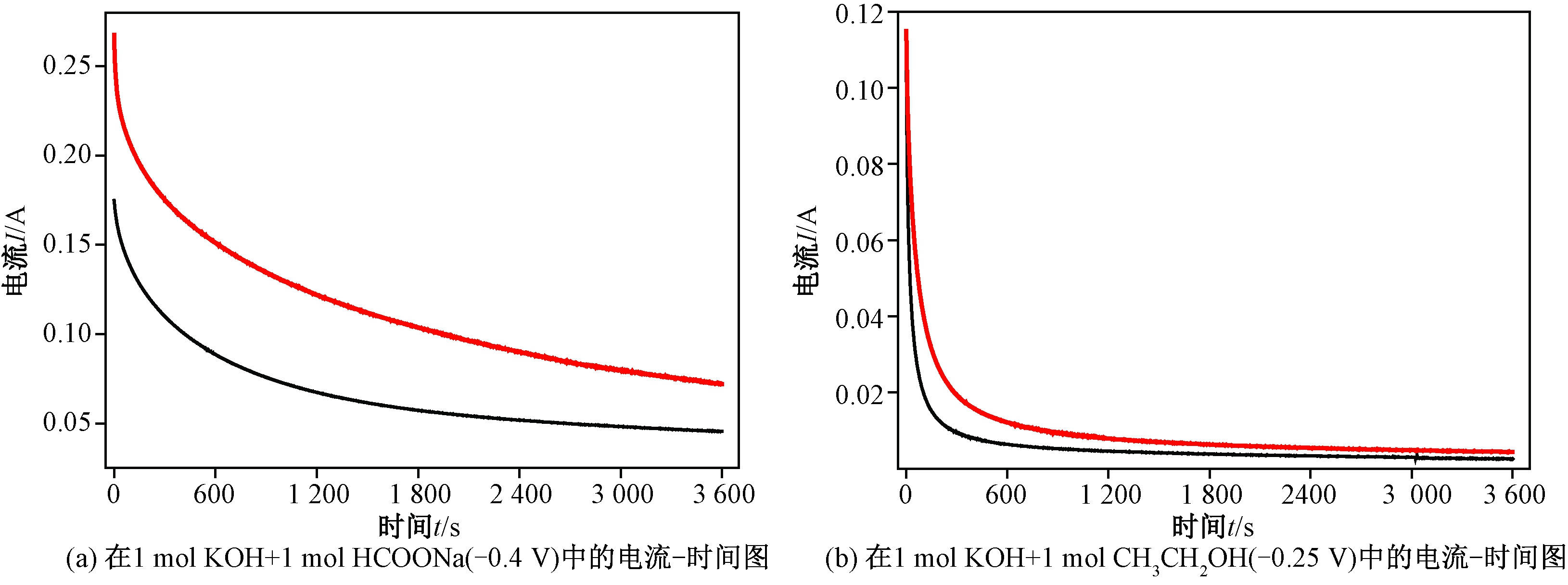
图7 催化剂Pd/SnO2/CNTs(黑线)和Pd/CeO2(SnO2)/CNTs(红线)的甲酸盐和乙醇电氧化电流-时间图
Figure 7 I-t diagrams of formate and ethanol electrooxidation ofPd/SnO2/CNTs (in black) and
Pd/CeO2(SnO2)/CNTs
3 结论
提出并验证了一种构建Pd/CeO2界面的湿化学法。EDS元素扫描及XPS结果都证明Pd/CeO2界面的形成。电化学结果表明,引入CeO2没有降低Pd的电化学活性,表明CeO2未覆盖Pd组分。进一步比较Pd/CeO2和Pd/SnO2对甲酸盐和乙醇电氧化活性表明,Pd/CeO2对甲酸盐和乙醇电氧化催化活性均优于Pd/SnO2,这可能是Pd/CeO2对CO吸附的抑制作用所致。该研究表明,通过本湿化学法可沉积导电性差的金属氧化物与Pd形成界面,扩大了电催化选用金属氧化物的范围。
[1] WANG C, FAN H, REN X, et al. Highly dispersed PtO nanodots as efficient co-catalyst for photocatalytic hydrogen evolution[J]. Applied surface science, 2018, 462:423-431.
[2] QU T, TAN Q, CHEN Y J, et al. Carbon layer-enhanced electronic interaction of Pd-SnO2 hybrid catalyst with high performance in DAFC[J]. Acs appl energy mater, 2019, 2(12): 8449-8458.
[3] ZHENG J N,HUANG K L,HOU G Y,et al.A highly active Pt nanocatalysts supported on RuO2 modified TiO2-NTs for methanol electrooxidation with excellent CO tolerance[J].International journal of hydrogen energy,2019,44(59):31506-31514.
[4] QIAO B T, WANG A Q, LI L, et al. Ferric oxide-supported Pt subnano clusters for preferential oxidation of CO in H2-rich gas at room temperature[J]. Acs catal, 2014, 4(7): 2113-2117.
[5] SUN X, QIANG Q, YIN Z G, et al. Monodispersed silver-palladium nanoparticles for ethanol oxidation reaction achieved by controllable electrochemical synthesis from ionic liquid microemulsions[J]. J colloid interface sci, 2019, 557: 450-457.
[6] NOBORIKAWA J, LAU J, TA J, et al. Palladium-copper electrocatalyst for promotion of oxidation of formate and ethanol in alkaline media[J]. Electrochim acta, 2014, 137: 654-660.
[7] TAN Q, SHU C Y, ABBOTT J, et al. Highly dispersed Pd-CeO2 nanoparticles supported on N-doped core-shell structured mesoporous carbon for methanol oxidation in alkaline media[J]. ACS catalysis, 2019, 9(7): 6362-6371.
[8] HUANG W J, MA X Y, WANG H. Promoting effect of Ni(OH)2 on palladium nanocrystals leads to greatly improved operation durability for electrocatalytic ethanol oxidation in alkaline solution[J]. Advanced materials, 2017, 29(37): 1703057.
[9] ELKHOLY A E, HEAKAL F E, EL-SAID W A. Improving the electrocatalytic performance of Pd nanoparticles supported on indium/tin oxide substrates towards glucose oxidation[J]. Applsed catalysis A, general, 2019, 580: 28-33.
[10] YARMIAYEV V,ALESKER M,MUZIKANSKY A,et al.Enhancement of palladium HOR activity in alkaline conditions through ceria surface doping[J].Journal of the electrochemical society,2019,166(7):3234-3239.
[11] REHAMAN M, REHMAN W, WASEEM M, et al. Adsorption mechanism of Pb2+ ions by Fe3O4, SnO2, and TiO2 nanoparticles[J]. ESPR, 2019, 26(19): 19968-19981.
[12] MILLER H A,LAVACCHI A,VIZZA F,et al.A Pd/C-CeO2 anode catalyst for high-performance platinum-free anion exchange membrane fuel cells[J].Angewandte chemie,2016,55(20):6004-6007.
[13] BAMBAGIONI V, BIANCHIN C, CHEN Y X, et al. Energy efficiency enhancement of ethanol electrooxidation on Pd-CeO2/C in passive and active polymer electrolyte-membrane fuel cells[J].Chemsuschem, 2012, 5(7): 1266-1273.
[14] YU H, DAVYDOVA E S, ASH U, et al. Palladium-ceria nanocatalyst for hydrogen oxidation in alkaline media: optimization of the Pd-CeO2 interface[J].Nano energy, 2019, 57: 820-826.
[15] HENNING S, HERRANZ J, GASTEIGER H A. Bulk-palladium and palladium-on-gold electrocatalysts for the oxidation of hydrogen in alkaline electrolyte[J]. Journal of the electrochemical society, 2015, 162(1): 178-189.
[16] BUS -ROGERO C, HERRERO E, FELIU J M. Ethanol oxidation on Pt single-crystal electrodes: surface-structure effects in alkaline medium[J]. Chemphyschem, 2014, 15(10): 2019-2028.
-ROGERO C, HERRERO E, FELIU J M. Ethanol oxidation on Pt single-crystal electrodes: surface-structure effects in alkaline medium[J]. Chemphyschem, 2014, 15(10): 2019-2028.