0 引言
罗丹明B广泛应用于纺织染色、涂料和食品加工行业[1],同时产生大量的含罗丹明B的废水。罗丹明B具有致畸、致癌和诱变性[2],会对水环境造成严重污染。目前,染料废水的处理方法包括吸附[3]、化学氧化[4]、生物降解[5]、萃取[6]和膜分离[7]等技术。吸附法去除率高、成本低、操作简单,是处理染料废水的重要方法。
近年来纳米材料作为吸附剂在废水处理中得到了广泛的关注。植物提取物含有的多酚和黄酮类化合物,可以作为还原剂用于绿色合成金属纳米粒子。目前,桉树叶[8]、鱼腥草[9]、葡萄叶[10]、爬山虎叶[11]等植物的提取物已成功应用于金属纳米材料的合成。本文以红薯叶提取物为原料绿色合成Fe/Cu纳米复合材料,并用于处理罗丹明B废水。
1 实验
1.1 试剂与仪器
红薯叶9月份采摘于河南郑州;罗丹明B(RhB)、一水柠檬酸、六水氯化铁、二水氯化铜、氢氧化钠、盐酸等均为分析纯。
AL-204型电子分析天平;TGL-16C型离心机;PHS-3C型精密酸度仪;ZWY-240型恒温振荡箱;CF080-S型干燥箱;TU18型紫外分光光度计。
1.2 Fe/Cu纳米复合材料的制备
将红薯叶用去离子水洗净,置于阳光下风干,然后粉碎、过孔径830 μm筛。随后称取45 g红薯叶于烧杯中加入750 mL去离子水,在90 ℃水浴锅中加热150 min。冷却后过滤、离心,取上清液储存备用。
将0.002 mol柠檬酸加入到已经装有160 mL红薯叶提取液的烧杯中,然后逐滴滴加80 mL FeCl3和CuCl2混合溶液(0.12 mol/L)[11-12],在室温下连续搅拌180 min。得到的混合液以4 200 r/min离心30 min,然后用去离子水洗涤沉淀3次,在333 K温度下烘干480 min,即得到0.51 g Fe/Cu纳米复合材料。利用比表面积分析仪对制备的Fe/Cu纳米复合材料进行表征,其比表面积为18.49 m2/g,平均孔径为14.44 nm。
1.3 实验方法
称取一定量的Fe/Cu纳米复合材料于含有20 mL一定浓度罗丹明B的锥形瓶中。用0.1 mol/L HCl或NaOH溶液调节罗丹明B溶液的初始pH。混合溶液在恒温振荡器中以130 r/min的速度振荡至吸附平衡,离心分离,然后用紫外-可见分光光度法在波长554 nm下测定上清液的吸光度,并由式(1)计算剩余溶液中罗丹明B的质量浓度。
(1)
式中:qe为单位质量Fe/Cu纳米复合材料吸附罗丹明B的平衡吸附量,mg/g;C0和Ce分别为罗丹明B溶液的初始质量浓度和平衡质量浓度,mg/L;V为罗丹明B溶液体积,L;m为吸附剂质量,g。
2 结果和讨论
2.1 吸附条件的优化
2.1.1 中心设计模型的建立
根据BBD实验设计规则,以罗丹明B的吸附量为响应值,考察了吸附时间(X1),吸附剂用量(X2)和pH(X3)对吸附过程的影响。实验的因素水平见表1。
表1 实验因素水平和范围
Table 1 Experimental parameters levels and range
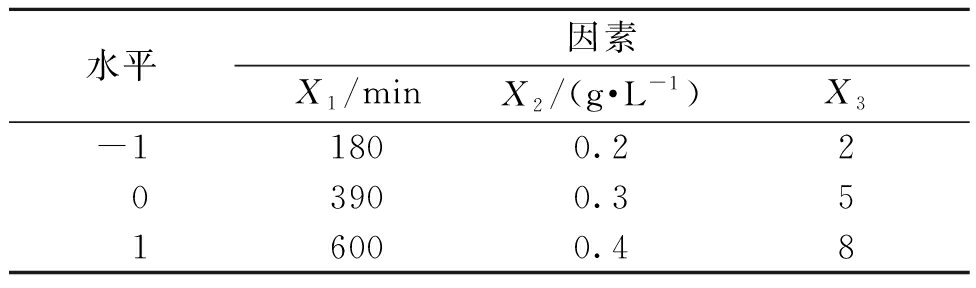
水平因素X1/minX2/(g·L-1)X3-11800.2203900.3516000.48
2.1.2 模型分析
响应面实验设计和结果如表2所示。通过二次多项式模型建立了响应值与试验因子之间的数学关系。得到罗丹明B吸附量qt与吸附时间、吸附剂用量和pH之间的二次多项式回归方程,如式(2)所示:
qt=284.88+11.71X1-59.44X2+5.18X3-
8.59X1X2+2.83X1X3+0.84X2X3-
(2)
方程的相关系数R2为0.999 6,表明多项式方程与实验值拟合度较高。由回归方程(2)计算得
到的最佳吸附条件:吸附时间为507 min,吸附剂用量为0.2 g/L,pH=5.61。预测得到吸附罗丹明B的吸附量为364.48 mg/g。在该条件下进行5次平行吸附实验,最终得到罗丹明B的平均吸附量是358.86 mg/g,与预测值相近,表明该模型可以用于优化Fe/Cu纳米复合材料对罗丹明B的吸附。
表2 实验设计和结果
Table 2 Experimental design and response values
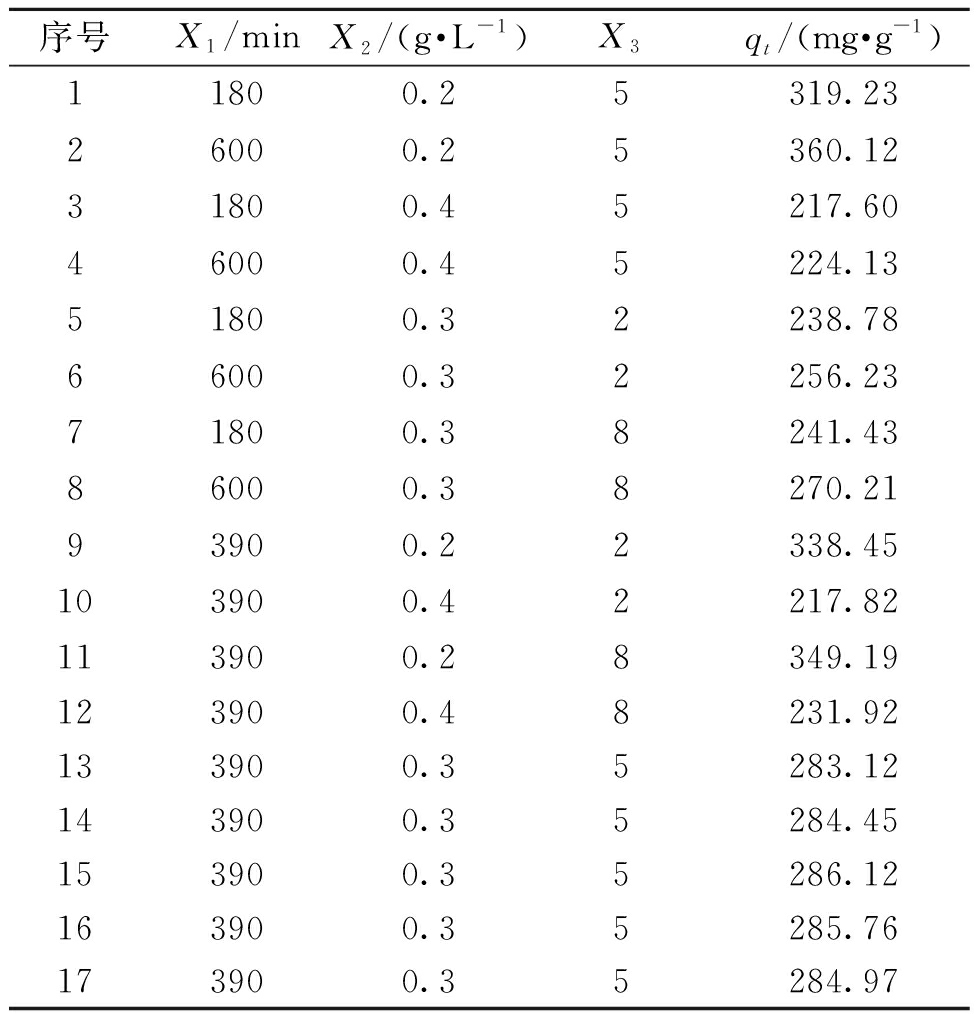
序号X1/minX2/(g·L-1)X3qt/(mg·g-1)11800.25319.2326000.25360.1231800.45217.6046000.45224.1351800.32238.7866000.32256.2371800.38241.4386000.38270.2193900.22338.45103900.42217.82113900.28349.19123900.48231.92133900.35283.12143900.35284.45153900.35286.12163900.35285.76173900.35284.97
方差分析结果见表3。由表3可知,模型的F值是1 806.79,P值小于0.05,表明模型的拟合结果比较显著。从F值判断可以得到3个因素对Fe/Cu纳米复合颗粒吸附罗丹明B的影响由大到小的顺序为:吸附剂用量>吸附时间>pH。从交互作用方面来看,吸附时间和吸附剂用量的交互作用最明显。
2.1.3 3D图形分析
各变量交互作用下的3D图如图1所示。由图可知,随着吸附剂用量的增加,单位质量吸附剂对罗丹明B的吸附能力降低;Fe/Cu纳米复合颗粒对罗丹明B的吸附量随着吸附时间的增加而逐渐增加直至达到吸附平衡;另外随着pH的增加,吸附量先增加后降低。
表3 Fe/Cu纳米复合材料吸附RhB的方差分析
Table 3 Analysis of variance for adsorption of RhB onto Fe/Cu nanocomposites
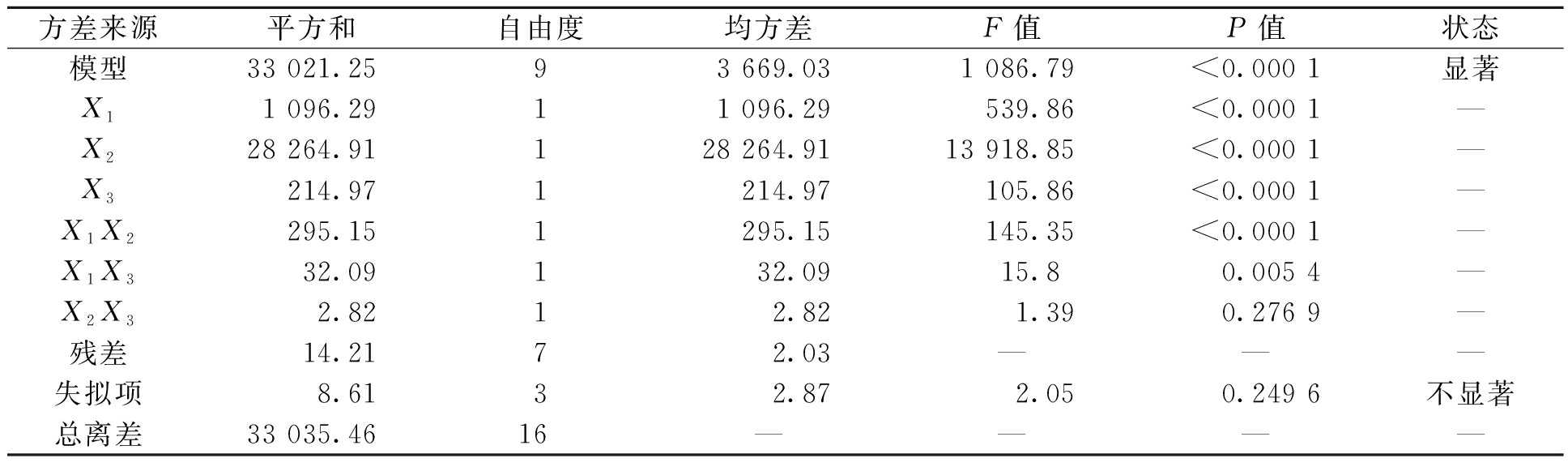
方差来源平方和自由度均方差F值P值状态模型33 021.2593 669.031 086.79<0.000 1显著X11 096.2911 096.29539.86<0.000 1—X228 264.91128 264.9113 918.85<0.000 1—X3214.971214.97105.86<0.000 1—X1X2295.151295.15145.35<0.000 1—X1X332.09132.0915.80.005 4—X2X32.8212.821.390.276 9—残差14.2172.03———失拟项8.6132.872.050.249 6不显著总离差33 035.4616————
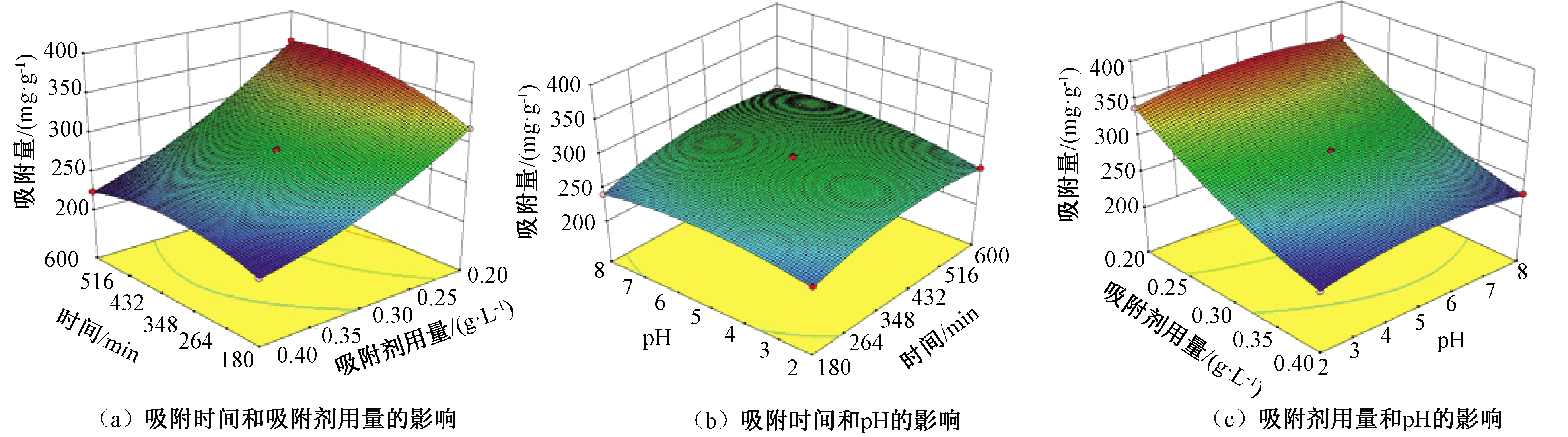
图1 罗丹明B吸附能力的三维响应图
Figure 1 Three-dimensional response surface plots of RhB absorption capacity
2.2 吸附等温线
为了进一步研究Fe/Cu纳米复合颗粒对罗丹明B的吸附特征,分别采用Langmuir(式(3))、Redlich-Peterson(式(4))和Sips(式(5))等温模型对实验数据进行拟合分析。实验数据与模型数据之间的差异用χ2(式(6))检验。
(3)
(4)
(5)
(6)
式中:qe和Ce分别为平衡吸附量和平衡质量浓度,mg/g,mg/L;qms和qm分别为Sips模型的饱和吸附量和Langmuir模型的最大单层吸附量,mg/g;Ks和m是Sips常数;KL是Langmuir常数,L/mg;AR、 BR和g是R-P等温线的常数;qe,exp和qe,cal分别为实际吸附量和理论吸附量,mg/g。
选择吸附平衡时间510 min,吸附剂用量0.2 g/L,溶液初始pH为4.48,考察不同温度下罗丹明B的初始浓度对吸附效果的影响。按照式(3)~(5)对实验数据进行非线性拟合分析,结果见图2和表4。
由表4可知,Sips模型的R2>0.99,χ2<0.69,并且模型参数qms和Ks均随着温度的升高而增大,表明Sips模型可以很好地描述罗丹明B的吸附过程。温度298 K时,Fe/Cu纳米复合材料对罗丹明B的最大吸附量是484.18 mg/g。Redlich-Peterson模型的R2>0.99,且相关参数随温度增加而增大,但χ2较大,所以Redlich-Peterson模型不能很好地描述罗丹明B在Fe/Cu纳米颗粒上的吸附行为。由于Langmuir模型的相关系数R2较低,χ2较大,表明该模型不适用于描述该吸附过程。
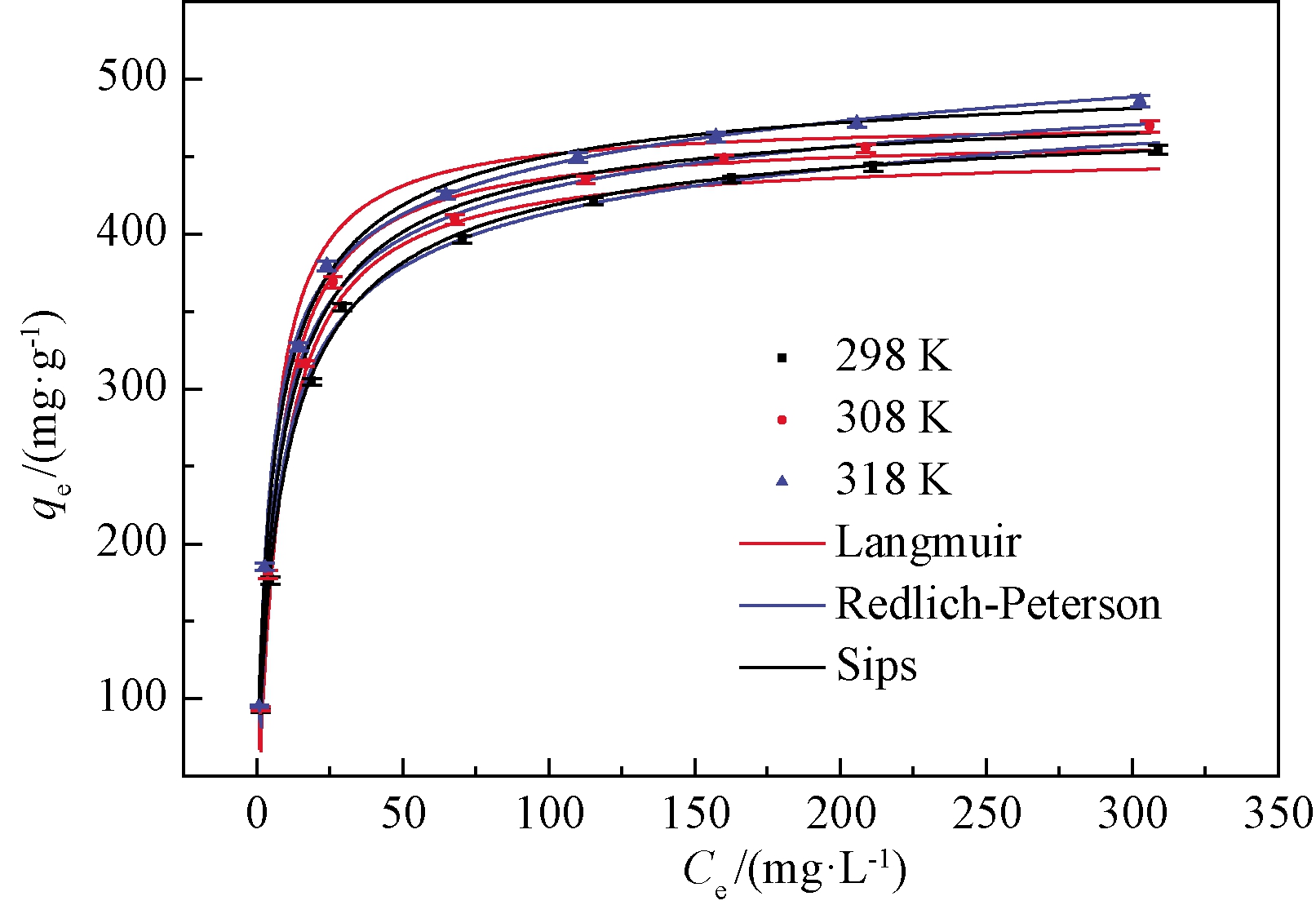
图2 等温方程的非线性拟合曲线
Figure 2 Non-linear fitted curve with isotherms model
表4 吸附等温线参数
Table 4 Parameters of adsorption isotherm
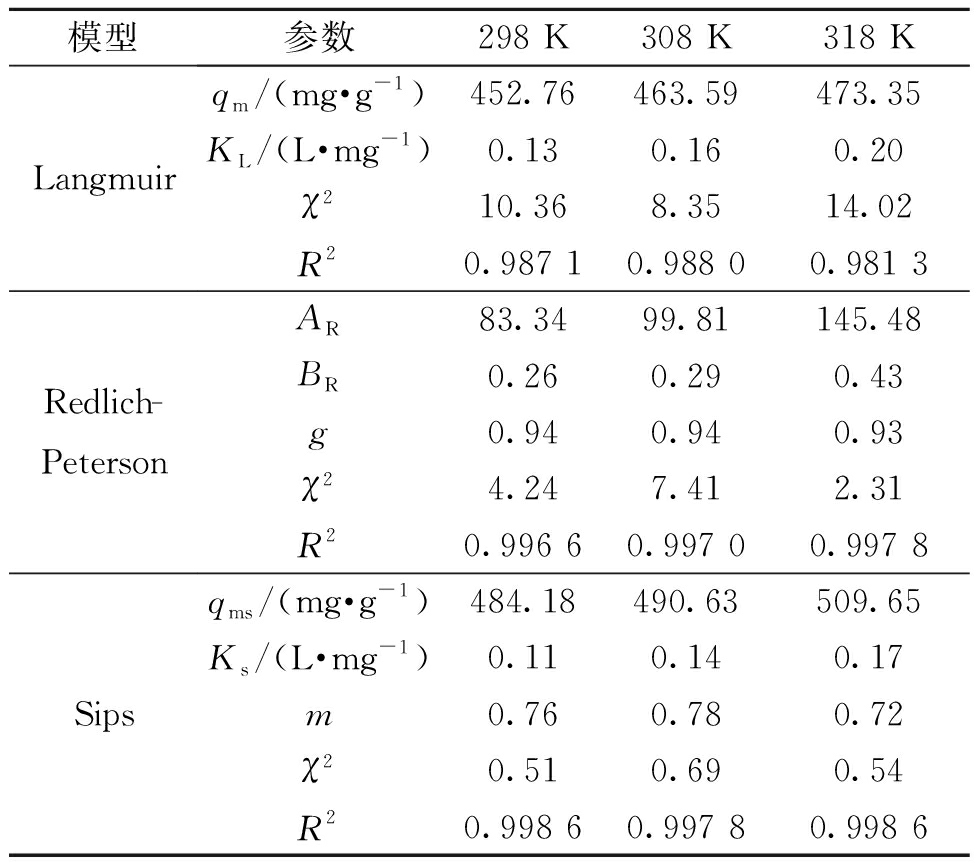
模型参数298 K308 K318 KLangmuirRedlich-PetersonSipsqm/(mg·g-1)452.76463.59473.35KL/(L·mg-1)0.130.160.20χ210.368.3514.02R20.987 10.988 00.981 3AR83.3499.81145.48BR0.260.290.43g0.940.940.93χ24.247.412.31R20.996 60.997 00.997 8qms/(mg·g-1)484.18490.63509.65Ks/(L·mg-1)0.110.140.17m0.760.780.72χ20.510.690.54R20.998 60.997 80.998 6
各种吸附剂对罗丹明B吸附能力比较见表5。可以看出,与其他材料相比,Fe/Cu纳米复合材料对罗丹明B具有较高的吸附能力。
表5 不同吸附剂对RhB吸附能力比较
Table 5 Comparison of adsorption capacities of RhB on various adsorbents

吸附剂吸附量/(mg·g-1)来源糠醛渣37.93文献[13]核桃壳57.83文献[1]活性炭182.48文献[14]Fe/Cu纳米复合材料484.18本文研究
2.3 热力学参数计算
在298、308、318 K温度下,热力学参数吉布斯自由能变(ΔG)、熵变(ΔS)和焓变(ΔH)分别用式(7)、(8)、(9)计算[15]:
(7)
ΔG=-RTln Kc;
(8)
(9)
式中:Ce和Cad分别为吸附平衡时溶液中和被吸附的罗丹明B质量浓度,mg/g;R为通用气体常数,8.314 J/(mol·K);T为温度,K。
在温度298、308、318 K下,计算得到ΔG分别是-9.68、-10.57和-12.06 kJ/mol,说明Fe/Cu纳米复合材料对罗丹明B的吸附行为是自发进行的,升温有利于吸附。焓变(25.88 kJ/mol)和熵变(0.12 kJ/(mol·K))均为正值,表明该吸附过程是吸热的熵增过程。
2.4 吸附动力学
分别在298、308、318 K温度下,选择罗丹明B的初始质量浓度100 mg/L,吸附剂用量0.2 g/L,初始pH为4.48,考察吸附时间对吸附过程的影响。利用式(10)~(12)对吸附动力学数据进行拟合:
qt=qe(1-e-k1t);
(10)
(11)
(12)
式中:k1和k2分别为准一级模型和准二级模型的速率常数,min-1,g/(mg·min);qe和qt分别为平衡时刻和时刻t罗丹明B的吸附能力,mg/g;kti为颗粒内扩散速率常数,mg/(g·min1/2);C为与边界层有关的常数,mg/g。
拟合结果见图3和表6。由图3(a)可知,Fe/Cu纳米复合材料对罗丹明B的吸附能力随着时间的延长而增加,然后趋于平衡。准二级动力学模型的相关系数R2>0.996,吸附速率常数随温度的增加而增加,高温有利于吸附进行,并且qcal值与qexp值比较接近,说明准二级动力学模型可以很好地描述该吸附过程。准一级动力学模型R2<0.97,不适合描述该吸附过程。
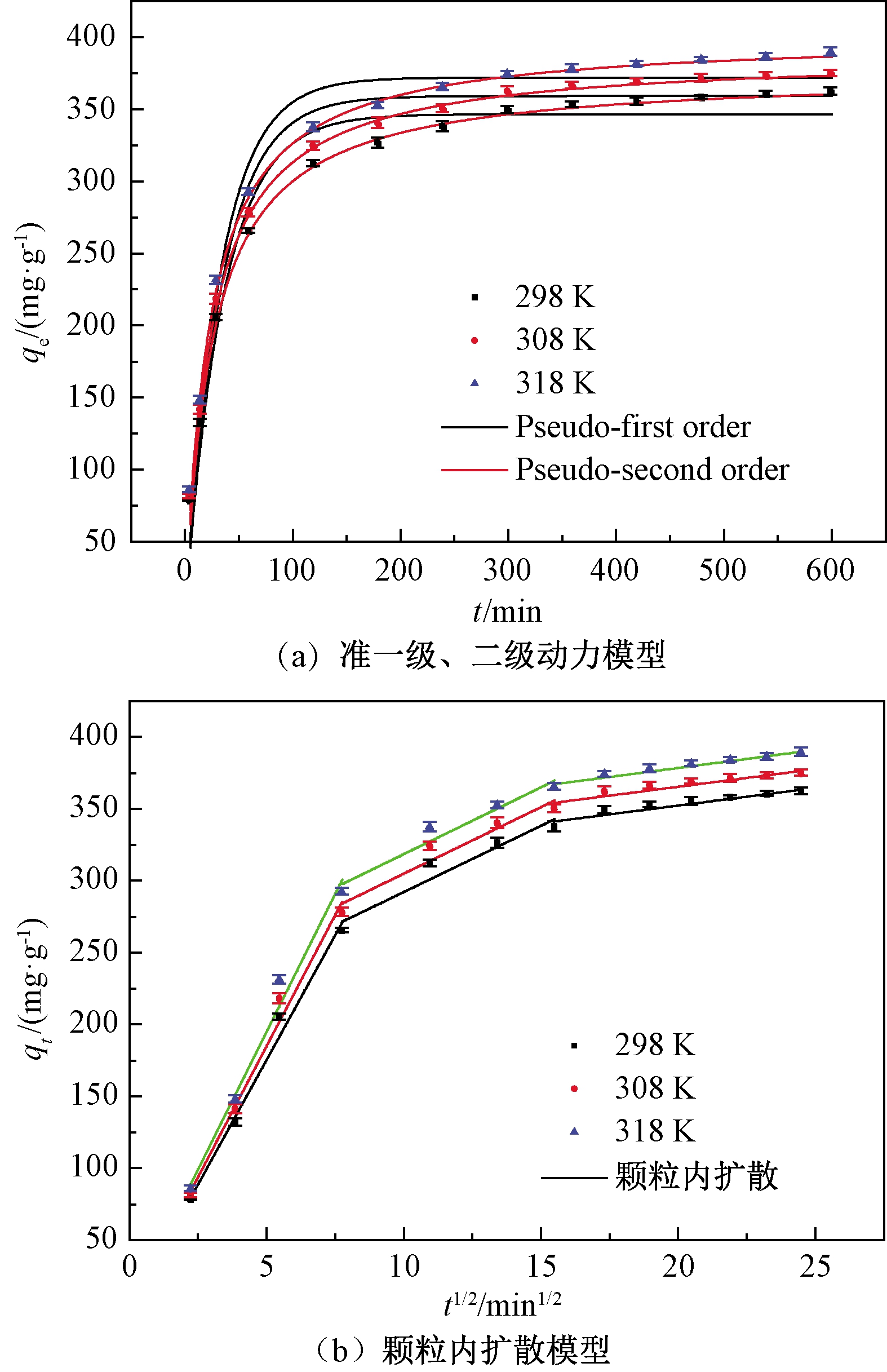
图3 准一级、准二级动力学模型和颗粒内扩散模型对罗丹明B吸附实验数据的回归曲线
Figure 3 Regression curves of experimental data for RhB adsorption with pseudo first-order, pseudo second-
order and intra-particle diffusion kinetic models
表6 吸附动力学参数
Table 6 Parameters of adsorption kinetic model
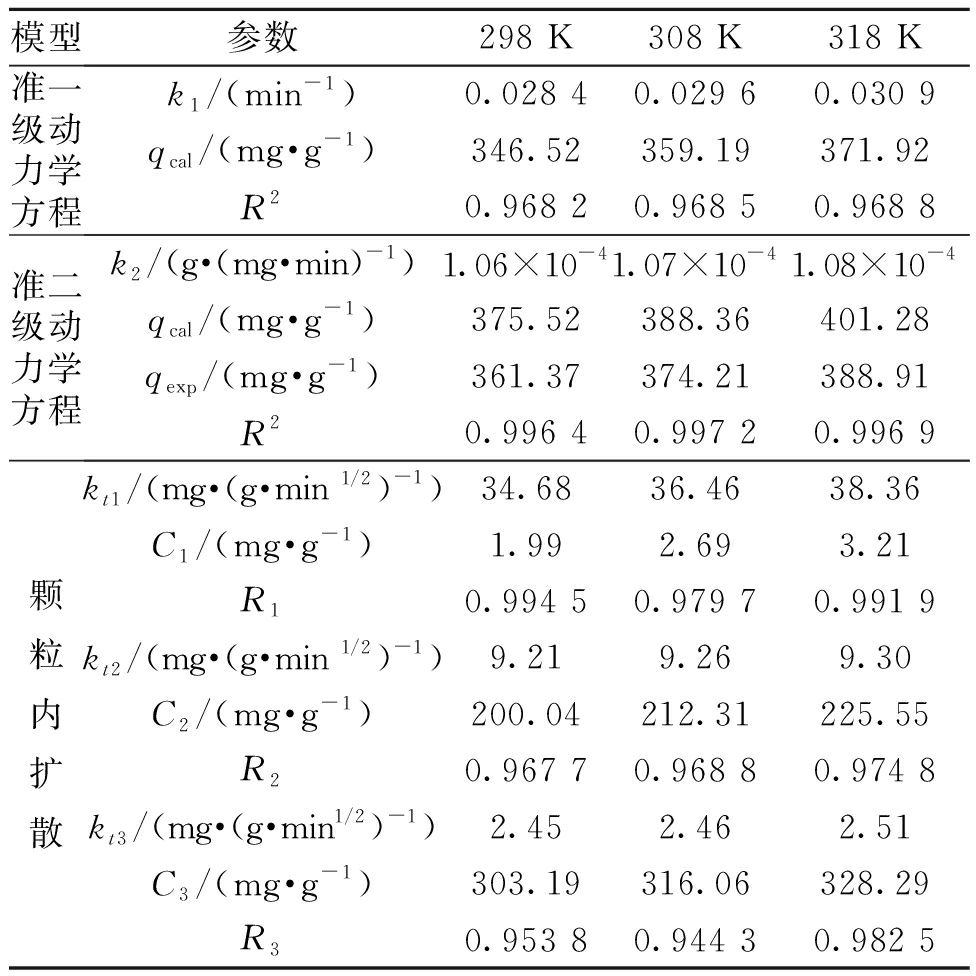
模型参数298 K308 K318 K准一级动力学方程k1/(min-1)0.028 40.029 60.030 9qcal/(mg·g-1)346.52359.19371.92R20.968 20.968 50.968 8准二级动力学方程k2/(g·(mg·min)-1)1.06×10-41.07×10-41.08×10-4qcal/(mg·g-1)375.52388.36401.28qexp/(mg·g-1)361.37374.21388.91R20.996 40.997 20.996 9颗粒内扩散kt1/(mg·(g·min 1/2)-1)34.6836.4638.36C1/(mg·g-1)1.992.693.21R10.994 50.979 70.991 9kt2/(mg·(g·min 1/2)-1)9.219.269.30C2/(mg·g-1)200.04212.31225.55R20.967 70.968 80.974 8kt3/(mg·(g·min 1/2)-1)2.452.462.51C3/(mg·g-1)303.19316.06328.29R30.953 80.944 30.982 5
从图3(b)可以看出,吸附过程可分为以下3个阶段:第一阶段,罗丹明B分子被转移到吸附剂的外表面,吸附速率较高;第二阶段吸附速率较慢,是颗粒内扩散过程;第三阶段为吸附平衡过程。第一阶段的kt1明显高于其他两个阶段,且C1<C2<C3。另外,这3条线均没有通过原点,说明在罗丹明B的吸附过程中,颗粒内扩散并不是唯一的速度控制步骤,边界层扩散可能也会对吸附行为产生影响。
2.5 SEM分析
Fe/Cu纳米复合材料的SEM图见图4。从图4可以看出,Fe/Cu纳米复合材料呈颗粒状,平均粒径为150~500 nm。Fe/Cu纳米复合材料具有一定的团聚现象,这可能是由于红薯叶提取物是多种天然化合物的混合物,在制备过程中多酚和黄酮对材料的聚集有影响[8]。

图4 Fe/Cu纳米复合材料的SEM图
Figure 4 The SEM image of Fe/Cu nanocomposites
2.6 吸附机理
RhB分子上的羧基和Fe/Cu纳米复合材料表面所含羟基或羰基形成的氢键是吸附的主要作用力。RhB也通过表面络合吸附在Fe/Cu纳米复合材料上。此外,Fe/Cu纳米复合材料表面的π电子和RhB所含苯环的π电子之间形成的π—π相互作用以及静电作用也对吸附有一定的影响。
3 结论
以红薯叶提取物为原料,采用绿色方法合成了一种新型Fe/Cu纳米复合材料。利用响应面分析法优化出吸附罗丹明B的最佳条件为吸附时间507 min、吸附剂用量0.2 g/L、pH=5.61。结果表明:Sips模型可以很好地描述Fe/Cu纳米复合材料对罗丹明B的吸附,并且该吸附行为是自发进行的,升高温度有利于Fe/Cu纳米复合材料对罗丹明B的吸附。动力学数据符合准二级动力学模型,颗粒内扩散和边界层扩散联合控制着吸附过程。本研究促进了可再生资源在新型吸附剂合成中的应用,为净化染料废水提供了一种简便易行的方法。
[1] 方芳,张璐璐,张明婷,等. 核桃壳吸附法去除水中罗丹明B的响应曲面优化及机理[J]. 净水技术, 2019, 38(2): 77-85.
[2] 刘琦,陈嘉磊,张启灵,等. 稻壳灰吸附剂对罗丹明B的吸附性能研究[J]. 化学研究与应用, 2019, 31(8): 1482-1491.
[3] 韩润平,房丽燕,李小钰,等. 聚乙烯亚胺负载四氧化三铁对刚果红的吸附性能[J]. 郑州大学学报(工学版), 2019, 40(2): 59-65.
[4] MICHAEL-KORDATOU I, KARAOLIA P, FATTA-KASSINOS D. The role of operating parameters and oxidative damage mechanisms of advanced chemical oxidation processes in the combat against antibiotic-resistant bacteria and resistance genes present in urban wastewater[J]. Water research, 2018, 129:208-230.
[5] BHUNIA S K, JANA N R. Reduced graphene oxide-silver nanoparticle composite as visible light photocatalyst for degradation of colorless endocrine disruptors[J]. ACS applied materials & interfaces, 2014, 6(22): 20085-20092.
![]() ZEC N, et al. Improved single-step extraction performance of aqueous biphasic systems using novel symmetric ionic liquids for the decolorisation of toxic dye effluents[J]. Journal of industrial and engineering chemistry, 2019, 76: 500-507.
ZEC N, et al. Improved single-step extraction performance of aqueous biphasic systems using novel symmetric ionic liquids for the decolorisation of toxic dye effluents[J]. Journal of industrial and engineering chemistry, 2019, 76: 500-507.
[7] AHMAD R, GUO J, KIM J. Structural characteristics of hazardous organic dyes and relationship between membrane fouling and organic removal efficiency in fluidized ceramic membrane reactor[J]. Journal of cleaner production, 2019, 232: 608-616.
[8] WANG T, JIN X Y, CHEN Z L, et al. Green synthesis of Fe nanoparticles using eucalyptus leaf extracts for treatment of eutrophic wastewater[J]. Science of the total environment, 2014, 466-467: 210-213.
[9] WEI Y F, FANG Z Q, ZHENG L C, et al. Biosynthesized iron nanoparticles in aqueous extracts of eichhornia crassipes and its mechanism in the hexavalent chromium removal[J]. Applied surface science, 2017, 399: 322-329.
[10] LUO F, YANG D, CHEN Z L, et al. The mechanism for degrading orange II based on adsorption and reduction by ion-based nanoparticles synthesized by grape leaf extract[J]. Journal of hazardous materials, 2015, 296: 37-45.
[11] ZHANG P, HOU D Y, O′CONNOR D, et al. Green and size-specific ssynthesis of stable Fe-Cu oxides as earth-abundant adsorbents for malachite green removal[J]. ACS sustainable chemistry & engineering, 2018, 6:9229-9236.
[12] SEBEIA N, JABLI M, GHITH A. Biological synthesis of copper nanoparticles, using nerium oleander leaves extract: characterization and study of their interaction with organic dyes[J]. Inorganic chemistry communications, 2019, 105: 36-46.
[13] CHEN X Y, LI H P, LIU W Y, et al. Effective removal of methyl orange and rhodamine B from aqueous solution using furfural industrial processing waste: furfural residue as an eco-friendly biosorbent[J]. Colloids and surfaces A: physicochemical and engineering aspects, 2019, 583:123976.
[14] LIU X D, TIAN J F, LI Y Y, et al. Enhanced dyes adsorption from wastewater via Fe3O4 nanoparticles functionalized activated carbon[J]. Journal of hazardous materials, 2019,373: 397-407.
[15] LIU Y. Is the free energy change of adsorption correctly calculated?[J]. Journal of chemical & engineering data, 2009, 54(7): 1981-1985.