0 引言
盐酸丁卡因是一种局部麻醉药,广泛用于硬膜外阻滞、蛛网膜下腔阻滞、神经传导阻滞和黏膜表面麻醉[1]。
盐酸丁卡因的多晶型在欧洲药典(9.0版)和Giron等发表的文献中均有描述[2-3],晶型A(熔点421.15 K)或晶型B(熔点407.15~412.15 K)室温可以长期保存。进一步研究发现,盐酸丁卡因原料药市售品多为晶型A和晶型B的混晶。按照中国药典2015版“药品晶型研究及晶型质量控制指导原则”的要求,对盐酸丁卡因进行多晶型的定量分析发现,溶液中晶型A与晶型B的体积比为4∶1时,达到动态平衡。盐酸丁卡因的溶解度的测定未见公开报道。本文报道盐酸丁卡因晶型制备及在常压下,在273.15~323.15 K温度内,采用平衡法测定的商业形式的盐酸丁卡因在甲醇、乙醇、等纯溶剂和甲醇-乙酸乙酯混合溶剂中的溶解度测定结果。本研究为盐酸丁卡因工业结晶和精制工艺提供了重要依据。
1 实验
1.1 实验材料和仪器
盐酸丁卡因购自北京燕京药业有限公司;乙醇、甲醇、三氯甲烷、异丙醇和乙酸乙酯均购自天津科密欧化学试剂有限公司,均为分析纯;BT-125D型分析天平;SYC型超级恒温水槽;DT-Q600型同步热分析仪;D8 ADVANCE型X射线粉末衍射仪;JEOL JSM-7500F型扫描电子显微镜。
1.2 晶型A和晶型B的制备
(1) 晶型A的制备:室温下,将商品化盐酸丁卡因溶于水中,8 ℃冷却12 h,过滤、真空干燥后得到白色针状的晶型A产物,高效液相色谱法测得质量分数≥99.9%。
(2) 晶型B的制备:将商品化盐酸丁卡因溶于水,用质量分数为10%的NaOH溶液调pH值为8~9,静置3~4 h后过滤得到丁卡因。丁卡因用乙醇溶解,然后通入干燥的HCl气体成盐,得到晶型B产物,高效液相色谱法测得质量分数≥99.9%。
1.3 热重-差示扫描量热分析(TG-DSC)
氮气环境,流速100 mL/min,取样5~10 mg放入氧化铝坩埚中,加热速率为5 K/min,测定两种晶型的DSC图,测量结果如图1所示。晶型A的熔点峰值对应为422.9 K,晶型B的熔点峰值对应为411.79 K,与文献[3-4]一致。
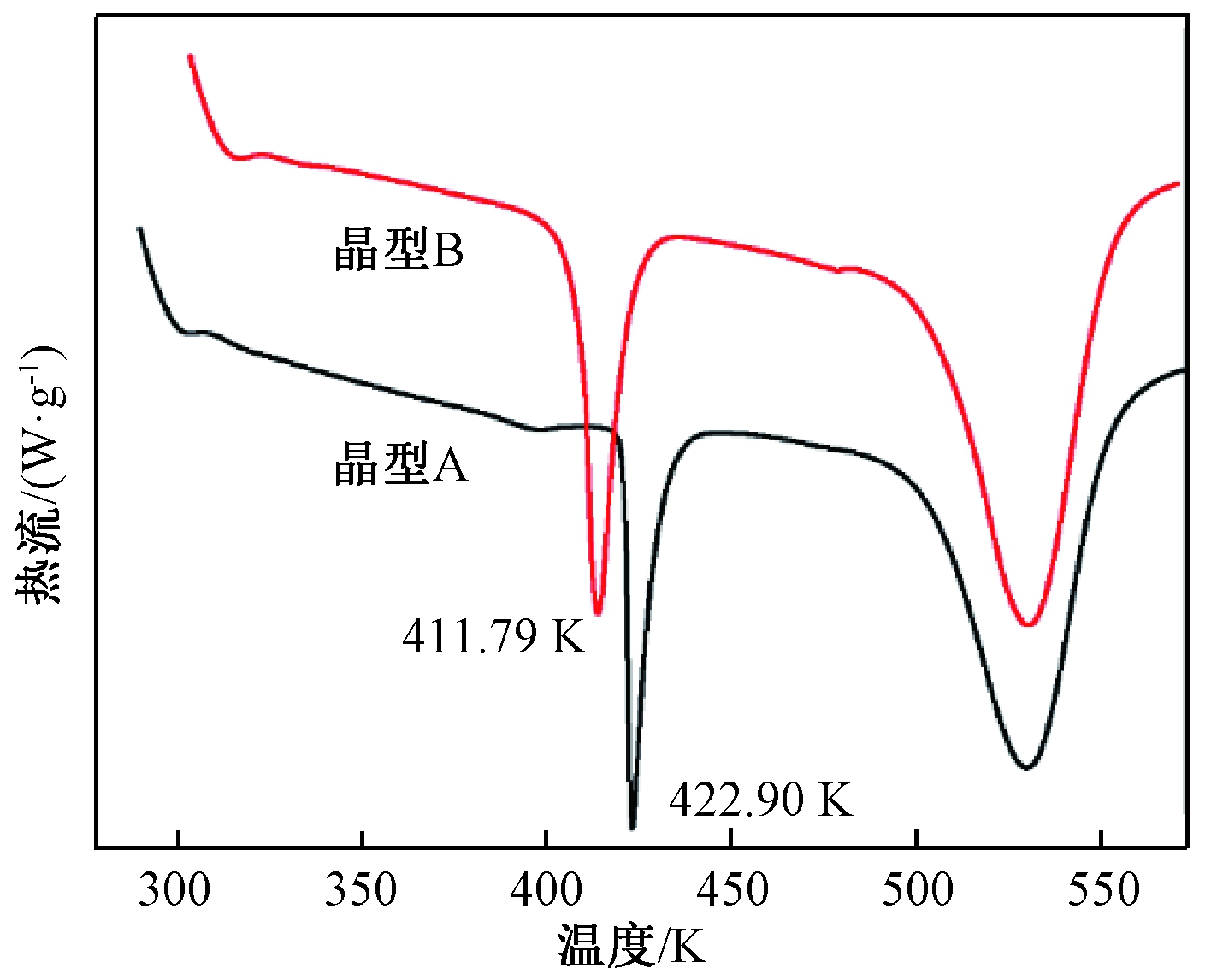
图1 晶型A和晶型B的DSC图
Figure 1 DSC curve of form A and form B
1.4 X射线粉末衍射(XRD)
Cu钯,发射波长0.15 418 nm的Cu-Kα射线,在管电压40 kV,管电流40 mA的条件下扫描,扫描衍射角为5°~60°,扫描步长为0.02°,扫描速率为0.1 s/步。扫描衍射角在5°~40°内差异较明显,XRD图谱如图2所示。
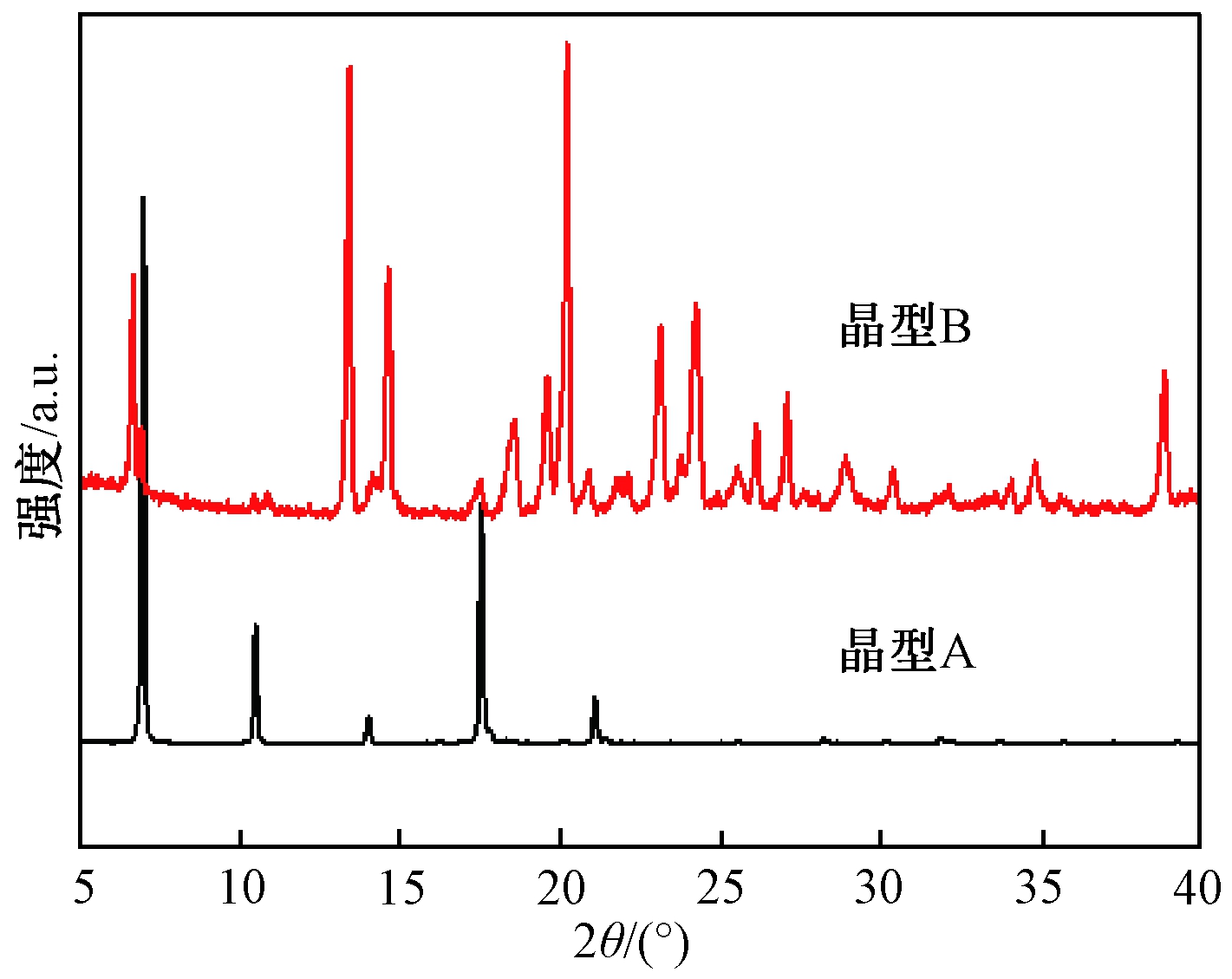
图2 晶型A和晶型B的XRD图
Figure 2 XRD curve of form A and form B
从图2可以看出,晶型A在2θ=6.9°±0.1°,15.7°±0.1°处有特征峰,晶型B在2θ=13.4°±0.1°,19.5°±0.1°处有特征峰。与文献[2]一致。
1.5 晶型A和晶型B的溶剂介导转晶现象
在研究晶型A和晶型B在甲醇、乙醇、异丙醇、乙酸乙酯、三氯甲烷溶剂中的溶解度时,通过DSC检测盐酸丁卡因晶型A和晶型B达到固液平衡后剩余的固体,定量分析发现其晶型A与晶型B质量比为4∶1时达到动态平衡。说明晶型A和晶型B在所测有机溶剂中易发生溶剂介导转晶型现象,转化为两种晶型的混合物。这也说明了商业化的盐酸丁卡因是稳定的,因此只对商业化的丁卡因溶解度的数据进行分析。
1.6 溶解度测量方法
采用平衡法[5]测定了盐酸丁卡因的溶解度。将过量的盐酸丁卡因加入到含有溶剂的双层玻璃反应釜中,用精度为0.1 K的温度计监测釜中溶液的温度。将混合物在恒定温度下通过磁力搅拌12 h或更长时间,达到固-液平衡后,停止搅拌并将溶液在相同温度下静置12 h,沉淀盐酸丁卡因颗粒。吸出适量的上清液,并通过注射器(0.45 μm)过滤,将滤液倒入预热的玻璃皿中。测量总质量。将称重后的容器置于温度为323.15 K真空烘箱中,然后蒸发溶液并定期记录托盘的质量,直至恒重。所有设备在转移过程中都必须经过预热和迅速操作,以防止产生误差。所有实验数据在相同条件下重复3次,取平均值。采用DSC对原料及平衡后的盐酸丁卡因进行晶型分析。
采用式(1)[6]计算盐酸丁卡因在纯溶剂中的溶解度,采用式(2)[7]计算盐酸丁卡因在甲醇-乙酸乙酯混合溶剂中的溶解度,甲醇在混合溶剂中的摩尔分数为x,用式(3)计算。
(1)
(2)
(3)
式中:m1、m2、m3 、m分别为盐酸丁卡因、甲醇、乙酸乙酯、纯溶剂的质量;M1、M2、M3、M分别为盐酸丁卡因、 甲醇、乙酸乙酯、纯溶剂的相对分子质量。
1.7 热力学方程
采用Apelblat方程拟合盐酸丁卡因在纯溶剂中的溶解度,其方程为:
(4)
式中:A、B、C为该方程的经验参数。A和B主要揭示了溶液非理想性对样品溶解度的影响;C主要体现温度与样品的熔融焓之间的关系。
Zhang等[8]提出CNIBS/R-K方程。该模型用于模拟盐酸丁卡因在甲醇-乙酸乙酯中的溶解度数据。方程的简化形式为:
(5)
式中:B1、B2、B3、B4、B5为该等式的经验参数。
上述两个模型用相对偏差RD和平均相对偏差ARD来检验结果的一致性,
(6)
(7)
式中:xcl为指溶解度的理论值;xi为溶解度的测量值。
2 结果与讨论
2.1 盐酸丁卡因在纯溶剂中的溶解度
图3显示了商品盐酸丁卡因在纯溶剂中的xi值。通过DSC检测盐酸丁卡因达到固液平衡后剩余的固体,其DSC数据与测定前没有变化,可以认为盐酸丁卡因在溶解过程中没有发生晶型转变。从图3可以看出,在纯溶剂中盐酸丁卡因的溶解度随温度的升高而增加,且在相同温度下纯溶剂中的溶解度顺序为:甲醇>乙醇>异丙醇>乙酸乙酯。当温度低于304 K时,在三氯甲烷中的溶解度大于在乙醇中的,而温度大于304 K时情况相反。盐酸丁卡因具有极性基团—NH—,其导致盐酸丁卡因在醇类中的溶解度更高,该现象可以用“相似相溶”的原理来解释。
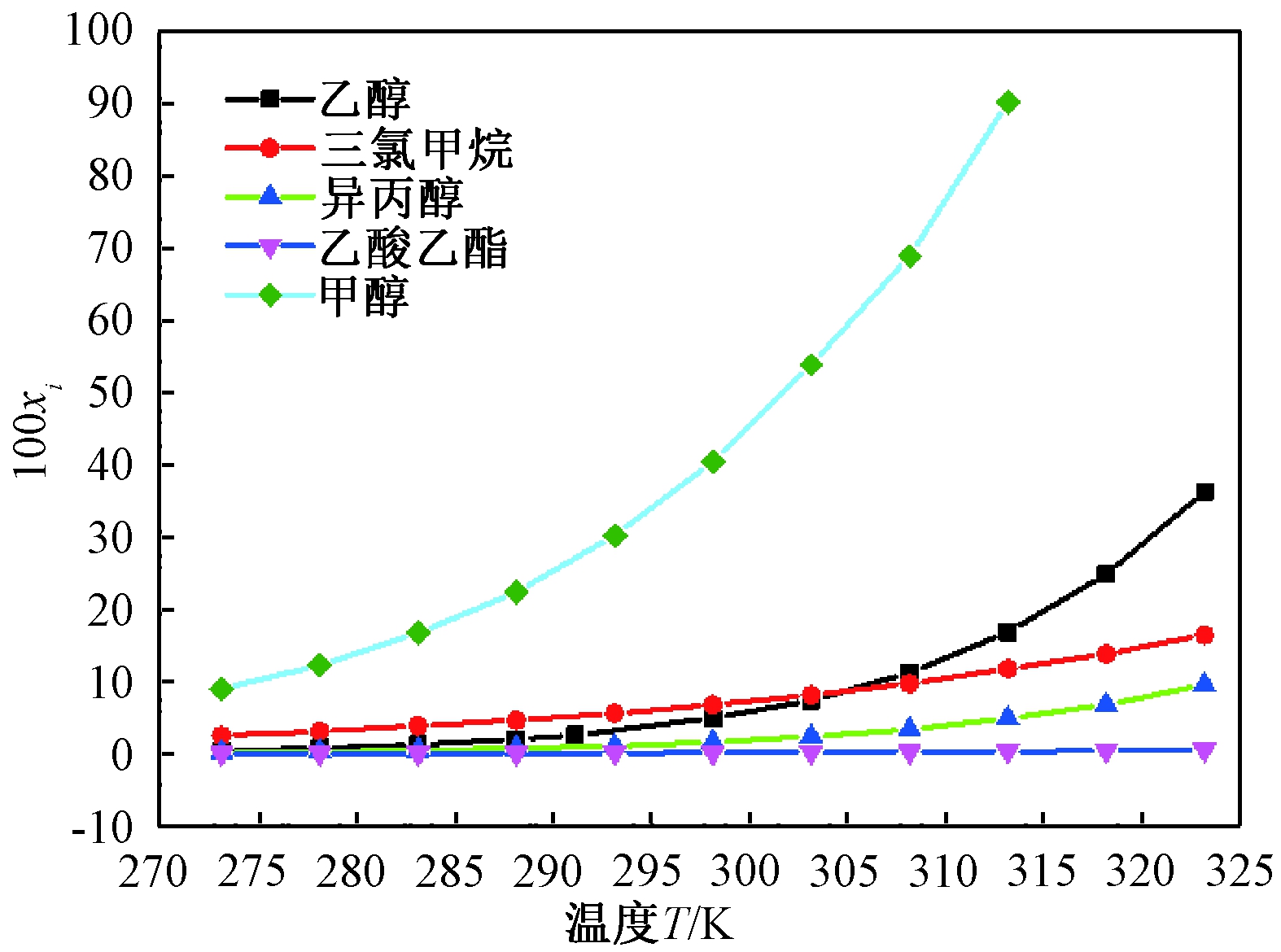
图3 盐酸丁卡因在纯溶剂中的溶解度
Figure 3 Solubility of tetracaine hydrochloride in
pure solvents
用Origin8软件对溶解度数据关于修正的Apelbat方程拟合,结果表明有很好的相关性,并且R2≥0.99,AD≤5%,ARD≤5%。表1列出了通过拟合获得的无量纲参数A、B、C的值。结果证明,修正的Apelblat方程适用于盐酸丁卡因所研究的温度和溶剂范围内的溶解度。
表1 盐酸丁卡因通过Apelblat方程拟合获得的无量纲参数
Table 1 Parameters of modified Apelblat equation for
tetracaine hydrochloride solubility fitting in pure solvents
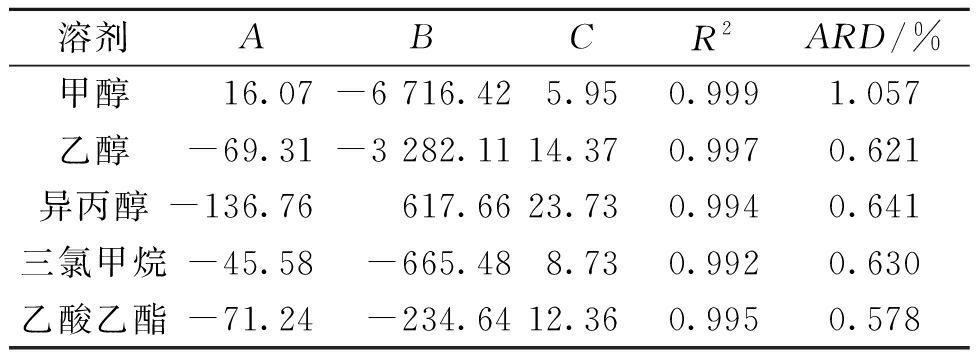
溶剂ABCR2ARD/%甲醇16.07-6 716.425.950.9991.057乙醇-69.31-3 282.1114.370.9970.621异丙醇-136.76617.6623.730.9940.641三氯甲烷-45.58-665.488.730.9920.630乙酸乙酯-71.24-234.6412.360.9950.578
2.2 盐酸丁卡因在甲醇-乙酸乙酯混合溶剂中的溶解度
盐酸丁卡因在甲醇-乙酸乙酯混合溶剂中的溶解度拟合值如图4所示。根据盐酸丁卡因在纯溶剂中的溶解度数据,选择甲醇作为易溶溶剂,乙酸乙酯作为不易溶溶剂,研究盐酸丁卡因在混合溶剂中的溶解行为。从图4可以看出,盐酸丁卡因出现潜溶现象,当甲醇的摩尔分数为0.849 2时溶解度达到最大值。这个规律可以用溶剂化效应解释。Apelblat和CNIBS/R-K方程的实验结果由Origin8.0软件拟合,可以看出,存在良好的相关性。测定系数R2≥0.99,ARD≤0.03%,拟合得到的参数列于表2和表3。
表2 盐酸丁卡因在混合溶剂中关于Apelblat方程拟合
得到的无量纲参数
Table 2 Parameters of modified Apelblat equation for
tetracaine hydrochloride solubility fitting in mixed solvents
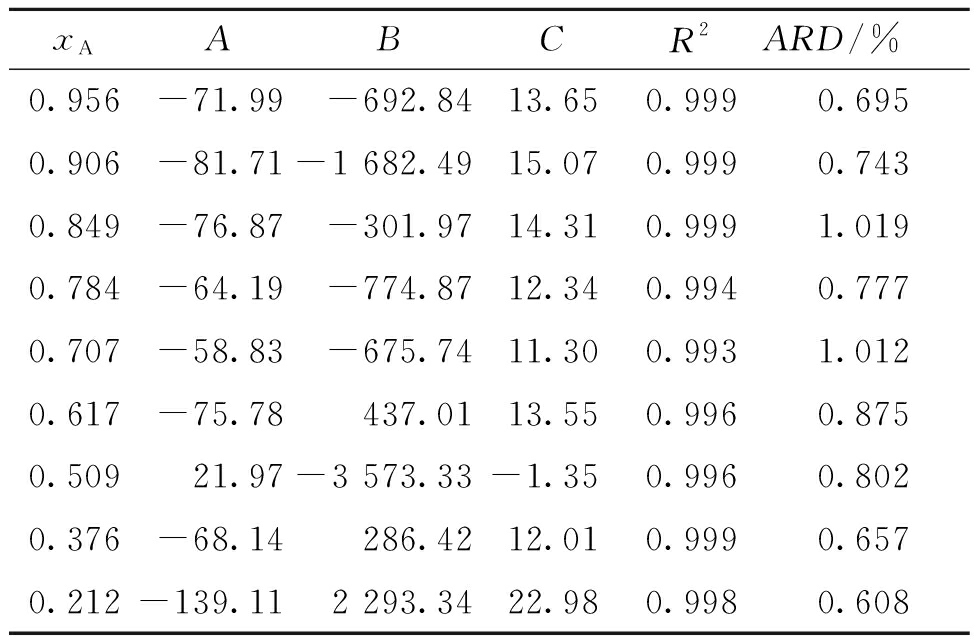
xAABCR2ARD/%0.956-71.99-692.8413.650.9990.6950.906-81.71-1 682.4915.070.9990.7430.849-76.87-301.9714.310.9991.0190.784-64.19-774.8712.340.9940.7770.707-58.83-675.7411.300.9931.0120.617-75.78437.0113.550.9960.8750.50921.97-3 573.33-1.350.9960.8020.376-68.14286.4212.010.9990.6570.212-139.112 293.3422.980.9980.608
2.3 溶液的热力学性质
对于理想溶液,溶解过程的热力学参数的计算采用van′t Hoff 方程来计算:
(8)
式中:R为气体摩尔常数,8.314 J/(mol·K);xi为溶质的溶解度;ΔHf为熔化焓;ΔSf为融化熵。
事实上,几乎所有的溶液都是非理想的,溶质与溶剂之间存在一定的作用。因此,对于真实物系,用溶解焓ΔHd代表熔化焓ΔHf,用溶解熵ΔSd代表溶解熵ΔSf,则:
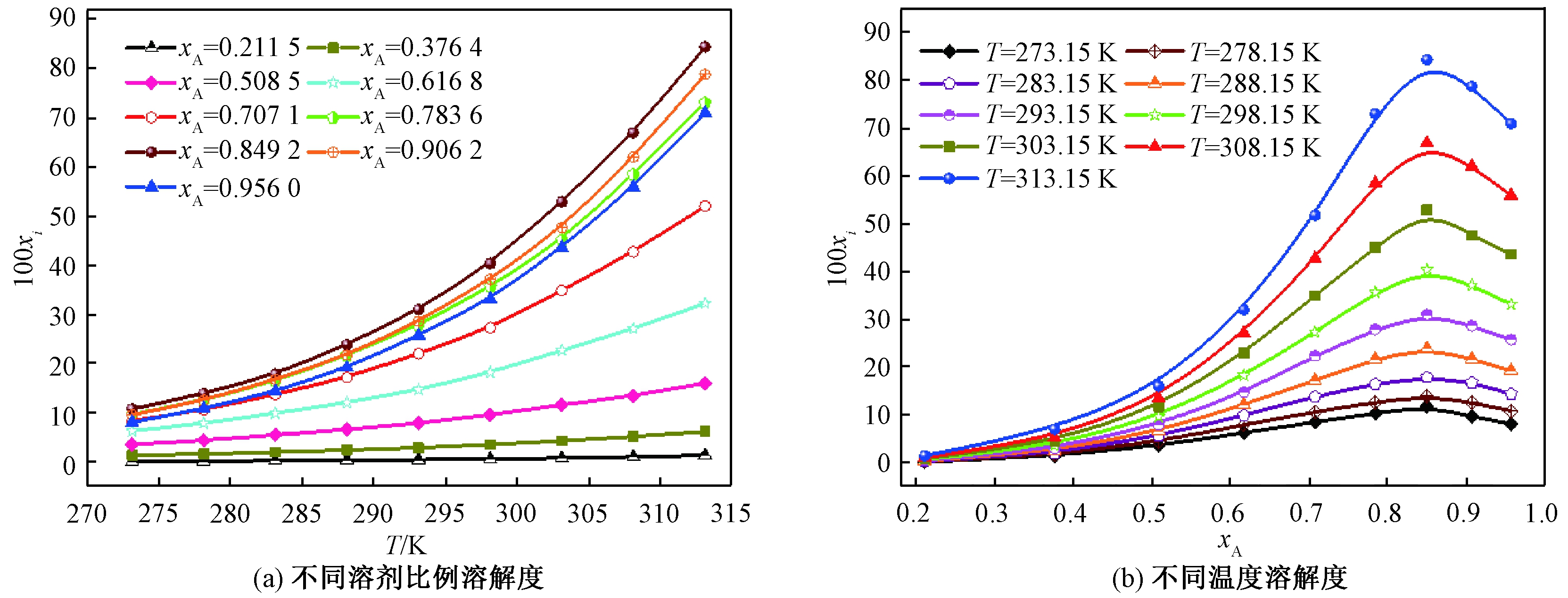
图4 盐酸丁卡因在混合溶剂中的溶解度
Figure 4 The solubility of tetracaine hydrochloride in mixed solvents
表3 盐酸丁卡因在混合溶剂中关于CNIBS/R-K方程拟合得到的无量纲参数
Table 3 Parameters of CNIBS/R-K equation for tetracaine hydrochloride solubility fitting in mixed solvents
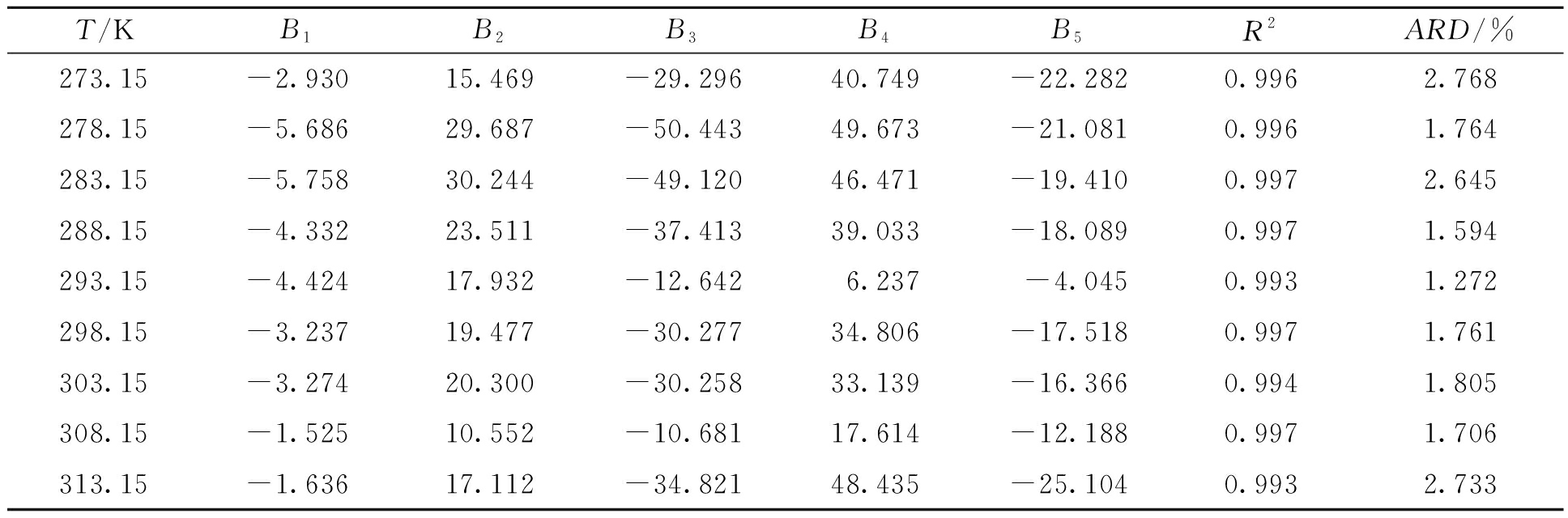
T/KB1B2B3B4B5R2ARD/%273.15-2.93015.469-29.29640.749-22.2820.9962.768278.15-5.68629.687-50.44349.673-21.0810.9961.764283.15-5.75830.244-49.12046.471-19.4100.9972.645288.15-4.33223.511-37.41339.033-18.0890.9971.594293.15-4.42417.932-12.6426.237-4.0450.9931.272298.15-3.23719.477-30.27734.806-17.5180.9971.761303.15-3.27420.300-30.25833.139-16.3660.9941.805308.15-1.52510.552-10.68117.614-12.1880.9971.706313.15-1.63617.112-34.82148.435-25.1040.9932.733
(9)
以ln xi为纵坐标,以1/T为横坐标作图,根据直线的斜率和截距计算ΔSd和ΔHf。
溶液的Gibbs自由能为:
ΔGd=ΔHd-TmeanΔSd;
(10)
(11)
式中:Tmean为平均热力学温度。
为了比较溶质在溶解过程中溶解焓和溶解熵对吉布斯自由能的贡献大小,采用式(12)、(13)进行计算:
![]()
(12)
(13)
盐酸丁卡因的溶解焓和溶解熵如表4所示,从表中数据可以看出盐酸丁卡因的ΔHd、ΔGd、ΔSd都为正值,这表明其溶解过程为非自发的吸热过程,为熵驱动过程。ζH都是大于50%的,这表明盐酸丁卡因在溶解过程中ΔHd、ΔSd、ΔGd的贡献较大。
表4 盐酸丁卡因在单溶剂中溶解过程中的热力学参数
Table 4 Thermodynamic parameters for dissolution of tetracaine hydrochloride in pure solvents
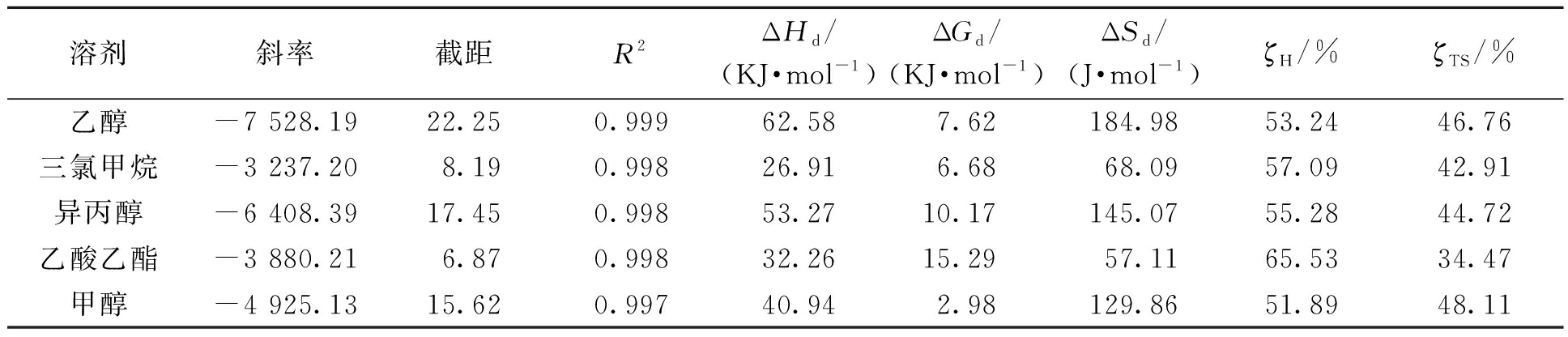
溶剂斜率截距R2ΔHd/(KJ·mol-1)ΔGd/(KJ·mol-1)ΔSd/(J·mol-1)ζH/%ζTS/%乙醇-7 528.1922.250.99962.587.62184.9853.2446.76三氯甲烷-3 237.208.190.99826.916.6868.0957.0942.91异丙醇-6 408.3917.450.99853.2710.17145.0755.2844.72乙酸乙酯-3 880.216.870.99832.2615.2957.1165.5334.47甲醇-4 925.1315.620.99740.942.98129.8651.8948.11
3 结论
(1)在明确了盐酸丁卡因多晶型转化规律的基础上,测定了商业化盐酸丁卡因的溶解度数据。在甲醇-乙酸乙酯混合溶液中,盐酸丁因存在潜溶现象,当甲醇摩尔分数为0.849 2时,溶解度达到最大值。
(2)Apelblat方程能较好地描述盐酸丁卡因在纯溶剂中的溶解度。CNIBS/R-K方程能准确地关联混合溶剂中甲醇的摩尔分数与盐酸丁卡因摩尔溶解度的关系。
(3)热力学分析显示,盐酸丁卡因在所测纯溶剂中的溶解过程为熵驱动非自发吸热过程。
[1] RODGERS H, CRAVEN R. Local anaesthesia for ocular surgery[J]. Anaesthesia & intensive care medicine, 2017, 18 (1): 41-43.
[2] GIRON D, DRAGHI M, GOLDBRONN C, et al. Study of the polymorphic behaviour of some local anesthetic drugs[J]. Journal of thermal analysis, 1997, 49(2): 913-927.
[3] 何浩明,韩进.盐酸丁卡因的同质异晶现象[J].中国药学杂志,1993,28(1):33-34,61.
[4] 刘艳萍, 魏航航, 李倩. 聚乳酸立构复合晶体的表面形貌及其力学性能[J]. 郑州大学学报(工学版), 2018, 39(6): 83-87.
[5] 于玉振, 张晓慧, 李鹏坤, 等. 普瑞巴林晶型I在纯溶剂及丙酮-水混合溶剂中的溶解度测定与关联[J]. 高校化学工程学报, 2017, 31 (1): 7-12.
[6] SHAKEEL F, HAQ N, ALANAZI F K, et al. Solubility and thermodynamic function of apremilast in different (transcutol+water) cosolvent mixtures: measurement, correlation and molecular interactions[J]. Journal of industrial and engineering chemistry, 2017, 56: 99-107.
[7] LIU L, LI H Z, CHEN D, et al. Solubility of 1, 1-diamino-2, 2-dinitroethylene in different pure solvents and binary mixtures (dimethyl sulfoxide+water) and (N, N-dimethyl formamide+water) at different temperatures [J]. Fluid phase equilibria, 2018, 460: 95-104.
[8] ZHANG P S, ZHANG C, ZHAO R, et al. Measurement and correlation of the solubility of florfenicol form A in several pure and binary solvents[J]. Journal of chemical & engineering data, 2018, 63 (6): 2046-2055.