0 引言
氢(H2)呼气试验已被世界各国专家广泛应用于诊断碳水化合物吸收不良、小肠细菌过度生长(small intestinal bacterial overgrowth, SIBO)等病症,因其具有简便、迅速及无创等优点,现已作为一种非侵入性胃肠功能的常规检查方法[1-4].小肠中存在的产甲烷菌会利用氢和二氧化碳生产甲烷,若在氢呼气试验中同时进行对甲烷含量的测定,对排除假阴性结果及提高相关疾病的确诊率将更有意义[5-7].现阶段甲烷和氢的呼气检测一般采用气相色谱技术、电化学技术、固态传感器技术等检测手段.气相色谱仪是一种用于精确分离复杂样品中化合物的化学分析仪器,但是由于设备复杂昂贵,所需检查时间较长,因而难以实现多样本、大数据的检测需求[8].而电化学技术使用的氢气传感器是一种化学燃料电池,利用呼出气体中的氢与传感器中的化学物质发生反应,把产生的能量转化成电流.但是由于在检测气体时要消耗传感器内的化学物质,随着检测次数的增加,其结果的稳定性和敏感性将逐渐降低[9].上述技术都难以满足甲烷和氢呼气检测的实际需求.
为了实现大规模的临床应用,需要提出一种可以同时检测氢体积分数φ(H2)、甲烷体积分数φ(CH4)和二氧化碳体积分数φ(CO2)的小型一体化检测仪器,其应具有快速方便、数据准确、性能稳定和可重复性高等优点,并能根据二氧化碳体积分数修正检测值,降低样本采集限制条件,减少呼气采集等人为因素造成的误差.
1 材料和方法
1.1 虚拟电子鼻系统设计
虚拟电子鼻系统基于气相色谱原理,简化了大型气相色谱设备的复杂结构,其硬件系统主要包括进样通路、清洗通路及检测通路三个部分.当两相三通电磁阀位于实线导通状态时,干燥管、计量环、流量计、精密流量调节阀、进样气泵依次连通构成进样通路.其中,干燥管内填充硅胶颗粒,用于滤除呼出气体中的水分,以消除湿度对传感器响应引起的误差.当管内三分之二的硅胶颗粒由蓝色变为粉色时,需重新填充.计量环用于定量存储样本气体,流量计与精密流量调节阀用于检测和调节气路流量,进样气泵提供负压以抽取气袋中的样本气体.过滤瓶、过滤塞、载气气泵(风扇)、精密流量调节阀、流量计、色谱柱、检测气室依次连通构成清洗通路.其中,过滤瓶内装有活性炭、硅胶颗粒、分子筛,用于过滤室内空气中的杂质分子以获得洁净的空气作为载气,以便持续清洗色谱柱与气室.过滤塞装有孔径为25 μm的纤维滤膜,以滤除大颗粒物质,避免堵塞气泵与色谱柱.载气气泵配有测温模块,通过温度反馈来调节风扇转速从而冷却气泵温度.
当两相三通电磁阀同时切换至虚线导通状态时,各部件构成检测通路,计量环中的样本被载气推入色谱柱中,分离后的各组分分别被红外激光传感器(GSS-SprintIR)与金属氧化物半导体(metal oxide semiconductor, MOS)传感器(TGS813)检测后,得到φ(H2)、φ(CH4)和φ(CO2),检测结果可显示于仪器的液晶屏上或通过热敏打印模块打印,也可通过串口或USB接口传输至上位机,再进行后续的数据分析.一次检测完成后,两相三通电磁阀再次切换至实线通路,仪器进入清洗状态,等到传感器响应恢复到基线值后,可进行下一次进样与检测.虚拟电子鼻系统结构原理如图1(a)所示,硬件实物如图1(b)所示.
1.2 检测气室设计
检测气室为长方体结构,一面上部开有二氧化碳传感器槽,另一面开有二氧化碳传感器通气口与MOS传感器槽,其底部开有圆柱形槽,构成气体反应室,反应室覆盖MOS传感器的敏感材料.气体反应室内部形成微小空间,经色谱柱分离后的气体各组分经过进气口,从气体反应室的顶部垂直流向MOS传感器表面,并从侧壁连通的出气口排出,以保证MOS传感器快速给出输出响应,并在短时间内恢复至基线.其中,二氧化碳传感器选用英国GSS公司SprintIR系列的高速红外激光传感器,采样频率可达20 Hz,功耗仅为35 mW,φ(CO2)测量范围为1%~20%,精确度为70×10-6.氢气和甲烷传感器选用日本FIGARO公司TGS813系列的MOS传感器,其对可燃烧气体有着较好的灵敏度,对呼出气体中除氢气与甲烷之外的大部分成分没有明显响应.
检测气室另一侧壁开有测温孔(Pt100).检测气室整体为金属材质,以保证较大的热惯性,顶面开有控温模块装配孔,控温模块包含加热器与过温保护开关.其中加热器与Pt100实现对检测气室的测温与控温,系统通电后,加热器对检测气室进行升温,温度传感器实时测量检测气室的温度作为反馈值,通过PID控温算法把温度控制在合适的恒定值,以尽可能抑制温度漂移对传感器输出造成的影响.当温度过高时,保护开关自动断开以保护传感器不受损坏.检测气室结构设计如图2所示.
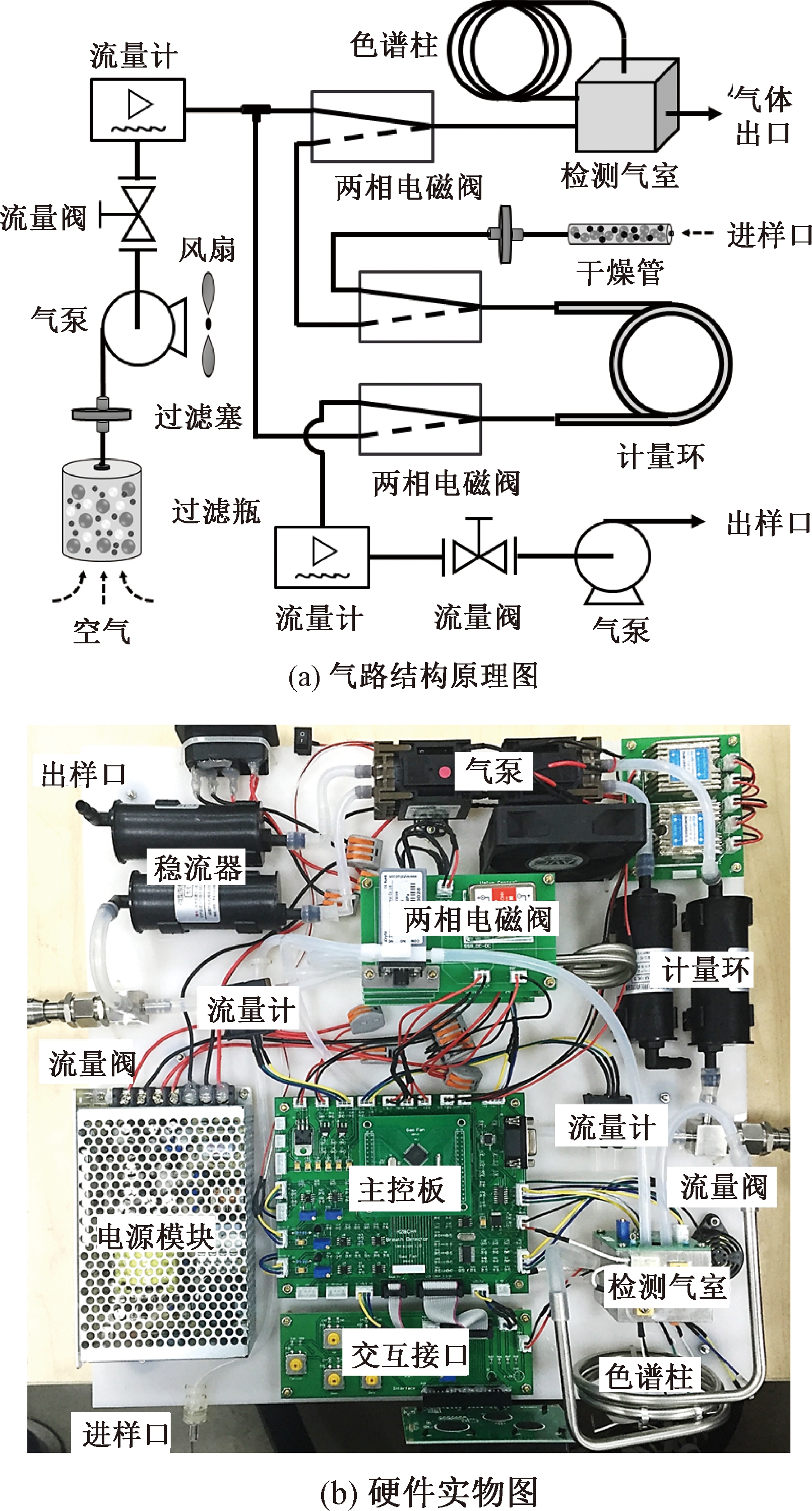
图1 虚拟电子鼻系统
Fig.1 Virtual electronic nose system
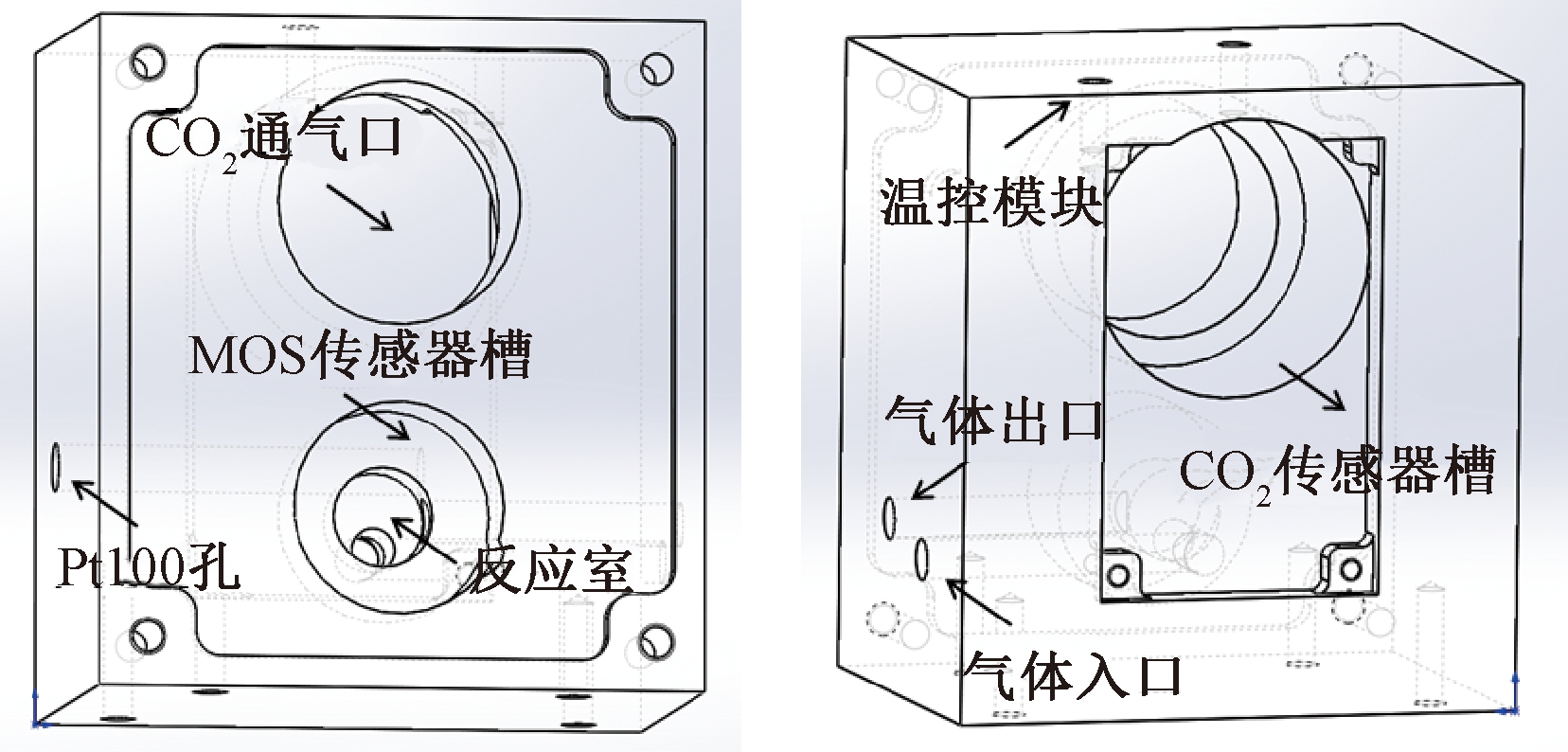
图2 检测气室结构设计
Fig.2 Structure design of gas detection chamber
1.3 标定实验与样本检测
根据一般人体呼出气体中φ(CO2)和胃肠道疾病病人呼出气体中φ(H2)和φ(CH4)[10-11],设定虚拟电子鼻对φ(H2)、φ(CH4)检测范围均为1×10-6~500×10-6,分辨率为1×10-6;对φ(CO2)检测范围为0.1%~10%,分辨率为0.1%.笔者利用标准气体对传感器进行标定,选用1 000×10-6的氢气与甲烷标准气体,使用计量法配置高浓度梯度(200×10-6~500×10-6)、中浓度梯度(20×10-6~180×10-6)、低浓度梯度(2×10-6~10×10-6),分别对传感器进行测试,每种浓度重复测量7次,每次检测提取峰值与基线并计算两者的差值,7次测量差值的平均值作为特征参数,分析特征值与浓度梯度的相关性,取相关系数R2最优的拟合结果作为标定公式.由于虚拟电子鼻受到环境与自身系统稳定性和随机噪声的影响,需在首次通电或检测了一定数量的样本后,使用特殊配置的标准气体(背景气体:洁净空气),φ(H2)=144×10-6,φ(CH4)=74×10-6,φ(CO2)=6.1%,对仪器进行校准并修正标定公式.
笔者选择SIBO作为代表性的胃肠道疾病.SIBO甲烷氢呼气试验一般服用乳果糖作为底物,根据检测者体重计算服用底物量,空腹服用底物0.5 h后开始测量,3 h内每隔20 min采集一次呼气样本,共计10个样本[12-13].使用仪器分别检测样本中φ(H2)、φ(CH4)的修正值,并绘制浓度随时间的变化曲线.选取医院提供的健康人与SIBO病人的样本进行检测与分析,对比两者的差异性,初步搭建SIBO诊断模型.
2 结果与分析
2.1 温度与流量控制
检测气室温度与载气气路流量是影响虚拟电子鼻系统检测结果准确性和稳定性的两个关键因素.控制检测气室温度恒定可避免呼出气体冷凝现象并抑制传感器输出响应的温度漂移.经测试,开机预热2 h后,检测气室温度稳定在38 ℃±0.5 ℃,MOS传感器输出响应达到稳定状态,基线漂移小于50 mV.系统通电后自动进入预热状态,程序判断出温度稳定在设置的范围后,允许系统进入主菜单.在运行过程中,当气室温度异常时,程序自动跳入预热界面,禁止其他所有操作.气室控温与传感器基线漂移曲线如图3所示.
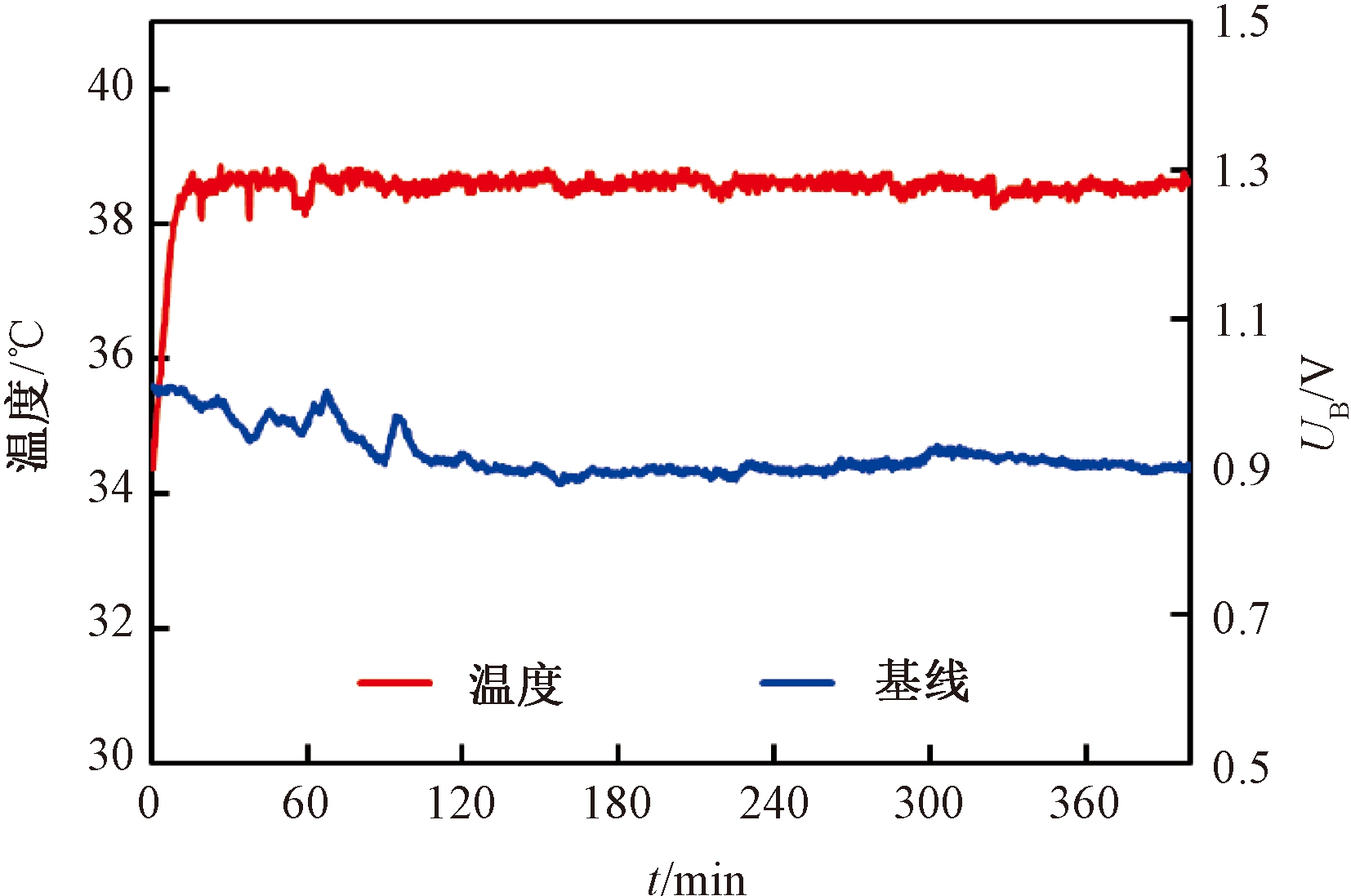
图3 气室控温与传感器基线漂移曲线
Fig.3 Temperature control of the gas chamber and baseline drift of sensor
虚拟电子鼻系统传感器对氢气和甲烷混合气体输出响应为双峰结构,经过色谱柱分离后,氢气先从色谱柱中流出,甲烷随后流出.MOS传感器分别对氢气和甲烷产生响应,响应峰值的时间点代表检测的物质,响应峰值的大小反应检测物质的浓度.载气气路流量对MOS传感器输出响应和双峰结构有着显著影响,分别设置5种不同的载气气路流量,对φ(H2)=200×10-6(背景气体:洁净空气)的样本多次测量,观察流量对传感器输出响应的影响,如图4所示.可以看出,流速较大时,出峰较快,峰值响应较大,但氢气峰与甲烷峰之间重叠较多,即传感器在与氢气反应后,未恢复基线时就与甲烷开始反应,致使检测结果误差较大;流速较小时,两个特征峰分离较开,但峰值响应较小,恢复基线时间较久,致使单次检测周期过长,不利于大样本分析.综合考虑检测准确性与检测周期,设置当载气气路流量在60 mL/min±3 mL/min的范围内时,允许仪器进入检测状态.当仪器运行过程中载气气路流量异常时,仪器显示错误界面,需调整精密流量阀或检查气路,使流量恢复正常后才能进行其他操作.
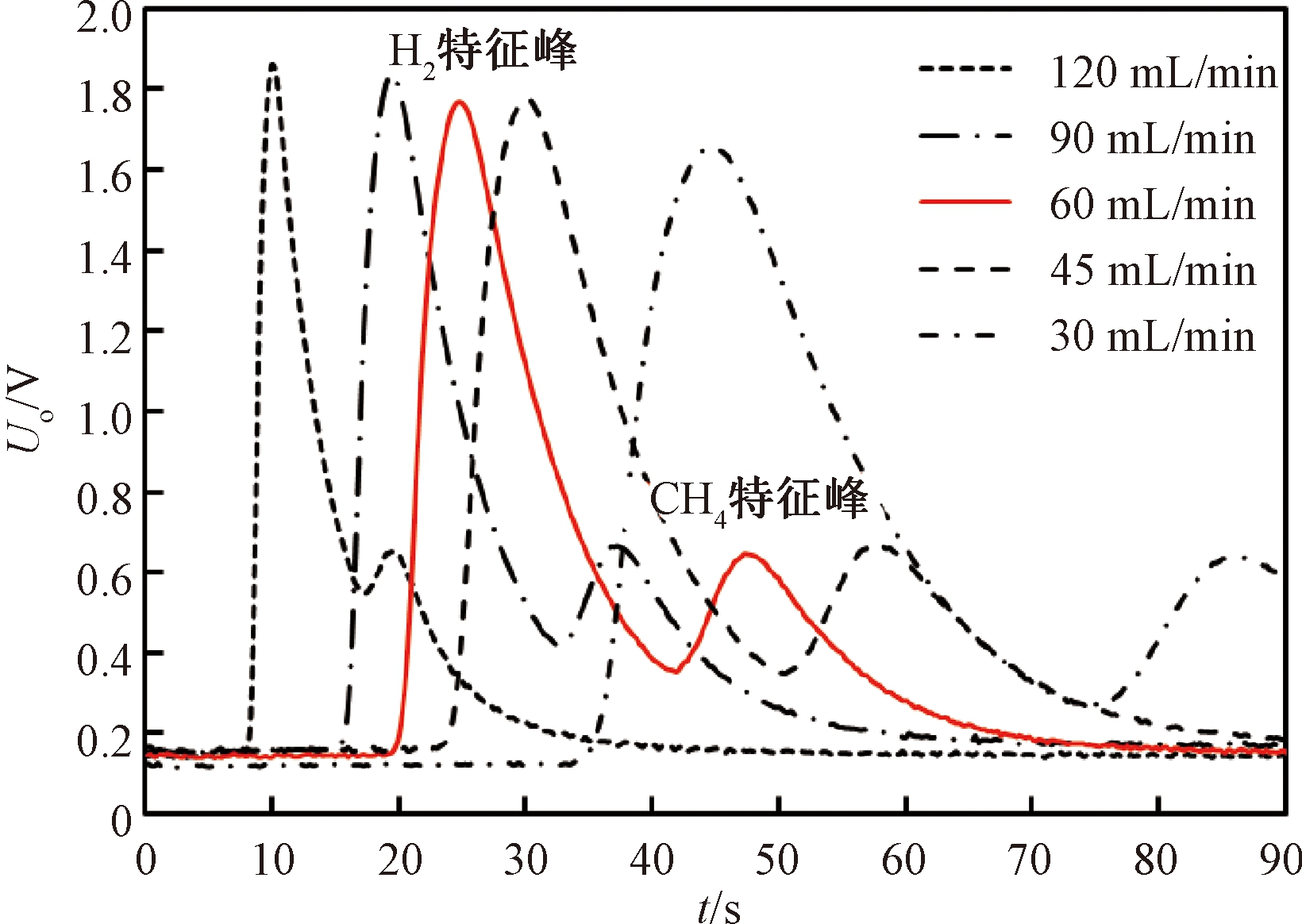
图4 载气气路流量对传感器输出响应的影响
Fig.4 Influence of carrier gas flow rate on sensor output response
2.2 二氧化碳浓度修正
人体呼吸节律过程中,与血液中气体发生交换的肺泡气含有较多的代谢物质.在采集样本时,待测者一次呼气的不同阶段所含氢气、甲烷含量不同,φ(H2)检测值如图5(b)(修正前)所示.可以看出,测量结果可比性较差,不利于诊断分析.现阶段检测技术与设备对采气限制条件较多,很难保证完全获取肺泡气,从而增加操作复杂度并影响推广.笔者设计的检测系统可同步测量样本中的φ(CO2),并对φ(H2)、φ(CH4)检测值进行修正.
预设φ(CO2)期望值为5.5%(该值为一般人体肺泡气二氧化碳体积分数).φ(CO2)期望值除以φ(CO2)检测值后得到修正因子,修正后的φ(H2)、φ(CH4)等于φ(H2)、φ(CH4)检测值乘以修正因子.呼出气体中φ(CO2)与修正因子如图5(a)所示,呼出气中的φ(CO2)和计算后得到的修正因子随不同的呼气阶段(如死腔气体与肺泡气等)呈周期性变化.φ(H2)的二氧化碳修正结果如图5(b)所示,呼出气中的φ(H2)随φ(CO2)的变化而变化,修正后的φ(H2)被归一化到同一水平,消除了不同呼气阶段造成的差异.该修正方法有利于降低样本采集限制条件,减少呼气采集等人为因素造成的误差,使检测结果更具可比性,为相关疾病的初筛与诊断提供更可靠的检测数据.
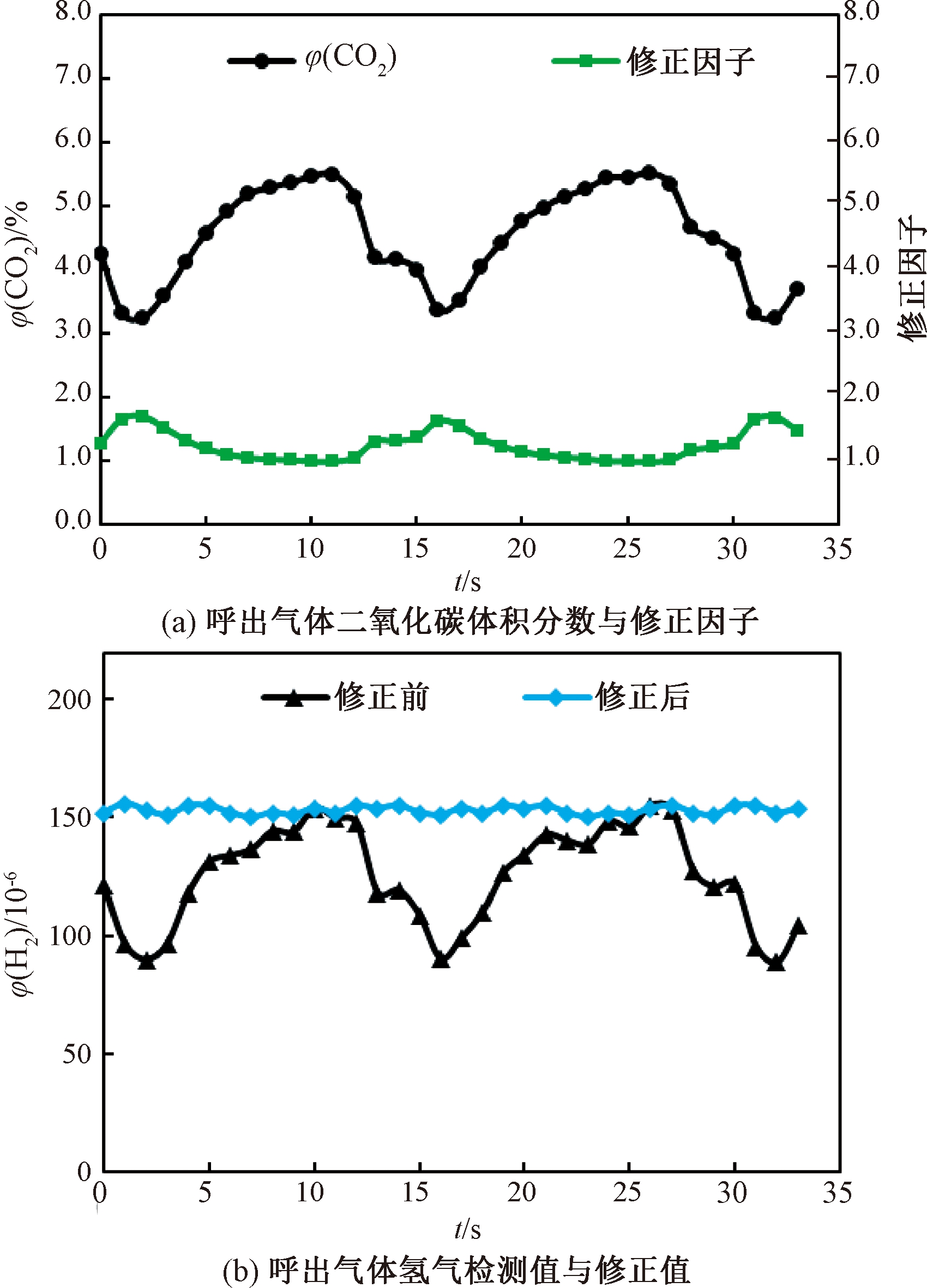
图5 二氧化碳修正曲线
Fig.5 Correction curve of CO2
2.3 气体浓度梯度标定实验
对虚拟电子鼻系统MOS传感器进行标定,甲烷浓度梯度响应曲线如图6所示.MOS传感器输出响应形成双峰曲线,依次为氢气特征峰与甲烷特征峰,双峰之间间隔较大,氢气响应恢复基线后再与甲烷开始反应,甲烷反应后快速恢复基线,整体单次测量周期为90 s.氢气与甲烷特征峰位置重复性良好,峰值与浓度呈明显正相关.低浓度梯度响应与中高浓度梯度响应相比,因为信噪比降低,曲线更为粗糙,甲烷特征峰区分不明显,可通过单独增加放大倍数加以改进.
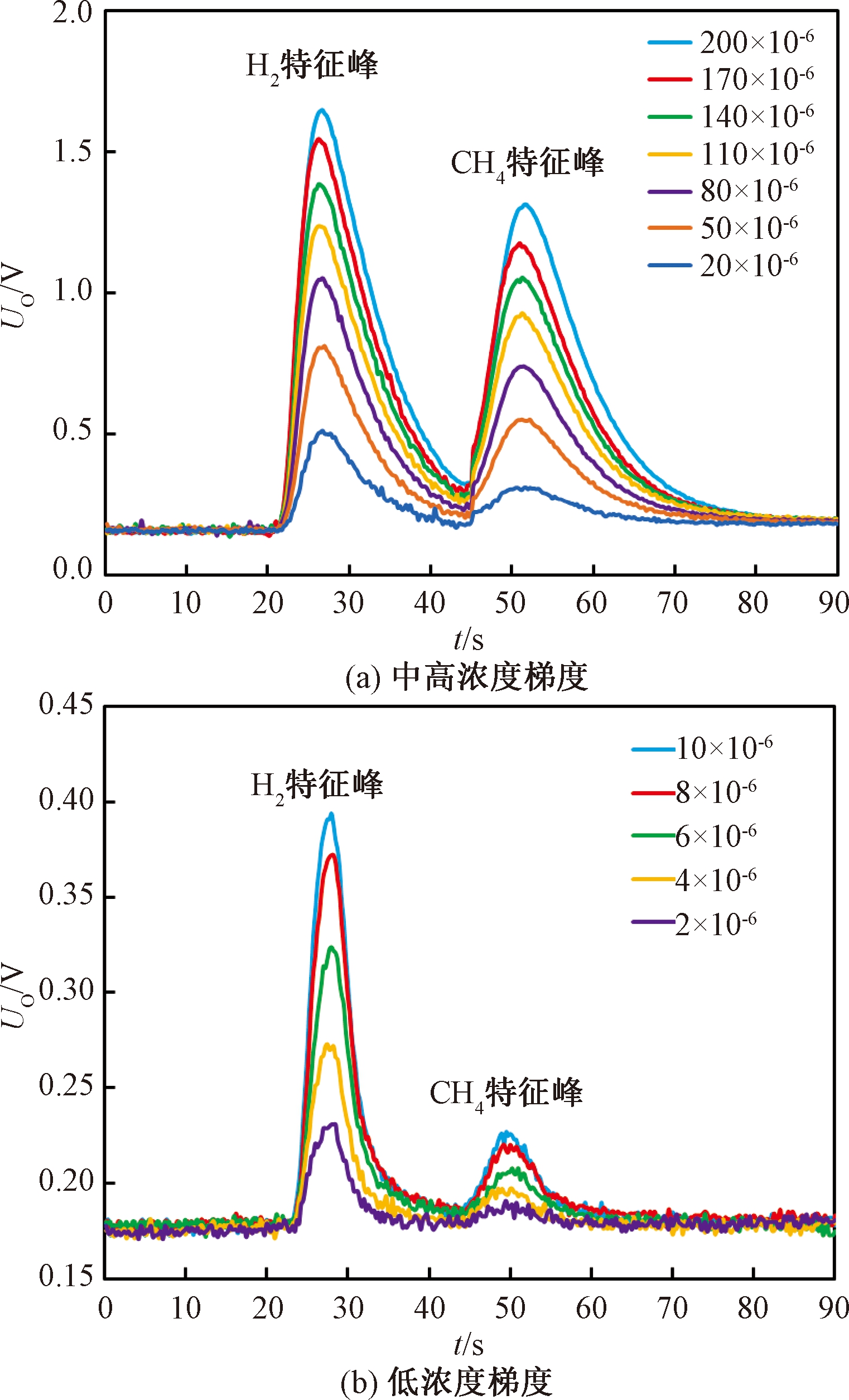
图6 虚拟电子鼻氢气与甲烷浓度梯度响应曲线
Fig.6 Response curves of H2 and CH4 concentration of virtual electronic nose
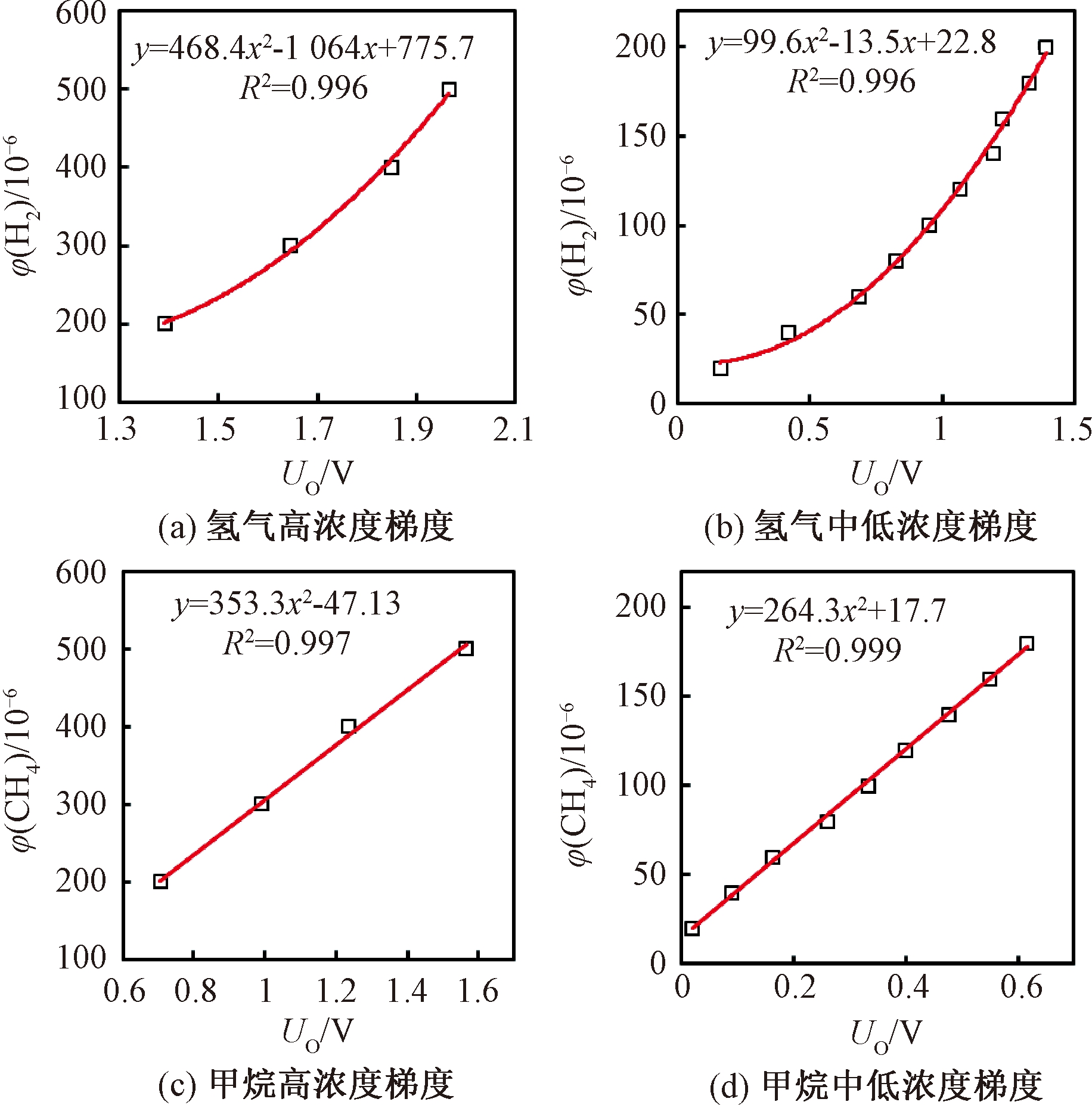
图7 虚拟电子鼻响应与浓度梯度相关性分析
Fig.7 Correlation analysis between responses of virtual electronic nose and concentration gradient
提取多次测量的传感器响应峰值作为特征参数,氢气和甲烷的高浓度与低浓度梯度相关性分析分别如图7所示.取相关系数(R2)最优的拟合结果作为标定公式,氢气标定公式为二次曲线,甲烷标定公式为线性曲线,4组公式的R2均大于0.99,线性拟合度良好.测试样本时,将传感器输出响应带入标定公式后可计算出φ(H2)、φ(CH4)检测值.根据人体呼出气体中φ(CO2)范围,设定修正因子小于4时,所测φ(CO2)有效,并对φ(H2)、φ(CH4)检测值进行修正.虚拟电子鼻系统对φ(H2)、φ(CH4)的检测范围均为1×10-6~500×10-6,分辨率为1×10-6,满足一般患者呼出气内φ(H2)、φ(CH4)所需检测范围和灵敏度.
2.4 诊断模型
选择SIBO作为代表性的胃肠道疾病,选取健康人与SIBO病人的样本进行检测与分析.检测者在空腹时根据自身体重服用一定量的乳果糖,3 h内采集10次样本,使用仪器分别检测样本中φ(H2)、φ(CH4)的修正值,绘制浓度随时间的变化曲线,建立SIBO诊断模型,包含检测数据、模型分析、参数设置等功能的上位机软件界面如图8所示.健康人小肠段中细菌较少,乳果糖不被消化吸收,φ(H2)、φ(CH4)维持在基线水平,1~2 h后,乳果糖到达结肠段被细菌分解产生氢气,产甲烷菌结合氢气与二氧化碳产生甲烷,φ(H2)、φ(CH4)显著上升(对照组).SIBO病人的曲线趋势主要分为单峰模型和双峰模型.单峰模型中,φ(H2)、φ(CH4)、φ(H2)+φ(CH4)相较于基础值至少分别上升了20×10-6、6×10-6、24×10-6,且起始上升时间(St)在90 min之前.双峰模型中,首次出现峰(Pv1)的时间点(St1)至少在90 min之前,φ(H2)、φ(CH4)、φ(H2)+φ(CH4)相较于基础值至少分别上升了12×10-6、4×10-6、14×10-6,且短暂回落基线后出现峰值更高的结肠峰(Pv2).
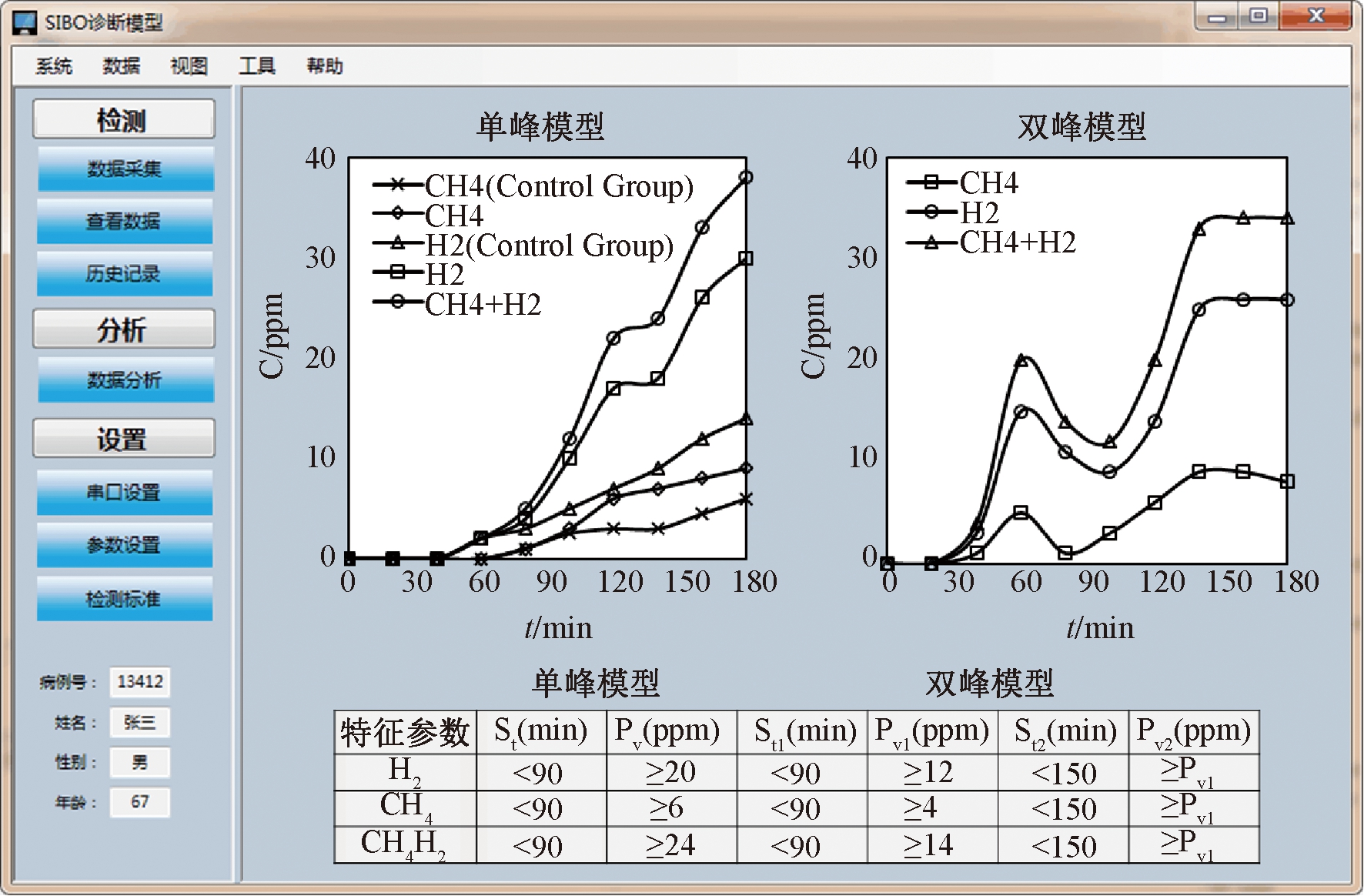
图8 SIBO诊断模型与软件界面
Fig.8 Software interface with diagnosis models for SIBO
此外,如果在服用乳果糖之前,φ(H2)、φ(CH4)的基础值分别大于20×10-6、10×10-6,且每隔20 min连续测3次的φ(H2)、φ(CH4)均大于20×10-6、10×10-6,则也判断为SIBO阳性.但如果较高的φ(H2)、φ(CH4)基础值在1 h内有显著的下降,则考虑为禁食不充分,需3~5 d后禁食重新测量.
3 讨论
本研究设计了基于虚拟电子鼻的甲烷氢呼气胃肠道功能检测系统,使用标准气体标定传感器,并分析输出响应特征值与浓度梯度相关性,得出标定公式,选用实际呼气样本验证仪器准确性与稳定性,并分析健康人与SIBO病人呼气中φ(H2)、φ(CO2)曲线的差异,初步建立SIBO诊断模型.与现有设备和技术相比,该系统具有以下特点与优势:
(1)φ(CO2)的同步检测与修正.根据φ(CO2)浓度修正后的φ(H2)、φ(CH4)被归一化到同一水平,消除了不同呼气阶段造成的差异,减少呼气采集等人为因素造成的误差,为相关疾病的初筛与诊断提供更可靠的检测数据;
(2)独特的检测气室结构.样本中各组分从气体反应室的顶部垂直流向MOS传感器表面,并从侧壁连通的出气口排出,MOS传感器快速给出输出响应,并在短时间内恢复基线,单次检测周期较短;
(3)精确的气路流量控制.设置最佳的进样流量使样本短时间内自动充满计量环.设置最优的载气流量使氢气与甲烷特征峰相互分离无重叠,且在短时间内恢复基线,进一步缩短单次检测周期,以满足临床大样本量的检测需求;
(4)利用仪器搭建诊断模型.仪器实现无创、快速检测呼出气体中φ(H2)、φ(CH4),准确性与稳定性良好.载气为过滤后的空气,无需特殊高纯气体,减少气瓶、压力转换与控制等部件的体积与复杂度,提高使用安全性.整体操作简便,用户交互友好,分析实际样本初步搭建SIBO诊断模型.
未来可进一步增加健康人与病人检测样本量,拓展胃肠道疾病检测种类,增加检测标志物,实现一体化多疾病综合检测系统,建立更为丰富智能的诊断模型,通过大数据分析制定疾病诊断标准.由此搭建胃肠道疾病检测中心或联合大型医院与社区医院形成胃肠道疾病诊疗网络,实现云平台数据共享、实时在线诊断等信息交互功能.
4 结论
呼气试验是一种日渐流行的胃肠道功能检测方法,在用于诊断SIBO等胃肠道疾病有着广泛的应用.笔者介绍了一种基于虚拟电子鼻的胃肠道功能检测系统,可检测人体呼出气体中φ(H2)、φ(CH4)和φ(CO2).由过滤后的室内空气作为载气,持续清洗色谱柱与检测气室,检测气室配有测温与控温模块,维持气室温度为38 ℃±0.5 ℃,使传感器基线漂移小于50 mV.自动进样并切换两相三通阀后,计量环中的待测样本被载气推入色谱柱进行分离,混合气体中的各组分分别被传感器检测.虚拟电子鼻经过标准气体标定后,分析输出响应与浓度梯度的相关性,取相关系数(R2)最优的拟合结果作为标定公式,由此计算得出φ(H2)、φ(CH4),并可根据φ(CO2)进行修正,消除死腔气体的影响.该系统对φ(H2)、φ(CH4)检测范围均为1×10-6~500×10-6,分辨率可达1×10-6.对健康人与病人样本进行分析,建立SIBO诊断模型.笔者设计的检测系统具有特异性高、重复性与稳定性良好、无创且操作便捷等优势,在未来可用于大规模的临床与家庭病人的数据采集与诊断分析.
[1] YANG C Y, CHANG C S, CHEN G H.Small-intestinal bacterial overgrowth in patients with liver cirrhosis, diagnosed with glucose H2 or CH4 breath tests[J].Scandinavian journal of gastroenterology, 1998, 33(8): 867-871.
[2] GASBARRINI A, LAURITANO E C, GABRIELLI M, et al.Small intestinal bacterial overgrowth: diagnosis and treatment[J].Digestive diseases, 2007, 25(3): 237-240.
[3] RIORDAN S M, MCLVER C J, DUNCOMBE V M, et al.Bacteriologic analysis of mucosal biopsy specimens for detecting small-intestinal bacterial overgrowth[J].Scandinavian journal of gastroenterology, 1995, 30(7): 681-685.
[4] SUNG H J, PAIK C N, CHUNG W C, et al.Small intestinal bacterial overgrowth diagnosed by glucose hydrogen breath test in post-cholecystectomy patients[J].Journal of neurogastroenterology & motility, 2015, 21(4): 545-551.
[5] LIN E C, MASSEY B T.Scintigraphy demonstrates high rate of false-positive results from glucose breath tests for small bowel bacterial overgrowth[J].Clin Gastroenterol Hepatol, 2016, 14(2): 203-208.
[6] PIMENTEL M, CHOW E J, LIN H C.Normalization of lactulose breath testing correlates with symptom improvement in irritable bowel syndrome: a double-blind, randomized, placebo-controlled study[J].Am J Gastroenterol, 2003, 98(2): 412-419.
[7] WALTERS B, VANNER S J.Detection of bacterial overgrowth in IBS using the lactulose H2 breath test: comparison with 14C-D-xylose and healthy controls[J].Am J Gastroenterol, 2005, 100(7): 1566-1570.
[8] REIS J C, MORAIS M B, OLIVA C A, et al.Breath hydrogen test in the diagnosis of environmental enteropathy in children living in an urban slum[J].Dig Dis Sci, 2007,52(5): 1253-1258.
[9] MENDOZA E, CRISMATT C, MATOS R, et al.Diagnosis of small intestinal bacterial overgrowth in children: the use of lactulose in the breath hydrogen test as a screening test[J].Biomedica, 2007, 27(3): 325-332.
[10] COSTA M B, AZEREDO J I L, MARCIANO R D, et al.Evaluation of small intestine bacterial overgrowth in patients with functional dyspepsia through H2 breath test[J].Arq Gastroenterol, 2012, 49(4): 279-283.
[11] KOROTKOVA O V, SALINAS Y E, VASILIEVA E A, et al.Hydrogen respiratory test: pilot examinations for evaluation of the small intestinal colonization by normal microflora[J].Bull Exp Biol Med, 2013, 154(6): 818-820.
[12] LUPASCU A, GABRIELLI M, LAURITANO E C, et al.Hydrogen glucose breath test to detect small intestinal bacterial overgrowth: a prevalence casecontrol study in irritable bowel syndrome[J].Alimentary pharmacology & therapeutics, 2005, 22(11/12): 1157-1160.
[13] SAAD R J, CHEY W D.Breath testing for small intestinal bacterial overgrowth: maximizing test accuracy[J].Clin gastroenterol hepatol, 2014,12(12): 1964-1972.