0 引言
磺胺类抗生素是应用最早的人工合成的抗菌药,因其抗菌谱广、疗效强、方便安全等优点被广泛用于人体和动物[1]。但是抗生素在生物体内并不能被完全吸收,绝大部分抗生素或其代谢产物被排除体外进入环境中,有可能破坏生态系统[2]。因此如何从环境中去除其残留物成为亟需解决的课题。Yang等[3]比较了多孔树脂和活性炭对磺胺类药物的吸附效果,探讨了吸附机理;曹慧等[4]制备了磁性多壁碳纳米管并用于磺胺类药物的吸附行为研究;李雪冰等[5]利用活性炭吸附磺胺药物,具有良好的吸附效果。
吸附法由于成本低、操作简单等优点,在去除磺胺嘧啶钠等领域受到青睐[6]。最常用的吸附剂为活性炭,活性炭具有巨大的比表面积和复杂的孔道结构,成本低,工艺成熟。
而磁性活性炭既保留了传统活性炭优良的吸附性能,又能通过磁性回收,便于活性炭的再次回收,因此受到了广泛关注。赋予活性炭磁性可采用一步法或者化学共沉淀法在活性炭上负载磁性颗粒(γ-Fe2O3、Fe3O4)。但由于化学共沉淀法的步骤多及磁性颗粒可能堵塞孔道的缺点,比较而言,一步法是更好地制备磁性活性炭的方法[7]。
笔者以生物质沙柳为原料,氯化锌为活化剂,氯化铁为磁化剂,通过一步热解制备了生物质磁性活性炭(magnetic biochar,MBC)。考察了磁性活性炭对磺胺嘧啶钠(sulfadiazine sodium,SAS)的静态吸附性能,不仅为活性炭的制备开辟了一条新途径,并且对实现沙柳资源的多级综合利用和减少抗生素污染具有重要意义。
1 实验
1.1 实验材料及仪器
磁性活性炭的制备:配制45 mL含有氯化锌和氯化铁的混合溶液,将沙柳浸于混合溶液中(沙柳、氯化锌和氯化铁的质量比为4∶4∶1),于60 ℃保温6 h后分离干燥。然后将前驱物放入程序升温的箱式炉中在700 ℃下活化1 h。再酸洗和水洗除杂,后筛分备用。
磺胺嘧啶钠购于河南海正升华生物技术有限公司。所有试剂均为分析纯。
主要仪器:pH计(pHS-3C),紫外可见分光光度计(UV-2012PV),气浴恒温振荡箱(SHZ-82)。
1.2 实验方法
取20 mL不同质量浓度的SAS水溶液放入50 mL锥形瓶中,然后向锥形瓶中加入0.01 g的MBC,混合后置于恒温振荡箱中。在一定温度下振荡一定时间磁分离。取上层清液测定吸光度,计算溶液中SAS含量。
1.3 吸附量的测定
用紫外分光光度计测定溶液吸光度,磺胺嘧啶钠的最大吸收波长为254 nm。单位质量吸附剂的吸附量根据下式计算:
(1)
式中:C0和Ce分别为吸附前和吸附平衡时SAS溶液质量浓度,mg/L;V为溶液体积,L;W为吸附剂用量,g;qe为平衡吸附量,mg/g。
2 结果与讨论
2.1 溶液pH值对MBC吸附SAS的影响
溶液的pH值能改变吸附剂和吸附质表面的电荷,进而影响吸附的过程[8]。为了探究其影响,配制质量浓度为181 mg/L的SAS溶液,调节溶液的pH值为2~11,加入0.01 g的MBC于298 K下振荡8 h。结果如图1所示。
从图1中可以看出,最小吸附量(232 mg/g)达到的最大吸附量(256 mg/g)的92 %,吸附量对溶液的pH值不敏感。磺胺嘧啶钠是两性分子,在不同的pH值下会有阳离子、阴离子和两性离子3种存在形态[9]。由于MBC吸附量随溶液 pH的变化很小,说明吸附过程与吸附质分子的存在形式没有明显的关系。
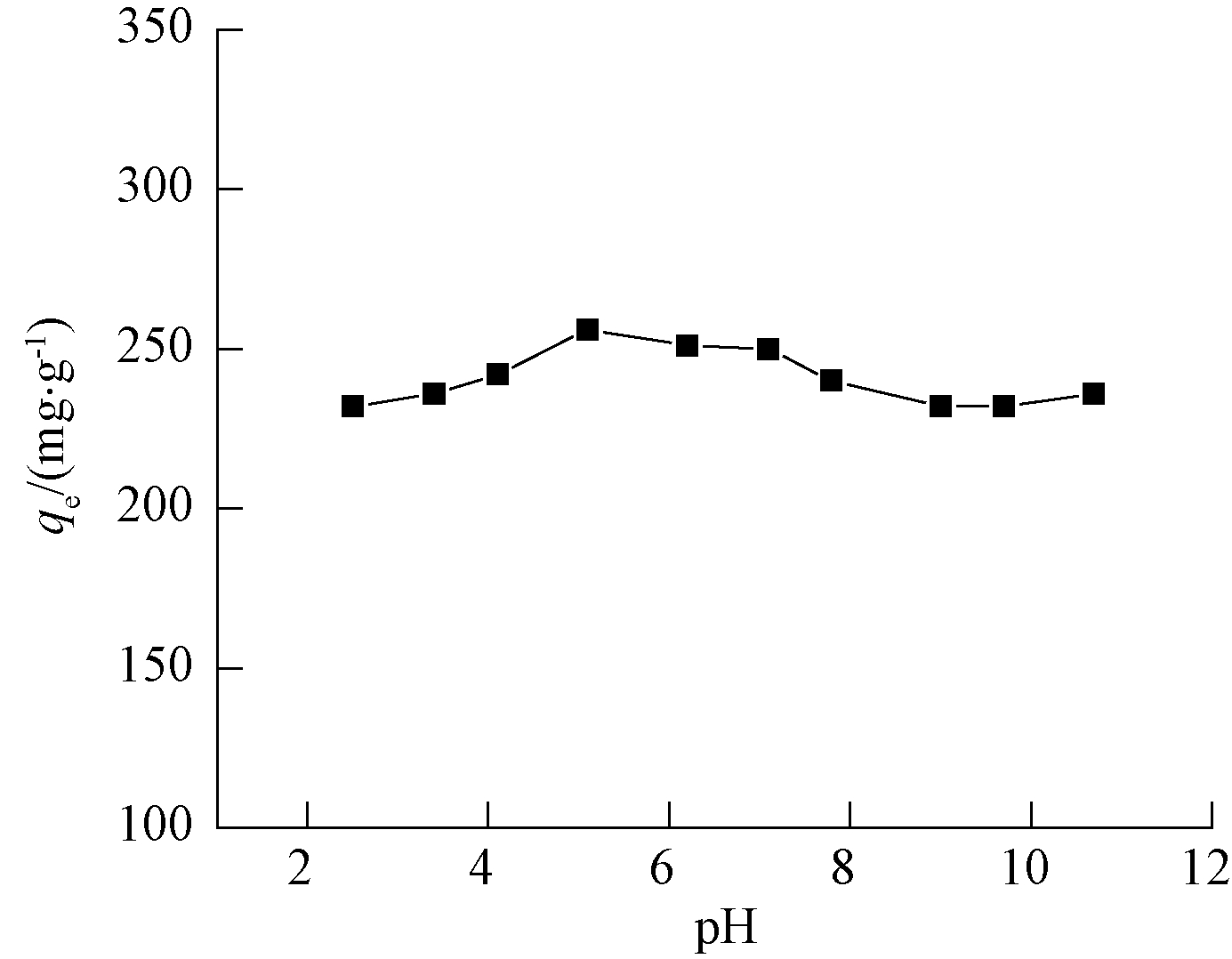
图1 溶液pH值对MBC吸附SAS的影响
Figure 1 The effect of pH on the adsorption of SAS by MBC
2.2 离子强度对MBC吸附SAS的影响
配置一系列含有NaCl或CaCl2(0~0.08 mol/L)的SAS溶液(181 mg/L),从中取20 mL加入0.01 g的MBC中,在298 K振荡8 h。实验结果见图2。
从图2可以看出,随着盐离子浓度的增大,MBC吸附量几乎没有变化,维持在240 mg/g。这说明材料的吸附性能表现出良好的稳定性。

图2 离子强度对MBC吸附SAS的影响
Figure 2 The effect of ionic strength on the adsorptionof SAS by MBC
2.3 吸附等温线
在一系列的SAS溶液中(25~227 mg/L),加入0.01 g的MBC,于298 K下振荡8 h,吸附达到平衡,结果见图3。
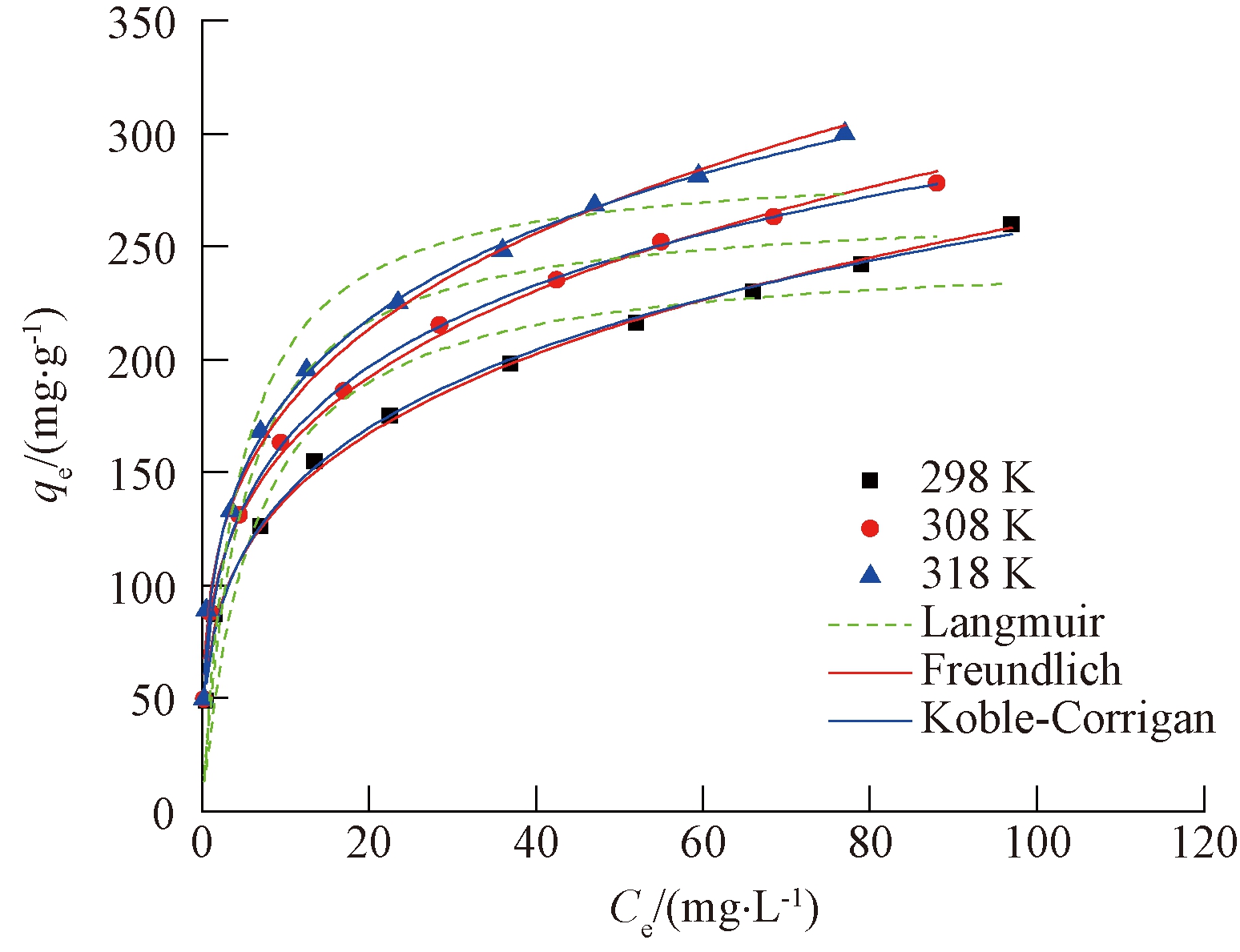
图3 MBC对SAS的吸附等温线拟合曲线
Figure 3 Adsorption isotherms of SAS onto MBC
采用Langmuir、Freundlich和Koble-Corrigan 3种等温线模型来描述MBC对SAS的吸附过程。方程式如下所示:
Langmuir吸附等温模型:
(2)
Freundlich吸附等温模型:
(3)
Koble-Corrigan吸附等温模型:
(4)
式中:qe是平衡吸附量,mg/g;Ce是溶液的平衡浓度,mg/L;qm是理论上的最大单分子层吸附量,mg/g;KL是Langmuir等温吸附常数,L/mg,其大小与吸附能有关;KF((mg/g) (L/mg)1/n)和 nF 都是 Freundlich常数且只与温度有关,分别代表吸附量和吸附强度;A、B、nK均为K-C等温模型常数。
对实验数据进行非线性拟合,见表1。从图3和表1可以看出,298 K时的最大吸附量为248.4 mg/g,而且吸附量随温度的增大而增大。
表1 MBC吸附SAS的吸附等温线拟合参数
Table 1 Parameters of adsorption isotherm of SAS onto MBC
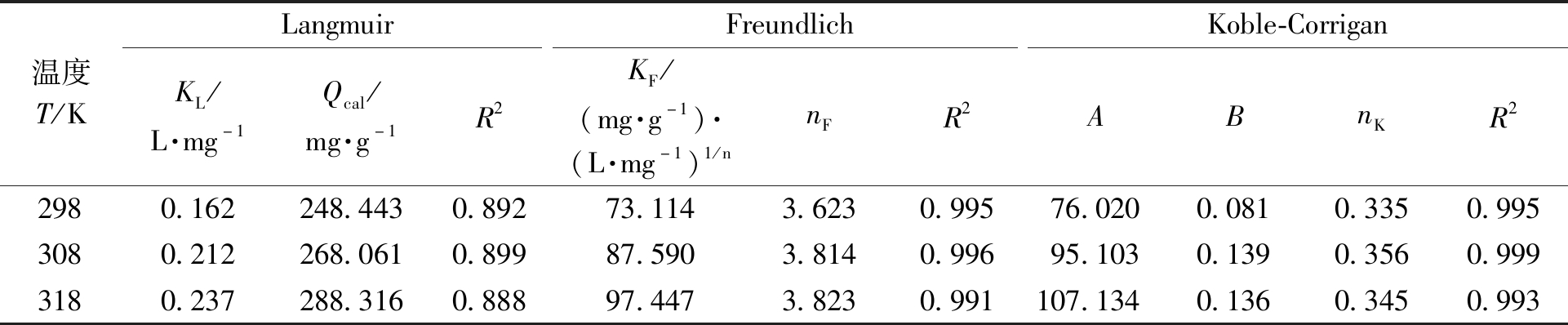
温度T/KLangmuirFreundlichKoble-CorriganKL/L·mg-1Qcal/mg·g-1R2KF/(mg·g-1)·(L·mg-1)1/nnFR2ABnKR22980.162248.4430.89273.1143.6230.99576.0200.0810.3350.9953080.212268.0610.89987.5903.8140.99695.1030.1390.3560.9993180.237288.3160.88897.4473.8230.991107.1340.1360.3450.993
Freundlich和Koble-Corrigan模型的相关系数均大于0.99,能较好地模拟吸附过程。符合Freundlich经验方程,说明吸附是发生在不均匀界面上的多分子层吸附[10]。随着温度的升高,nF值是增加的,说明了升温有利于吸附。K-C等温线模型其模型参数nK在0与1之间,说明过程中具备Langmuir和Freundlich方程的共同特征。
2.4 吸附动力学
吸附动力学用来描述吸附过程速率的快慢,分析吸附速率随时间的变化规律。分别采用准一级、准二级和Elovich动力学方程对MBC吸附SAS的动力学行为进行分析。方程的表达式如下:
准一级动力学方程:
q=qe(1-ek1t);
(5)
准二级动力学方程:
(6)
Elovich动力学方程:
(7)
式中:qe表示吸附剂在吸附平衡时的吸附量,mg/g;k1是准一级动力学模型的常数,min-1;k2是准二级动力学吸附常数,g/(mg·min);α为初始吸附速率,mg/(g·min);β为与表面覆盖度和活化能有关的常数,g/min。
对实验数据进行非线性拟合,结果见图4和表2。
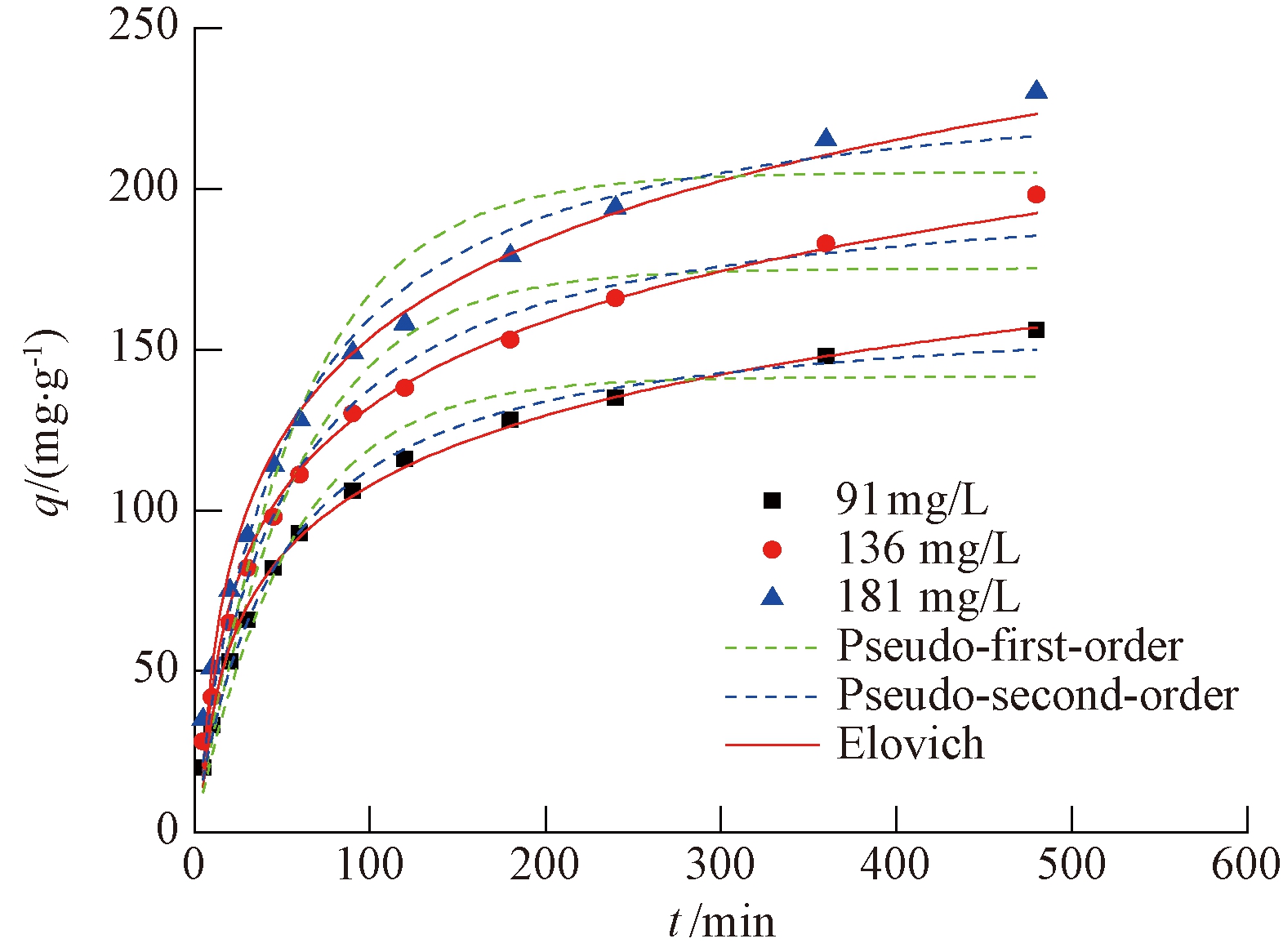
图4 MBC吸附SAS的吸附动力学曲线
Figure 4 Adsorption kinetic curves of SAS onto MBC
表2 MBC对SAS的吸附动力学参数
Table 2 Kinetic parameters for the adsorption of SAS on the MBC
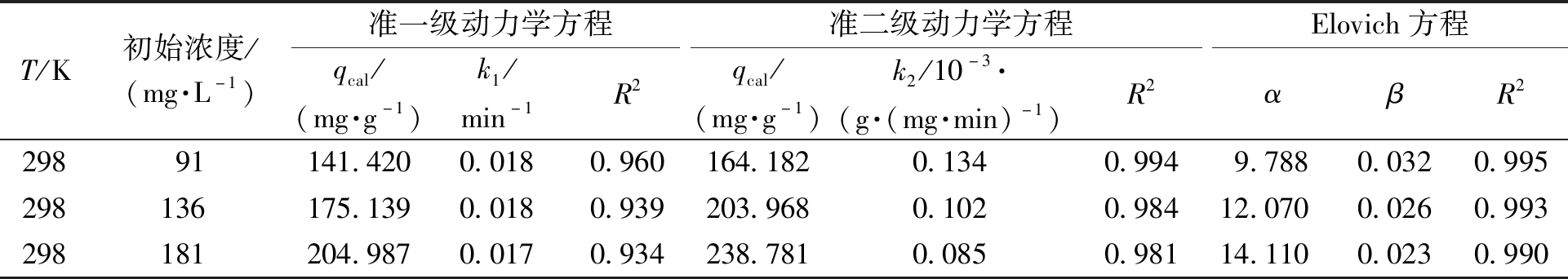
T/K初始浓度/(mg·L-1)准一级动力学方程准二级动力学方程Elovich方程qcal/(mg·g-1)k1/min-1R2qcal/(mg·g-1)k2/10-3·(g·(mg·min)-1)R2αβR229891141.4200.0180.960164.1820.1340.9949.7880.0320.995298136175.1390.0180.939203.9680.1020.98412.0700.0260.993298181204.9870.0170.934238.7810.0850.98114.1100.0230.990
从图4中可以看出,在90 min之前,吸附量增加的较快,这是因为吸附初期,溶液中SAS的浓度较大,MBC表面也有大量的活性位点,所以吸附速率相对较快。在90~480 min之内的曲线斜率变小,这是因为MBC表面的吸附位逐渐饱和,SAS分子进入MBC内部孔道,浓度降低,吸附速率逐渐下降,吸附量上升缓慢。当时间达到480 min时,吸附基本达到平衡。而且随着浓度的增大,吸附量随之增大。从表3可以看出Elovich动力学方程的相关系数更大(R2>0.99),可以更好地描述整个吸附过程,表明该吸附过程是不均匀界面上的多层吸附[11]。
为了进一步探究分子扩散过程,利用粒子内扩散模型来拟合数据。该模型可以用来描述物质在颗粒内部扩散的过程。其表达式如下所示:
q=k×t1/2+C,
(8)
式中:q表示吸附剂在时间t的吸附量;k是颗粒内扩散方程的速率常数,mg/(g·min1/2);C的值与边界层的厚度有关。在298 K温度不同初始浓度下MBC吸附SAS的参数如表3所示。
表3 不同初始浓度下MBC吸附SAS的粒子内扩散参数
Table 3 The parameters of intra-particle diffusion for SAS on the MBC with different initial concentrations
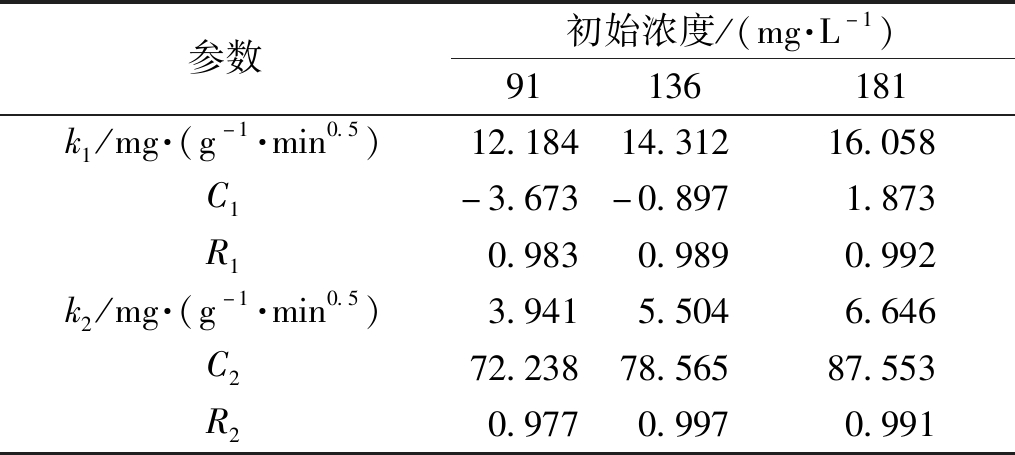
参数初始浓度/(mg·L-1)91136181k1/mg·(g-1·min0.5)12.18414.31216.058C1-3.673-0.8971.873R10.9830.9890.992k2/mg·(g-1·min0.5)3.9415.5046.646C272.23878.56587.553R20.9770.9970.991
扩散分为两部分。在扩散的第一阶段,SAS分子从水相中扩散到MBC的外表面并发生吸附,这一过程的传质阻力相对较小,速率较快。当吸附剂外表面达到饱和后,吸附过程进入第二阶段。因为吸附质SAS分子进入MBC的孔道内部,这一过程阻力较大,所以吸附速率较慢。另外拟合的直线没有通过原点,说明颗粒内扩散不是唯一的控速步骤,吸附过程是由膜扩散和粒子内扩散联合控制[12]。
3 吸附机理
为了探究吸附质与吸附剂间的作用力,采用溴化钾压片法,对MBC及吸附SAS后的MBC进行了红外表征,其结果见图5。从pH值和离子强度实验结果可知,溶液的pH值和盐度对吸附量的影响不明显,结合MBC及吸附SAS后MBC的红外光谱图,说明吸附作用力比较复杂,不仅有静电作用,还可能存在疏水作用、氢键和π—π共轭等作用力[13]。
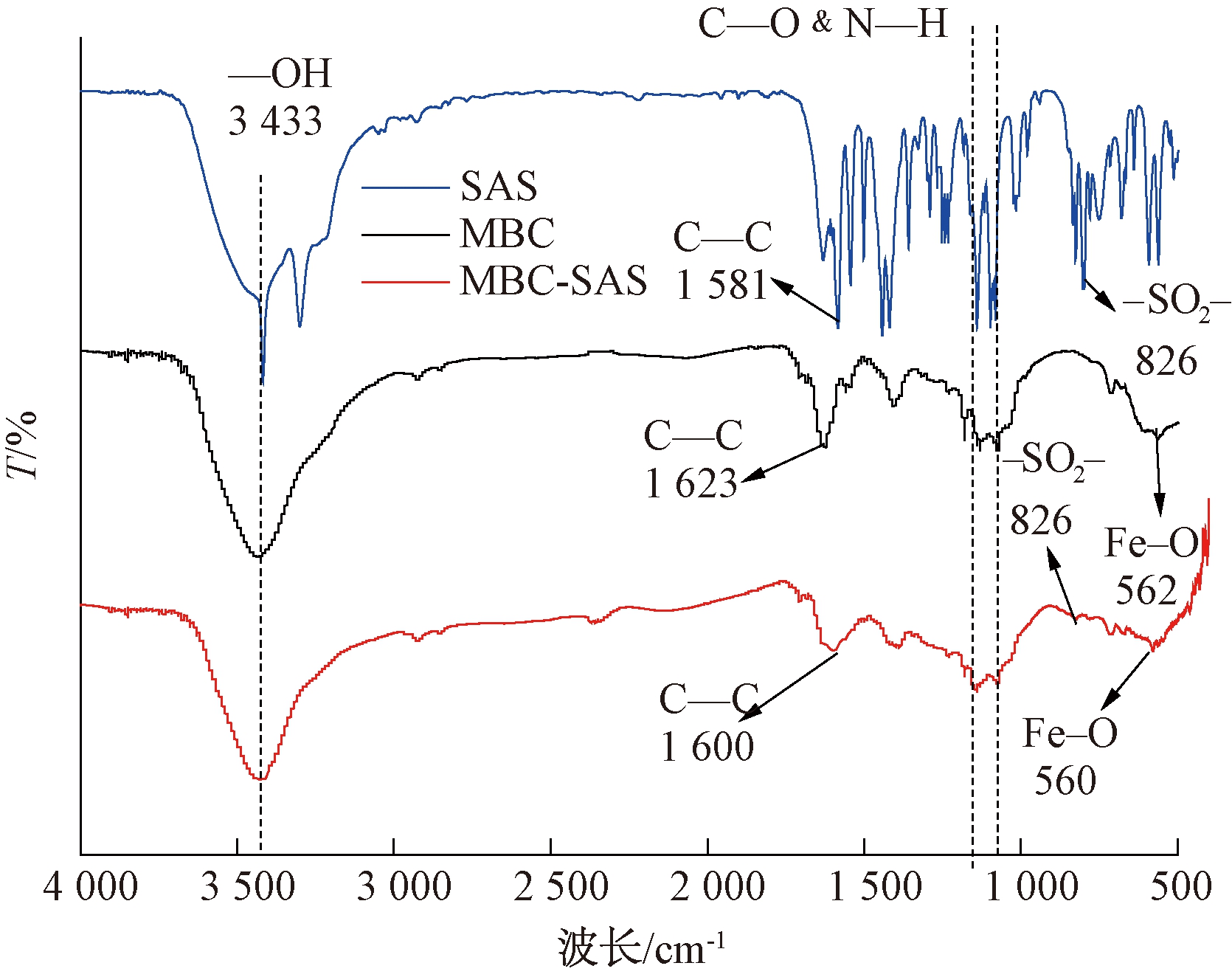
图5 磁性活性炭及吸附SAS后活性炭的红外光谱
Figure 5 FTIR spectra of MBC and MBC after adsorption
未吸附的MBC在3 439 cm-1处出现一个明显的O—H特征峰。1 623 cm-1 处的吸收峰为苯环内碳碳双键的吸收峰[14]。1 000 cm-1 和1 200 cm-1附近的峰为C—O 和—N—H 的吸收峰。最后,570 cm-1 处为 Fe—O的吸收峰[15]。一系列的峰表明活性炭含有多种官能团,有利于吸附。纯的SAS在1 581 cm-1处有苯环内碳碳双键的吸收峰,在826 cm-1处新峰则是SAS上—SO2—的特征峰。
对比之下,吸附SAS后MBC的红外图谱有两处明显的变化:苯环上碳碳双键特征峰因为与SAS上的杂环相互作用而发生了偏移,从1 623 cm-1偏移到1 600 cm-1。在826 cm-1处的新峰则是SAS上—SO2—的特征峰。除此之外MBC含有的大量含氧基团羟基能与SAS上的氢原子形成了氢键。MBC本身是疏水的,SAS的分子结构中也有疏水基团,疏水作用不可避免地影响着吸附过程。
通过以上分析论述,吸附的主要作用力有氢键、疏水作用和π—π共轭作用。
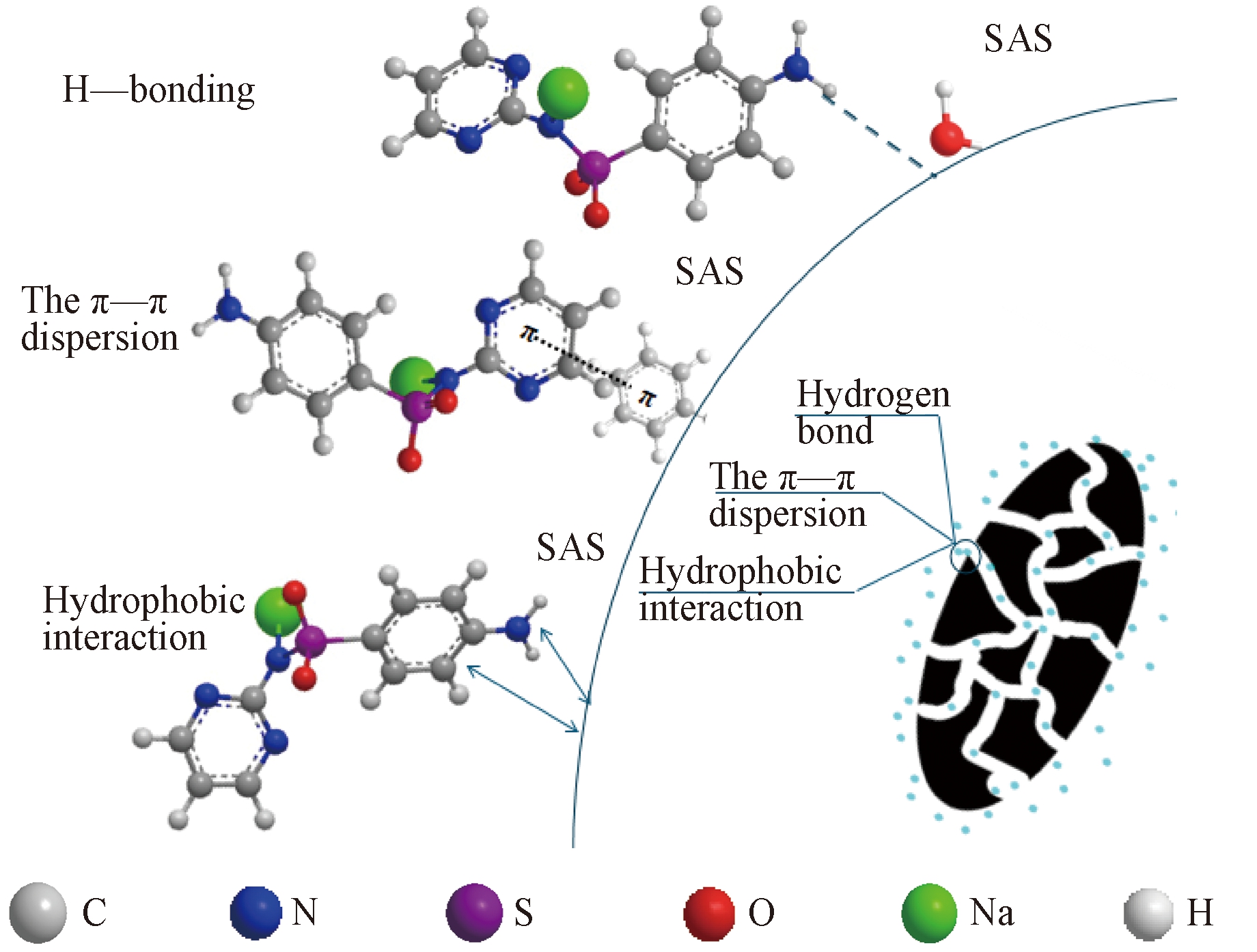
图6 MBC吸附SAS的机理示意图
Figure 6 Schematic illustration of the adsorption mechanism of SAS on MBC
4 结论
采用一步热解制备的生物质磁性活性炭对水体中的磺胺嘧啶钠有良好的吸附效果。吸附过程可以用Freundlich和Koble-Corrigan等温吸附模型来描述,298 K时的最大吸附量为248.4 mg/g。吸附动力学可以用Elovich动力学方程很好地描述。在吸附扩散过程中,粒子内扩散不是唯一的速率控制过程。吸附的主要作用力存在有氢键、疏水作用和π—π电子供体-受体的相互作用。
[1] 张芊芊.中国流域典型新型有机污染物排放量估算、多介质归趋模拟及生态风险评估[D].广州:中国科学院广州地球化学研究所,2015.
[2] 何金华,丘锦荣,贺德春,等.磺胺类药物的环境行为及其控制技术研究进展[J].广东农业科学,2012(7):225-229.
[3] YANG W B,ZHENG F F,XUE X X,et al.Investigation into adsorption mechanisms of sulfonamides onto porous adsorbents[J].Journal of colloid and interface science,2011,362(2):503-509.
[4] 曹慧,陈小珍,朱岩,等.磁性多壁碳纳米管对磺胺类药物的吸附行为[J].新型炭材料,2015,30(6):572-578.
[5] 李雪冰,付浩,林朋飞,等.水中典型磺胺类抗生素的活性炭吸附性质探究[J].给水排水,2016,42(1):36-41.
[6] 邹卫华,符艳真,刘鹏磊,等.改性柚皮对水体中盐酸环丙沙星的动态吸附研究[J].郑州大学学报(工学版),2018,39(6):78-82.
[7] YANG J P,ZHAO Y C,MA S M,et al.Mercury removal by magnetic biochar derived from simultaneous activation and magnetization of sawdust[J].Environmental science &technology,2016,50(21):12040-12047.
[8] LIN L,ZHAI S R,XIAO Z Y,et al.Dye adsorption of mesoporous activated carbons produced from NaOH-pretreated rice husks[J].Bioresource technology,2013,136:437-443.
[9] 邵珍珍,林青,徐绍辉.不同离子强度下SiO2胶体对磺胺嘧啶土壤吸附迁移行为的影响[J].土壤学报,2018,55(2):411-421.
[10] BAYRAMOGLU G,ALTINTAS B,ARICA M Y.Synthesis and characterization of magnetic beads containing aminated fibrous surfaces for removal of reactive green 19 dye:kinetics and thermodynamic parameters[J].Journal of chemical technology &biotechnology,2012,87(5):705-713.
[11] WU F C,TSENG R,JUANG R.Characteristics of Elovich equation used for the analysis of adsorption kinetics in dye-chitosan systems[J].Chemical engineering journal,2009,150(2/3):366-373.
[12] KHAN M Y,MANGRICH A S,SCHULTZ J,et al.Green chemistry preparation of superparamagnetic nanoparticles containing Fe3O4 cores in biochar[J].Journal of analytical &applied pyrolysis,2015,116,42-48.
[13] 吴志坚,刘海宁,张慧芳.离子强度对吸附影响机理的研究进展[J].环境化学,2010,29(6):997-1003.
[14] SUN X M,LI Y D.Colloidal carbon spheres and their core/shell structures with noble-metal nanoparticles[J].Angewandte chemie international edition,2004,43(5):597-601.
[15] KUMAR B,SMITA K,CUMBAL L,et al.Biogenic synthesis of iron oxide nanoparticles for 2-arylbenzimidazole fabrication[J].Journal of saudi chemical society,2014,18(4):364-369