0 引言
甲硫醚、二甲二硫醚和甲硫醇是具有极低嗅觉阈值的恶臭污染物,较低浓度即可引起强烈的不适感.近年来人类生活生产活动的迅速扩张(如垃圾与污水处理厂、化工厂、牲畜养殖场和造纸厂等的建设)产生了过量的恶臭物质,引发了诸多严重的社会、环境和健康问题,因此对恶臭物的监测需求日益迫切.多国对硫系恶臭物的容许排放量有严格的规定.在我国,甲硫醚一级厂界标准值不得高于0.03 mg/m3[1].这种较低的检出限对仪器的性能提出新的挑战.
由于恶臭物化学性质活泼,因此,采用采样带回分析的方式难以确保检测结果准确.而有针对性地检测受排放管控的恶臭物质,确认恶臭物质的组分信息是至关重要的.目前,恶臭物检测手段主要有以气相色谱-质谱(GC-MS)技术为代表的仪器检测[2]和以电子鼻为代表的传感器检测[3-4].GC-MS技术是常用的实验室检测手段,可对混合样品进行定性定量检测.但由于GC分离时间较长,MS需真空工作环境,因此该方法不易实现现场快速检测.以电子鼻为代表的传感器模拟人工嗅辨,可提供恶臭强度信息并作出危害评价,但无法确认恶臭物的成分信息.基于以上现状,亟待研究一种可用于现场检测且提供成分信息的恶臭物质检测方法.
离子迁移谱(ion mobility spectrometer,IMS)仪是根据大气压下不同离子在漂移管中迁移率的差异实现对物质分离检测的一种分析仪器[5].这种分析仪检测灵敏度高、结构相对简单、易于小型化和便携化,被广泛应用于化学战剂、爆炸物、毒品等痕量物质的现场快速检测.IMS技术在混合物质组分分析中也有相关研究报道.Ilibeigi等[6]利用负电晕放电IMS技术实现了对金属盐混合物的成分分析;本实验室的程浩等[7]用自制的IMS仪实现了对敌敌畏、杀扑磷、毒死蜱、对硫磷和辛硫磷等有机磷农药及其混合物的检测.为实现IMS仪的组分分析能力,研究人员通常采用多束毛细管柱(MCC)或气相色谱(GC)同IMS仪联用的方式.有报道利用MCC-IMS对酿酒酵母的挥发性代谢物进行现场检测,分析出的19种物质可用于确定该微生物的代谢阶段[8].GC-IMS检测技术结合模式识别数据处理方式在食品质检中(例如蜂蜜[9]、橄榄油[10]等成分复杂的组分分析)取得较好的检测效果.
近些年出现了将IMS仪应用于恶臭污染物检测的报道.Rudnicka等[11]采用MCC-IMS方法对尿液挥发物进行检测,在优化的系统参数下可以测得甲硫醚、二甲二硫醚等物质;Denawaka等[12]利用GC-IMS技术对长时间穿着衣物的挥发物进行分析,得到了甲硫醚和二甲二硫醚等32种挥发性有机物的谱图.
综上所述,IMS技术是一种谱学检测方法,可对物质进行定性定量检测,并提供混合物质的成分信息.但目前关于IMS技术用于恶臭污染物检测的研究较少,检出限、线性范围、混合样品检测效果等尚鲜见相关报道.笔者提出了一种基于电晕放电离子迁移谱技术的恶臭污染物检测方法,通过优化工作参数来研究常见恶臭污染物单一及混合样品的检测特性,探索CD-IMS技术在恶臭污染物现场检测及成分分析方面应用的可行性.
1 实验部分
1.1 实验装置
CD-IMS系统为实验室自制,结构如图1所示.主要由进样装置、漂移管及辅助设备三部分组成[13].漂移管是IMS系统的主体结构,由离子栅门将其分隔为离化区与漂移区.离化区前端装有聚四氟乙烯圆柱塞,在其内侧固定一单端开口玻璃导管和电晕放电针.塞上开有通孔,用于排出从漂移区末端引入的漂移气.通过玻璃导管引入离化区的样品分子与电晕放电产生的反应离子发生分子-离子反应,生成的产物离子在电场作用下向离子栅门方向漂移,栅门开启后进入漂移区,最终被漂移区末端的法拉第盘接收.该离子流信号被放大并传输至上位机,处理后得到相应的离子迁移谱图.通过观测CD-IMS系统谱图中离子峰的变化来确定待测物的特征离子峰,分析特征离子峰信号强度与样品浓度的关系,计算检出限并标定仪器线性工作区间.
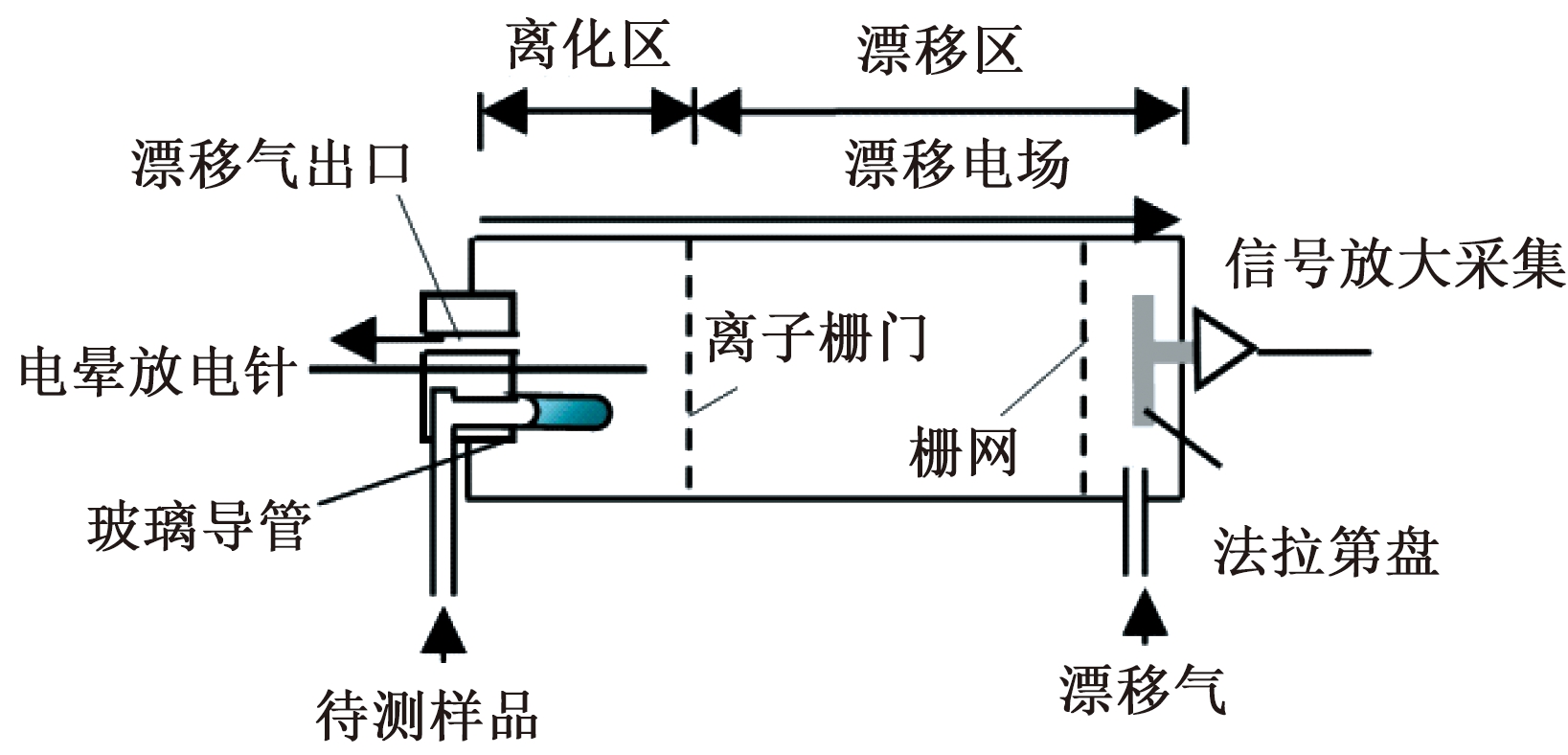
图1 CD-IMS系统结构示意图
Fig.1 Schematic illustration of CD-IMS
CD-IMS系统的主要参数:漂移气流量1 L/min;电晕针尖电压8.9 kV;漂移区长度12.7 cm;漂移区电场强度425 V/cm;离子门开关时间300 μs;载气流量80~300 mL/min;漂移管温度50~200 ℃.
采用如图2所示的配气装置配制待测样品.由于需要配制的气体浓度较低,因此采用标准气体两级稀释法:流量计1用于控制标准气体流量,流量计2用于控制压缩空气流量,两路气体混合实现第一级稀释.通过背压阀的一级稀释气体在流量计4的控制下,同流量计3控制的压缩空气混合,完成对标准气体的第二级稀释.测试实验中,进样流量即为通过流量计3和4的气体流量之和.
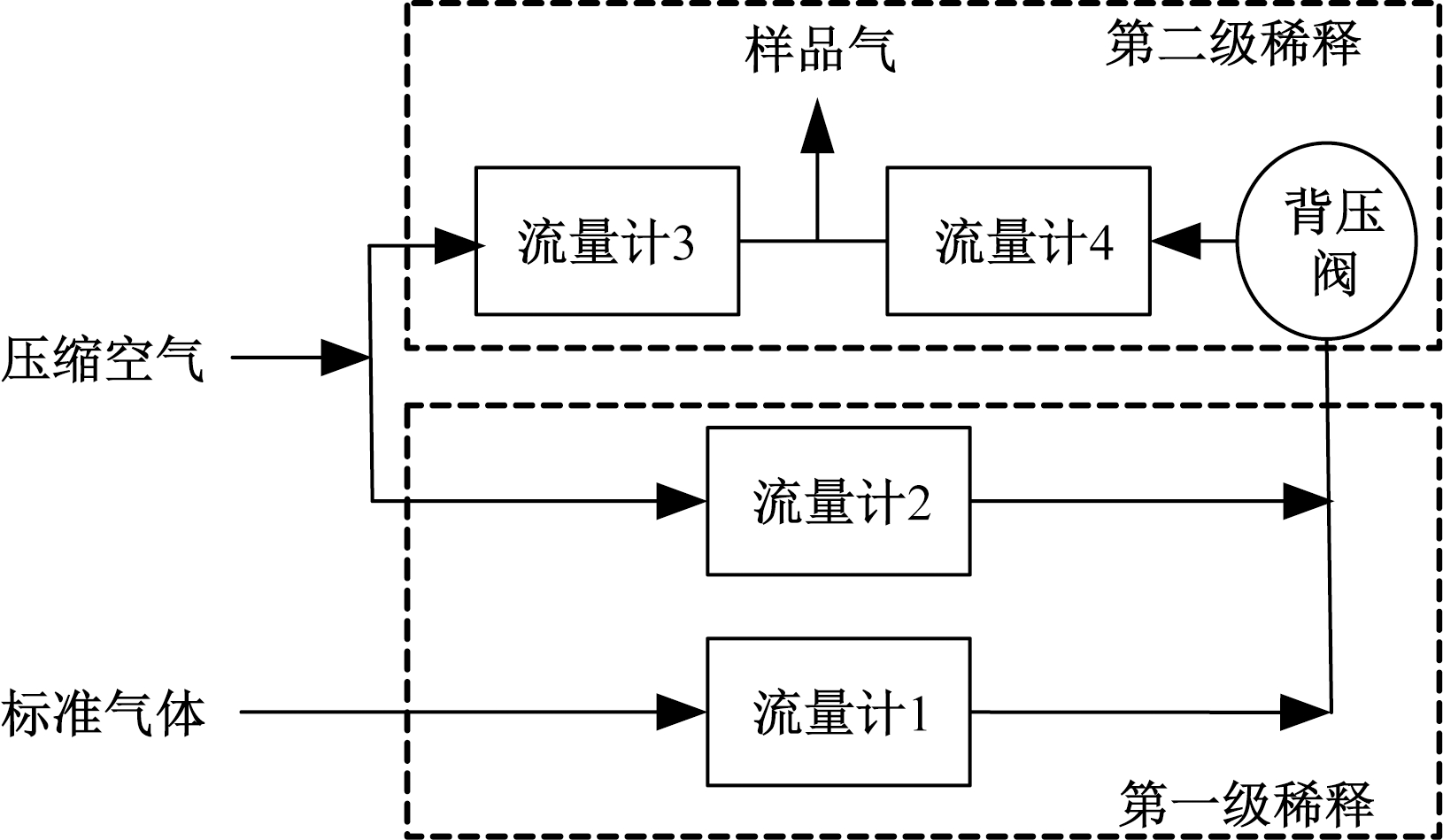
图2 配气装置示意图
Fig.2 Schematic illustration of gas distribution device
1.2 实验试剂
甲硫醚(标准气体,11.2 mg/m3,北京华元气体)、二甲二硫醚(标准气体,10.5 mg/m3,北京华元气体)、甲硫醇(标准气体,33.1 mg/m3,北京华元气体).
2 结果与讨论
2.1 约化迁移率
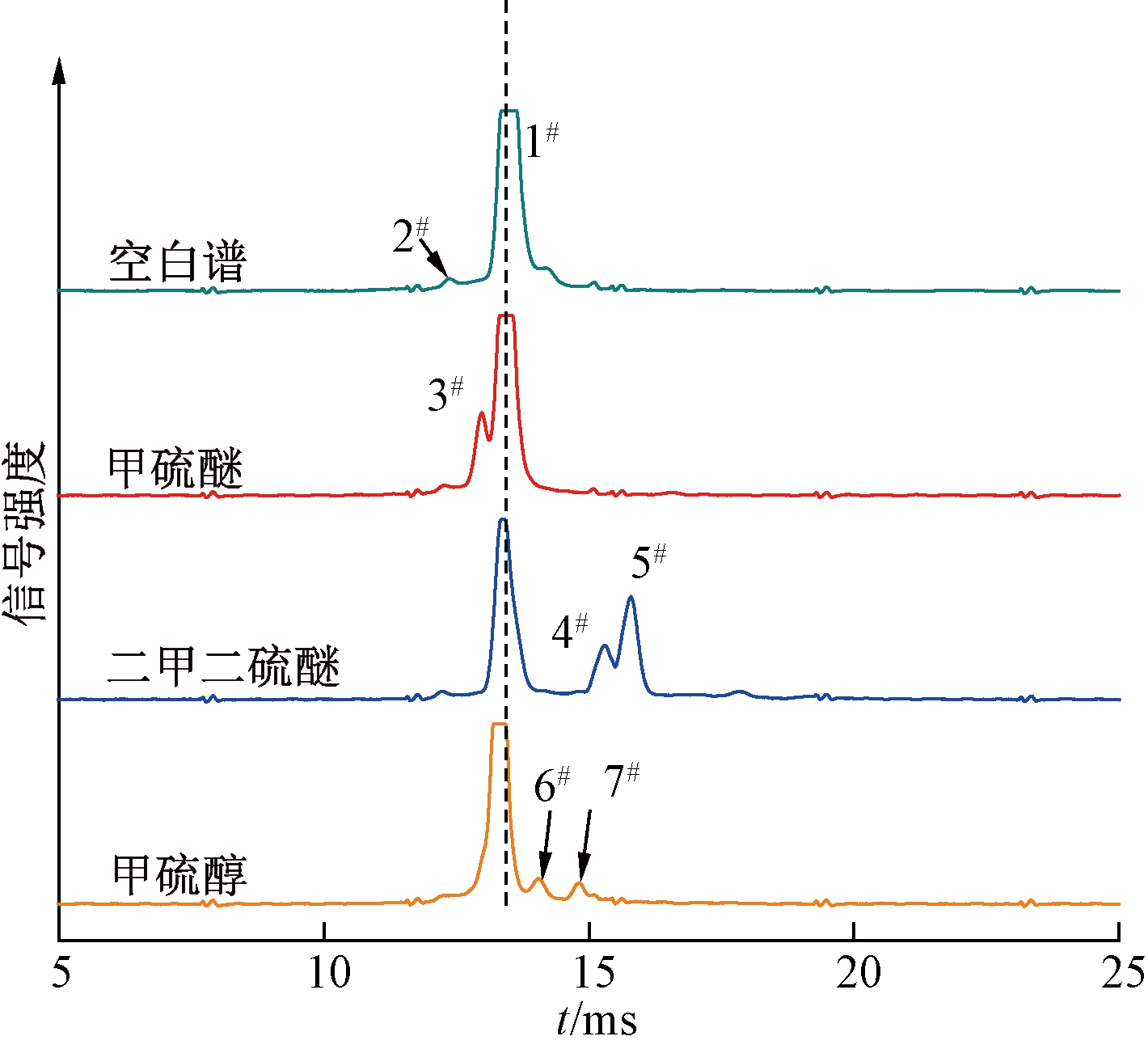
图3 3种恶臭物的CD-IMS系统谱图与空白谱图
Fig.3 CD-IMS spectra of three kinds of malodors and blank
CD-IMS系统的空白谱图及浓度分别为0.045、2.0、1.0 mg/m3的甲硫醚、二甲二硫醚、甲硫醇的样品检测谱图如图3所示.空白谱图中峰1#、2#为反应离子H+(H2O)n和环境杂质(NH4)+(H2O)n,其中,n的数目取决于漂移管温度和漂移气水份含量[14].(NH4)+(H2O)n峰的强度取决于环境中氨的含量及漂移管温度.
通过对比空白谱图与样品谱图,可确认峰3#为甲硫醚的特征离子峰,其漂移时间t为12.89 ms.二甲二硫醚谱图中有两个产物离子峰,测试过程中发现,峰5#的信号强度与浓度的线性关系优于峰4#,因此选择峰5#作为二甲二硫醚的特征离子峰,其漂移时间为15.73 ms.与二甲二硫醚类似,甲硫醇谱图中亦有两个产物离子峰.测试过程发现,峰7#信号强度与浓度的线性关系优于峰6#,所以选择峰7#作为甲硫醇的特征离子峰,其漂移时间为14.74 ms.
为准确计算特征离子的约化迁移率,以约化迁移率受漂移电场、漂移管温度等因素影响很小的四丁基溴化铵[15]作为标定物,通过公式(1)计算出样品特征离子的约化迁移率.
(1)
式中:K与Kstd分别为样品和标定物特征离子的约化迁移率;t与tstd分别为样品和标定物特征离子的漂移时间.四丁基溴化铵的约化迁移率为1.33 cm2/(V·s)[15].经计算,甲硫醚、二甲二硫醚、甲硫醇的约化迁移率分别为2.07、1.70、1.82 cm2/(V·s).
2.2 参数优化
以甲硫醚为例,优化漂移管温度及进样流量.
(1)漂移管温度.3种恶臭物化学性质活泼,不宜高温检测,因此以10 ℃为间隔,在50~100 ℃的范围内寻找合适的漂移管工作温度.图4为甲硫醚样品的检测谱图,进样流量为150 mL/min,样品浓度为0.045 mg/m3.由于迁移率与温度正相关,当漂移管温度升高时,IMS谱峰整体出现左移趋势.
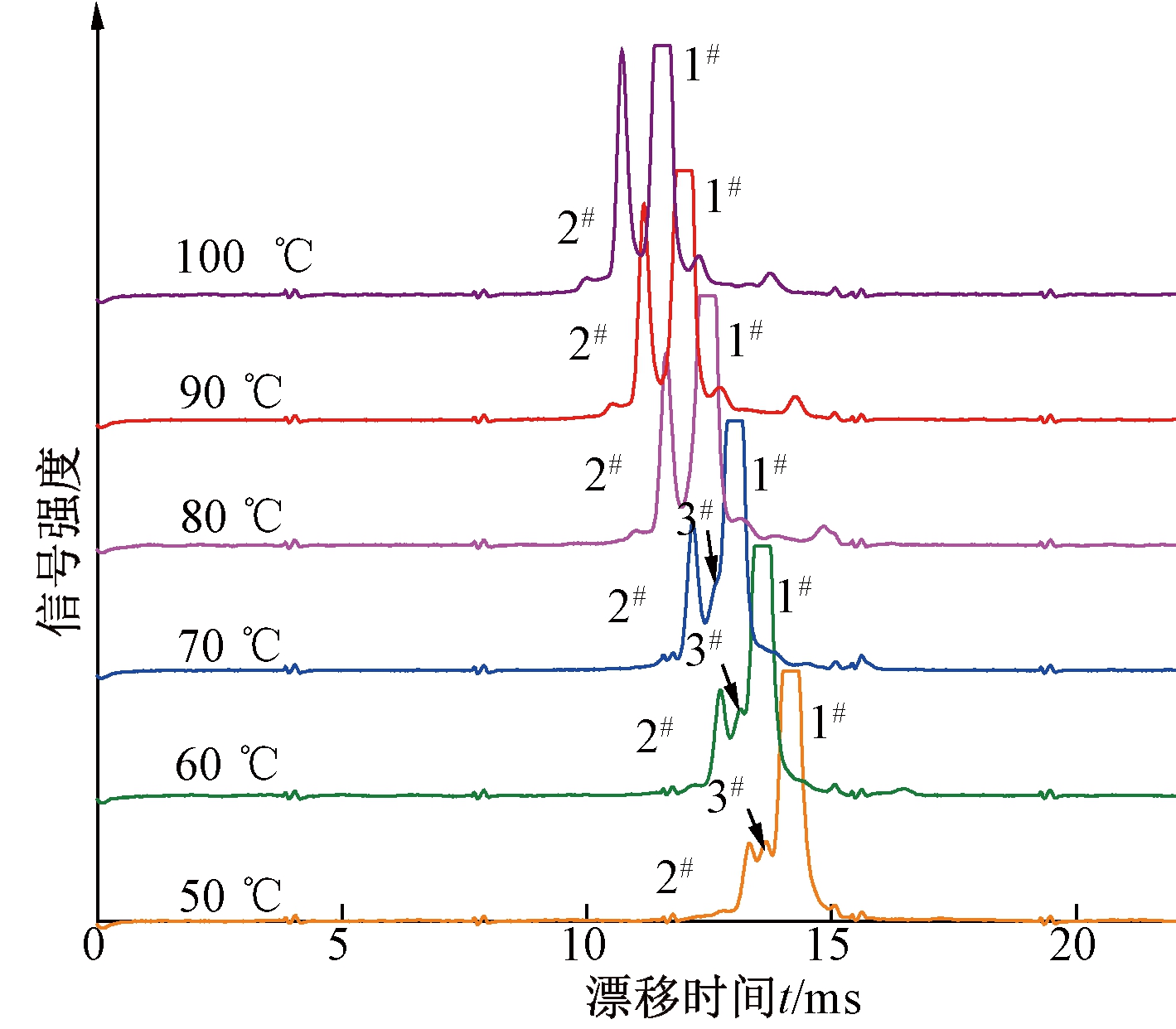
图4 不同漂移管温度下甲硫醚CD-IMS谱图
Fig.4 CD-IMS spectra of dimethyl sulfide at different temperature
漂移管温度为50、60、70 ℃时,谱图中明显可见3个离子峰:峰1#为反应物离子H+(H2O)n;峰2#为(NH4)+(H2O)n;峰3#为甲硫醚的产物离子.对比检测谱图可以看出:峰1#与峰3#有融合趋势.当漂移管温度高于70 ℃时,检测谱图中峰3#消失,出现这一现象的原因可能是漂移气水份含量随温度升高而降低,导致反应物离子峰1#对应的H+(H2O)n中n的数量减小[14],峰1#的位置前移并与产物离子峰3#交叠.漂移管温度分别为50、60 ℃时,产物离子峰的信号强度分别为1.57、1.71.综合考虑反应物离子峰分辨率及强度,漂移管温度可设置为60 ℃.
(2)进样流量.图5为特征峰信号强度-进样流量f的关系曲线.
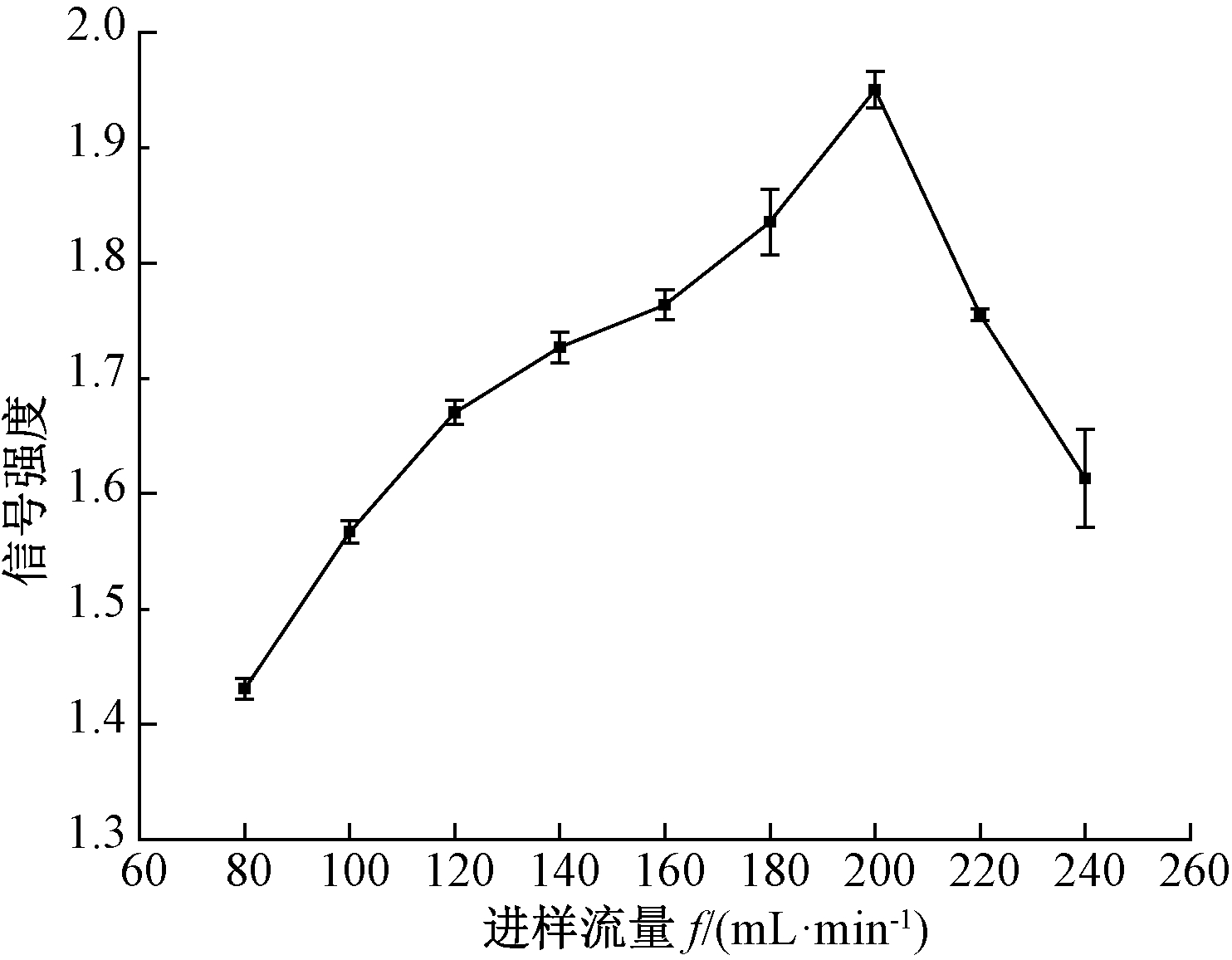
图5 特征峰信号强度-进样流量关系曲线
Fig.5 Relationship between the intensity of characteristic ion peak and the flow rate of sample injection
设定漂移管温度为60 ℃,甲硫醚样品浓度为0.045 mg/m3,研究进样流量对样品检测的影响.当进样流量在80~200 mL/min时,随着进样流量的增大,单位时间内进入离化区的样品量迅速增加,甲硫醚特征离子峰的信号强度逐渐增强.但当进样流量大于200 mL/min时,过大的流速使得样品在离化区停留时间变短,样品电离不充分,离子浓度降低,因此特征峰信号强度迅速减小.同时,实验发现过高的进样流量会导致谱图稳定性变差.综上,进样流量设定为200 mL/min.
2.3 检测结果
2.3.1 单一样品检测
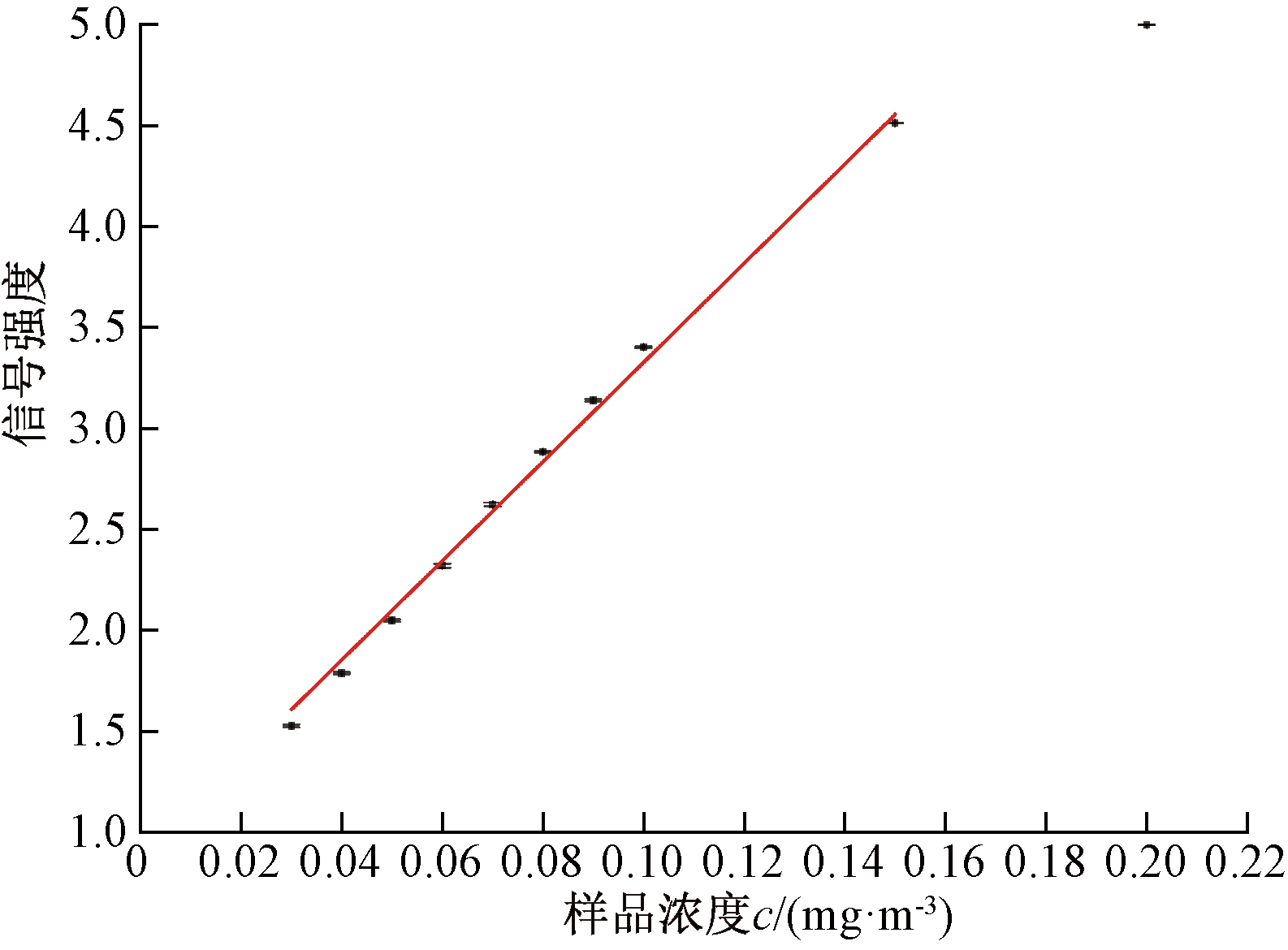
图6 甲硫醚样品特征离子峰信号强度-样品浓度曲线
Fig.6 Characteristic ion peak intensity of dimethyl sulfide as a function of sample concentration
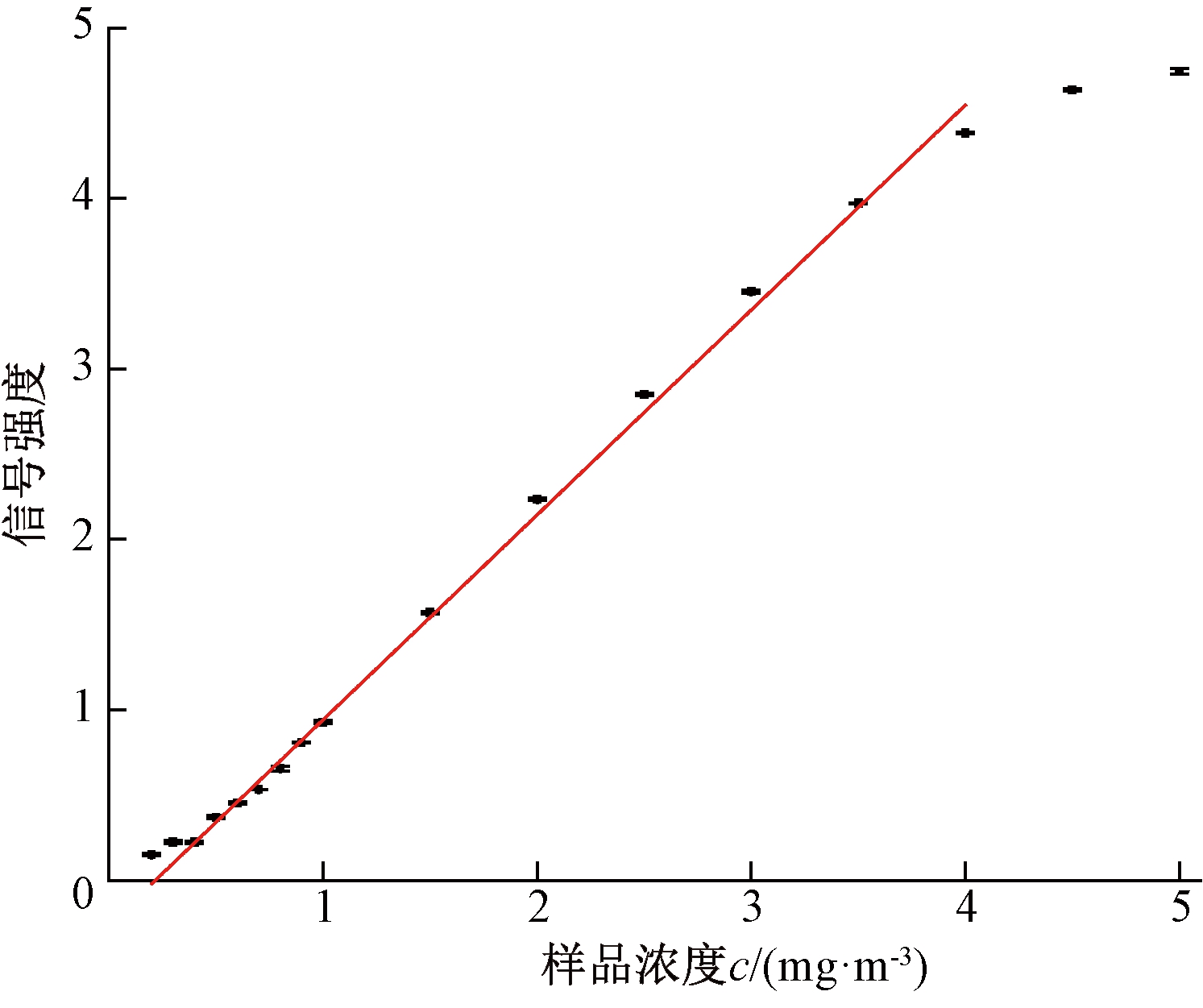
图7 二甲二硫醚特征离子峰信号强度-样品浓度曲线
Fig.7 Characteristic ion peak intensity of dimethyl disulfide as a function of sample concentration
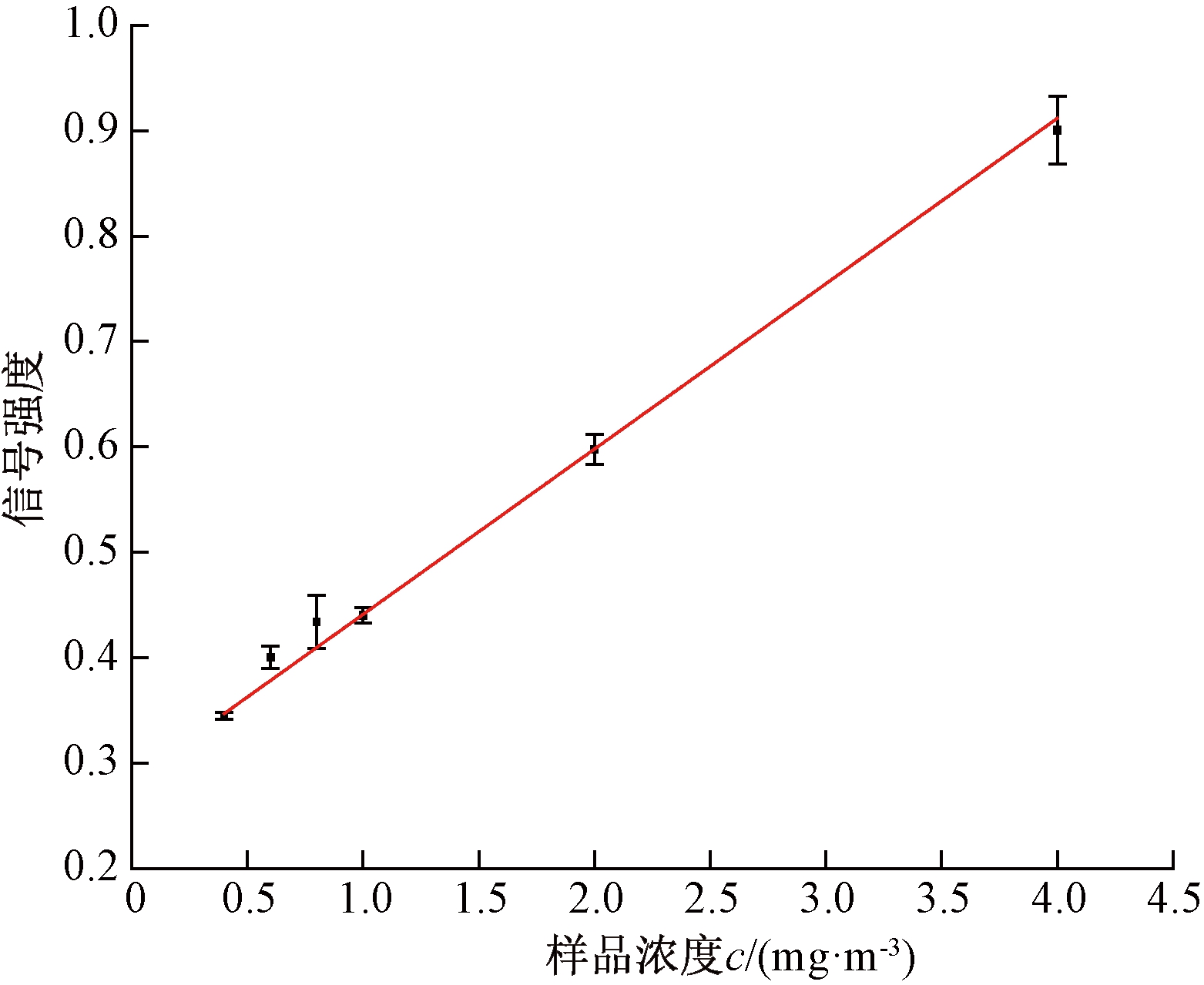
图8 甲硫醇特征离子峰信号强度-样品浓度曲线
Fig.8 Characteristic ion peak intensity of methyl mercaptan as a function of sample concentration
在优化的参数下(漂移管温度60 ℃;进样流量200 mL/min)对不同浓度的甲硫醚、二甲二硫醚和甲硫醇样品进行检测,每个浓度重复测试5次,得到3种物质特征离子峰的信号强度-样品浓度c关系曲线,如图6~8所示.表1列出了3种物质的线性范围、相关系数、恶臭物样品信号强度是仪器基线噪音标准差3倍时的理论检出限和相对标准偏差.甲硫醚、二甲二硫醚和甲硫醇线性范围分别为0.03~0.15、0.2~4.0、0.4~4.0 mg/m3,相对标准偏差分别不大于1.3%、2.0%、2.5%.甲硫醚与二甲二硫醚的理论检出限分别为0.93×10-3 mg/m3和0.019 mg/m3,满足国家标准(GB 14554—93)恶臭污染物厂界标准值的一级要求(0.03 mg/m3),说明CD-IMS对甲硫醚与二甲二硫醚有很好的检测能力.相对于甲硫醚与二甲二硫醚,甲硫醇质子亲和势较低、不易离子化,其理论检出限(0.144 mg/m3)与厂界标准值的一级要求(0.004 mg/m3)差距较大.有报道以硅胶为填料的富集管对甲硫醇的富集倍数可达700[16].因此,后续可采用传统富集法降低系统对甲硫醇的检出限,以满足国家标准要求.
表1 3种恶臭物检测结果
Tab.1 Detection results of dimethyl sulfide, dimethyl disulfide and methyl mercaptan
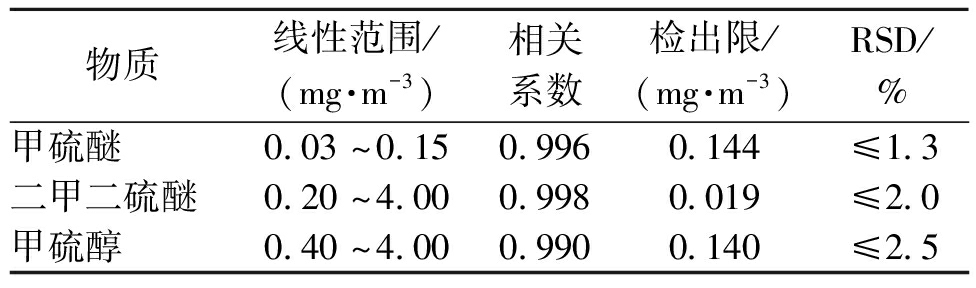
物质线性范围/(mg·m-3)相关系数检出限/(mg·m-3)RSD/%甲硫醚0.03~0.150.9960.144≤1.3二甲二硫醚0.20~4.000.9980.019≤2.0甲硫醇0.40~4.000.9900.140≤2.5
2.3.2 混合样品检测
为验证系统的成分分析能力,对3种恶臭物配制的混合样品进行测试,设计了如表2所示的3因素(3种待测样品)、3水平(3种样品浓度)的正交试验.
结果表明,对于9组不同浓度配比的混合样品,3种恶臭物的特征离子均可被CD-IMS仪检测.图9为正交试验中的一组典型谱图(N=7),谱图中可见峰1#~7#.对比图3可知,峰1#和峰2#分别为反应离子H+(H2O)n和环境杂质(NH4)+(H2O)n;峰3#、峰5#、峰7#与甲硫醚、二甲二硫醚和甲硫醇的特征离子峰一一对应.综上,IMS仪可以实现混合恶臭物的成分分析.
表2 混合样品检测正交试验表
Tab.2 Orthogonal experiment table of mixed sample
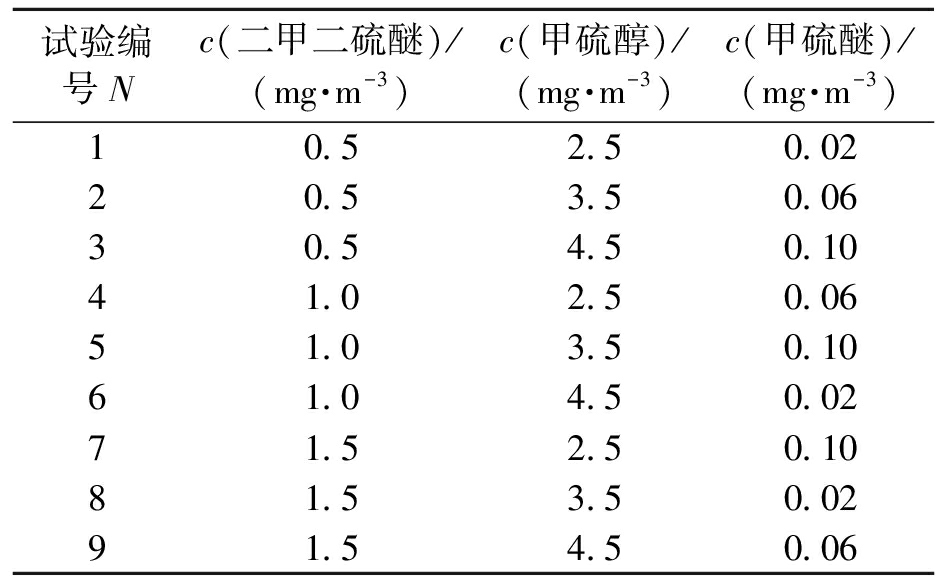
试验编号Nc(二甲二硫醚)/(mg·m-3)c(甲硫醇)/(mg·m-3)c(甲硫醚)/(mg·m-3)10.52.50.0220.53.50.0630.54.50.1041.02.50.0651.03.50.1061.04.50.0271.52.50.1081.53.50.0291.54.50.06
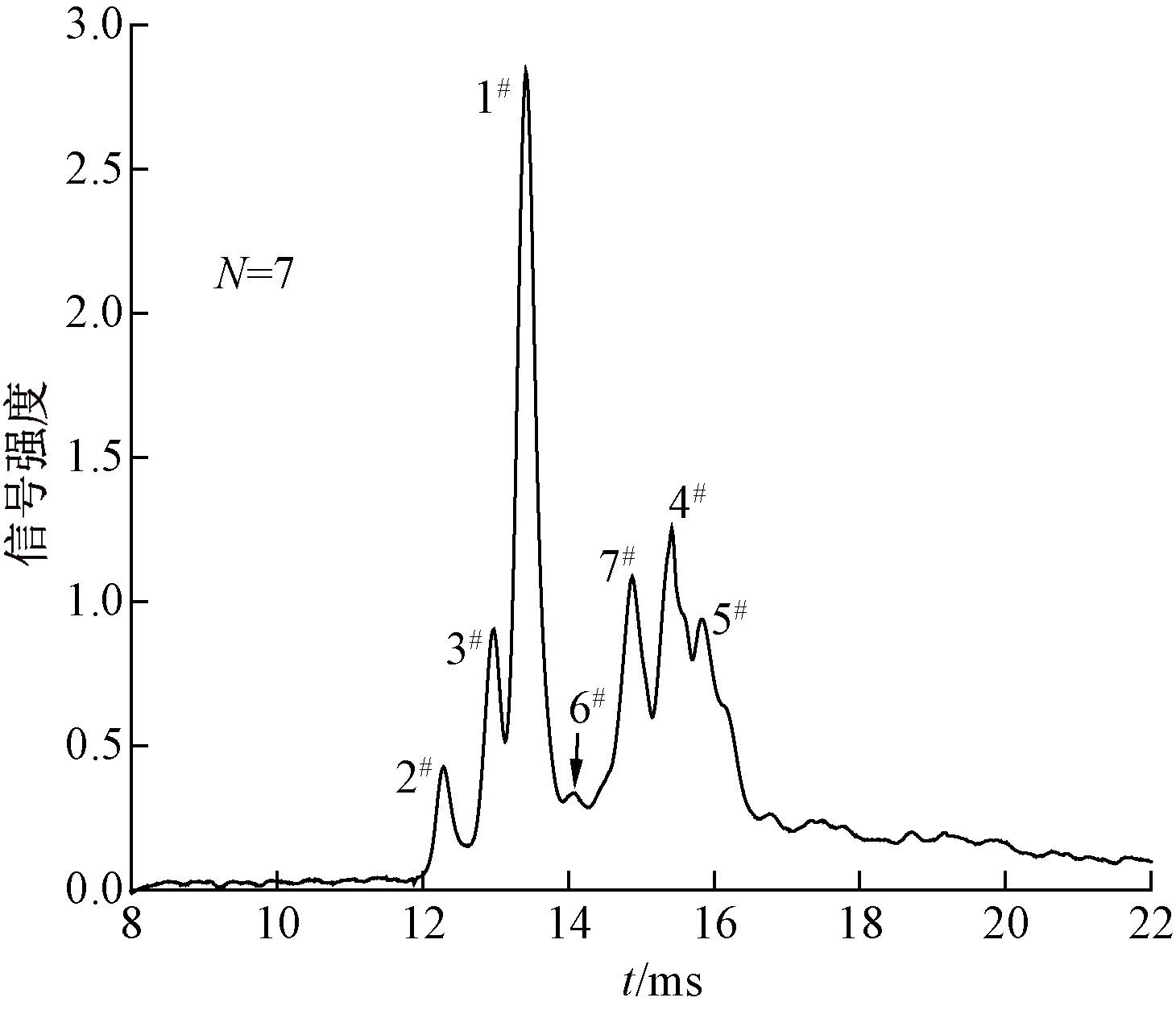
图9 混合样品CD-IMS检测谱图
Fig.9 CD-IMS spectra of mixed sample
恶臭物实际样品检测过程中,氨气等质子亲和势高的物质会影响其定量检测结果.今后将采用多束毛细管柱样品预分离技术排除干扰物的影响,实现恶臭物的现场检测.
3 结论
利用电晕放电离子迁移谱技术,在优化的参数下对甲硫醚、二甲二硫醚和甲硫醇样品进行检测.单一标准品检测结果表明,3种恶臭物线性范围分别为0.03~0.15、0.2~4.0、0.4~4.0 mg/m3时,对应的理论检出限分别为0.93×10-3、0.019、0.144 mg/m3.其中,甲硫醚与二甲二硫醚的理论检出限满足国家规定厂界标准值的一级要求.可以看出,离子迁移谱技术利用特征离子来实现物质的分离检测,是一种很好的定性检测手段.混合样品正交试验表明,搭建的CD-IMS系统可实现混合恶臭物的成分分析,为恶臭污染物的现场检测提供一种可行的选择.
[1] 国家环境保护局.GB 14554—93 恶臭污染物排放标准[S].北京:中国标准出版社, 1994.
[2] 芦会杰.典型生活垃圾处理设施恶臭排放特征及污染评价[J].环境科学, 2017, 38(8): 3178-3184.
[3] 刘伟玲,杨彩双,冉多钢,等.基于传感器阵列的恶臭气体检测[J].仪表技术与传感器, 2017(2): 66-69.
[4] 胡校兵,谢祯芳,谢骥,等.水热合成微纳米CuO及在气体传感器中的应用[J].郑州大学学报(工学版), 2016, 37(6): 10-14.
[5] EICEMAN G A, KARPAS Z.离子迁移谱[M].郭成海,曹树亚,译.北京:国防工业出版社, 2010.
[6] ILBEIGI V, VALADBEIGI Y, TABRIZCHI M.Ion mobility spectrometry of heavy metals[J].Analytical chemistry, 2016, 88(14): 7324-7328.
[7] 程浩, 高晓光, 贾建, 等.用于水中有机磷农药检测的离子迁移率谱仪预富集进样方法[J].分析化学, 2010,38(11): 1683-1686.
[8] HALBFELD C, EBERT B E, BLANK L M.Multi-capillary column-ion mobility spectrometry of volatile metabolites emitted by saccharomyces cerevisiae[J].Metabolites, 2014,4(3): 751-774.
[9] GERHARDT N, BIRKENMEIER M, SCHWOLOW S, et al.Volatile-compound fingerprinting by headspace-gas-chromatography ion-mobility spectrometry (HS-GC-IMS)as a benchtop alternative to 1H NMR profiling for assessment of the authenticity of honey[J].Analytical chemistry, 2018,90(3): 1777-1785.
[10] GERHARDT N, BIRKENMEIER M, SANDERS D, et al.Resolution-optimized headspace gas chromatography-ion mobility spectrometry (HS-GC-IMS)for non-targeted olive oil profiling[J].Analytical and bioanalytical chemistry, 2017,409(16): 3933-3942.
[11] RUDNICKA J, MOCHALSKI P, AGAPIOU A, et al.Application of ion mobility spectrometry for the dete-ction of human urine[J].Analytical and bioanalytical chemistry, 2010,398(5): 2031-2038.
[12] DENAWAKA C J, FOWLIS I A, DEAN J R.Evaluation and application of static headspace-multicapillary column-gas chromatography-ion mobility spectrom-etry for complex sample analysis[J].Journal of chromatography A, 2014,138(8): 136-148.
[13] 王瑾香, 高晓光, 贾建,等.固相微萃取-离子迁移率谱快速检测茶饮料中痕量敌敌畏[J].分析化学, 2015, 43(8): 1193-1197.
[14] PUTON J, NOUSIAINEN M, SILLANP
 M.Ion mobility spectrometers with doped gases[J].Talanta, 2008, 76(5):978-987.
M.Ion mobility spectrometers with doped gases[J].Talanta, 2008, 76(5):978-987.
[15] VIIDANOJA J, SYSOEV A, ADAMOV A, et al.Tetraalkylammonium halides as chemical standards for positive electrospray ionization with ion mobility spectrometry-mass spectrometry[J].Rapid communications in mass spectrometry, 2005, 19(21):3051-3055.
[16] KUDRYAVTSEV A S, MAKAS A L, TROSHKOV M L, et al.The method for on-site determination of trace concentrations of methyl mercaptan and dimethyl sulfide in air using a mobile mass spectrometer with atmospheric pressure chemical ionization, combined with a fast enrichment/separation system[J].Talanta, 2014,123: 140-145.