0 引言
原花青素(Proanthocyanidins,PC)是一种抗氧化剂[1].经研究发现,其是目前世界上清除人体自由基最有效的天然产物,大量存在于植物的种子、花和皮等部位中,在医药、保健品、化妆品领域应用广泛.莲房含有丰富的原花青素,如提取,可变废为宝[2].原花青素按聚合度划分,分为低聚体(平均聚合度≤4)和高聚体(平均聚合度>4).低聚体的抗氧化活性远远高于高聚体,故高聚体降解为低聚体的研究成为热点[3].
目前,原花青素的催化降解方法主要有氢化降解法、微生物降解法、化学降解法等.氢化降解法设备昂贵、反应条件苛刻、操作相对复杂,但降解率高;微生物降解法设备简单低廉、操作简便、零二次污染,但合适的微生物难寻,且难培养;化学降解法因设备低廉、操作简便、降解率高等优点已引起国内外研究者的广泛关注,故本研究选用化学降解法.化学降解法主要为酸降解法,Luo等[4]采用亚硫酸作为酸降解剂,将葡萄籽及皮中原花青素降解为低聚体;赵平等[5]同样采用亚硫酸作为酸降解剂,将原花青素的平均聚合度从7.06降到4.30.
考虑到实际应用中,涉及领域对物质的纯度要求极其高,所以必须保证降解产物的纯度达到一定的标准.酸降解剂参与降解反应后,不易进行分离,这势必会影响产物的纯度和后续应用,故笔者在文献[6-7]的基础上首次提出采用固体酸作为催化剂降解高聚体原花青素.
1 试验方案
1.1 试验原材料
新鲜莲房,市售;蒸馏水,实验中心自制;儿茶素,98%,郑州希派克科技有限公司;乙醇、冰乙酸,天津市风船化学试剂科技有限公司,AR;乙酸乙酯、甲醇、浓盐酸,天津市科密欧化学试剂有限公司,AR;硫酸,烟台市双双化工有限公司,AR;芳草醛,阿拉丁工业公司,AR;1#、2# TiO2,玛雅试剂有限公司(1、2号分别指100 nm TiO2、P25TiO2).
1.2 试验仪器
电子天平,北京赛多利斯仪器系统有限公司;集热式恒温加热磁力搅拌器,郑州市中原科技玻璃仪器厂;飞鸽牌离心机,上海安亭科技仪器厂;电热鼓风干燥箱,上海一恒科学仪器有限公司;真空干燥箱,上海精宏实验设备有限公司;旋转蒸发器,上海亚荣生化仪器厂;循环水式多用真空泵,巩义市英峪华科仪器厂;马弗炉,上海黔通仪器科技有限公司;UV-1800紫外可见分光光度计,岛津企业管理有限公司;WQF-510傅里叶变换红外光谱仪,北京瑞利分析仪器厂;ASAP 2 460比表面积及孔隙分析仪,美国Micromeritics有限公司;Agilent 1 100凝胶渗透色谱,安捷伦科技有限公司.
1.3 试验内容
1.3.1 莲房高聚体原花青素的提取
将干燥的新鲜莲房粉碎,并过粒径为0.15 mm筛子得莲房粉末.将莲房粉浸渍于石油醚中,料液比为4∶15 (g/mL),脱脂24 h.脱脂后,于通风处自然风干.采用溶剂法提取原花青素.提取剂为60%的乙醇溶液,料液比为1∶15 (g/mL),50 ℃下浸提60 min.提取液于10 000 r/min转速下离心,上清液在45 ℃下旋转蒸发以回收乙醇,得到原花青素粗提液[8].然后用乙酸乙酯3次萃取分级,水相即为高聚体原花青素悬浮液.将其稀释10倍作为降解原料.
1.3.2 固体酸的筛选及制备
筛选4种酸溶液和2种固体载体,确定采用降解性能好的H2SO4溶液和吸附性能佳的纳米级TiO2[9].分别取5 g 1#、2# TiO2,配置1、2、3 mol/L的硫酸溶液各10 mL/g.浸渍沉淀法分别浸渍1 h[10].抽滤后,滤饼于真空干燥箱在90 ℃下烘24 h,取出研碎,过粒径为0.15 mm筛子.再置于400 ℃的马弗炉中活化3 h,制备出的固体酸冷却后待用.
1.3.3 固体酸降解反应实验
取10 mL降解原液,加入一定量的SO42-/TiO2固体酸催化剂,放入一定温度的水浴锅内,降解反应一定时间.取出后过滤固体酸并冷却液体至室温,测定原花青素的平均聚合度及降解率.
平均聚合度采用魏冠红(2006年)的改良香草醛法测定[11].当采用乙酸作为溶剂时,香草醛只与末端黄烷-3-醇发生缩合反应,从而可以确定原花青素的摩尔量.当采用甲醇作为溶剂时,香草醛可以与所有酚羟基发生反应,从而可以确定原花青素的质量.二者结合即可求出原花青素的平均聚合度.
1.4 聚合度及降解率的计算
原花青素的平均聚合度可通过公式(1)计算;原花青素的降解率可通过公式(2)计算:
(1)
式中:DP为平均聚合度;m为原花青素的质量浓度,μg/mL;n为原花青素的摩尔浓度,μmol/mL;M为儿茶素的摩尔质量,290.27 g/mol.
降解率![]()
(2)
式中:DP1为降解前的平均聚合度;DP2为降解后的平均聚合度.
1.5 工艺优化试验
在单因素实验的基础上设计正交试验,以找出最优降解反应条件.
1.6 表征
通过FT-IR、BET分析来表征SO42-/TiO2固体酸的性能;通过降解原料与降解产物的紫外光谱及凝胶色谱对比分析来验证降解反应效果.
2 分析与讨论
考察载体TiO2颗粒大小、固体酸用量、反应温度、反应时间对高聚体原花青素降解效果的影响.
2.1 固体酸降解反应工艺
2.1.1 单因素实验
(1)TiO2颗粒大小对降解反应的影响.采用不同粒度TiO2(1#及2#纳米级TiO2)作载体,制备1 mol/L SO42-/TiO2,在适宜条件下做降解实验.
保持温度80 ℃,时间60 min的反应条件不变.1# TiO2作载体制备的固体酸的加入量选择0.1、0.15、0.2、0.25、0.3、0.35 g;2# TiO2作载体制备的固体酸的加入量选择0.01、0.02、0.03、0.04、0.05、0.06 g·/(10 mL),所得结果如图1所示.
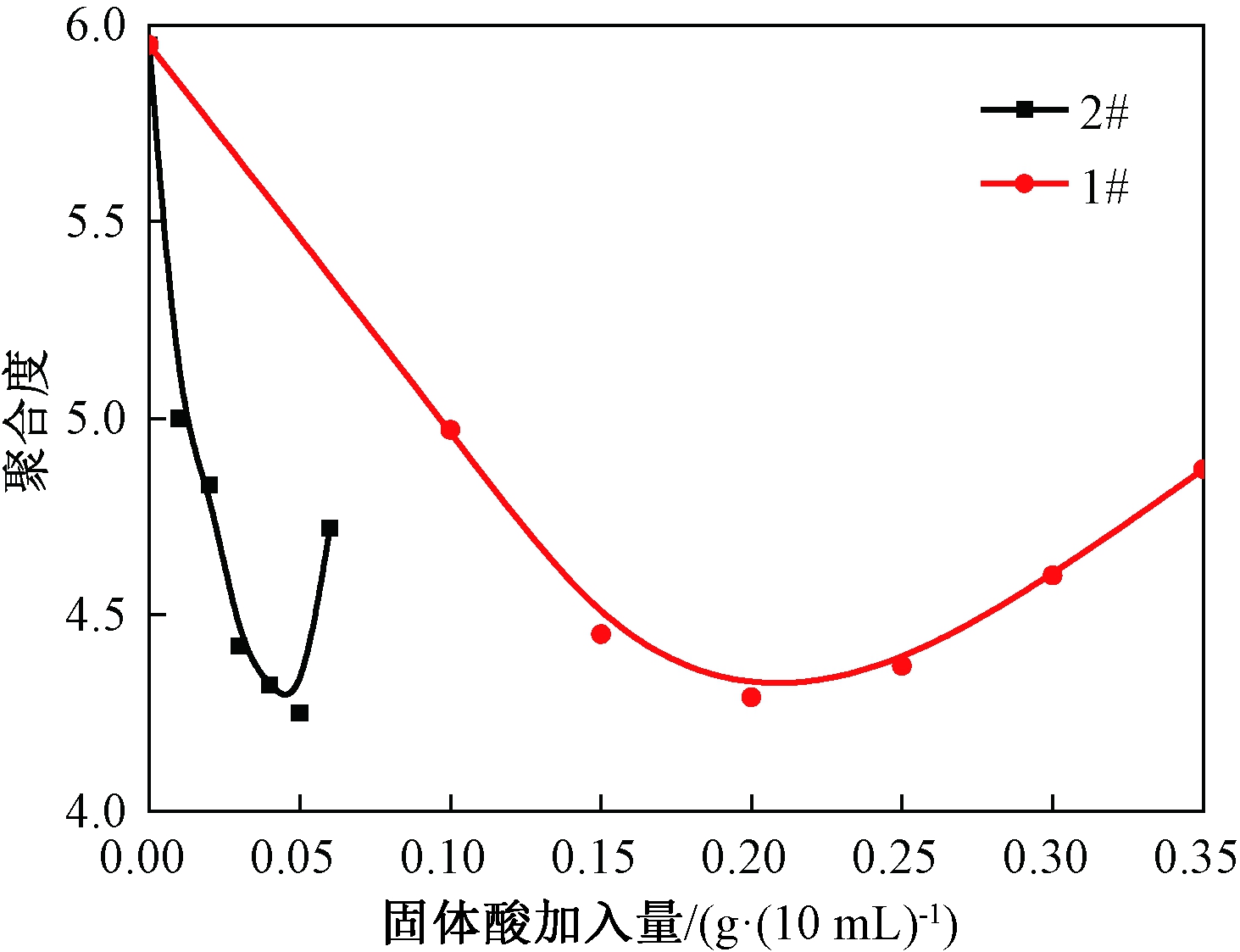
图1 TiO2颗粒大小对聚合度的影响
Fig.1 TiO2 particle size impacts on polymeric degree
载体粒度的大小直接影响着改性催化剂性能的好坏.由图1可以看出:当聚合度降为4.25时,1# TiO2作载体的催化剂消耗0.2 g,2# TiO2作载体制备的催化剂需0.05 g.达到相同的降解效果,粒径较小的2# TiO2作载体制备的催化剂用量少得多.故以下实验中催化剂用量、反应温度、反应时间对降解效果的研究,均采用2# TiO2制备的固体酸.
(2)H2SO4浓度及酸用量对降解反应的影响.保持温度80 ℃,时间60 min的反应条件不变,采用不同浓度(1、2、3 mol/L)H2SO4制备的SO42-/TiO2固体酸,加入量均为0.01、0.02、0.03、0.04、0.05、0.06 g·(10 mL)-1,所得结果见图2和图3.
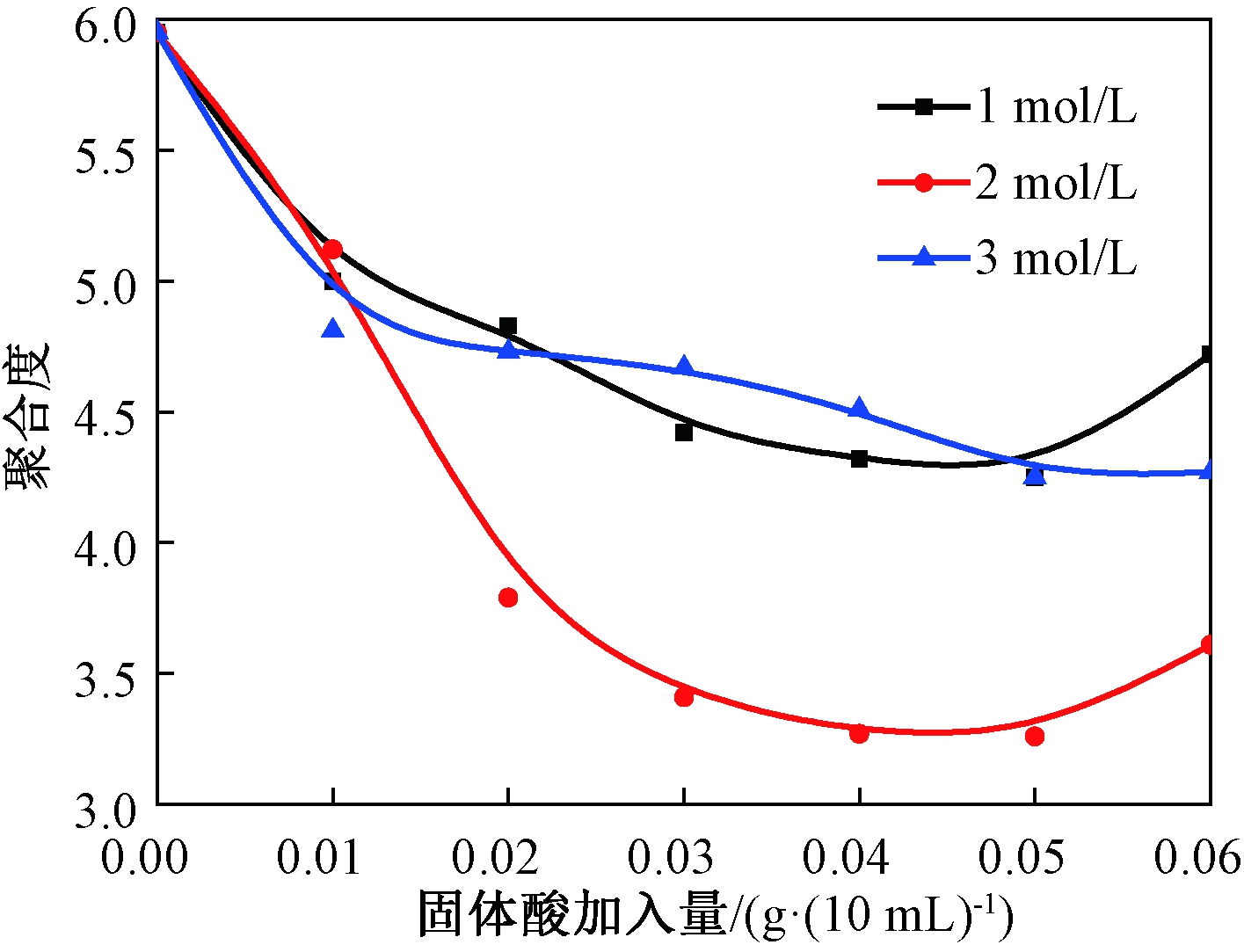
图2 固体酸加入量对聚合度的影响
Fig.2 Solid acid addition impacts on polymeric degree
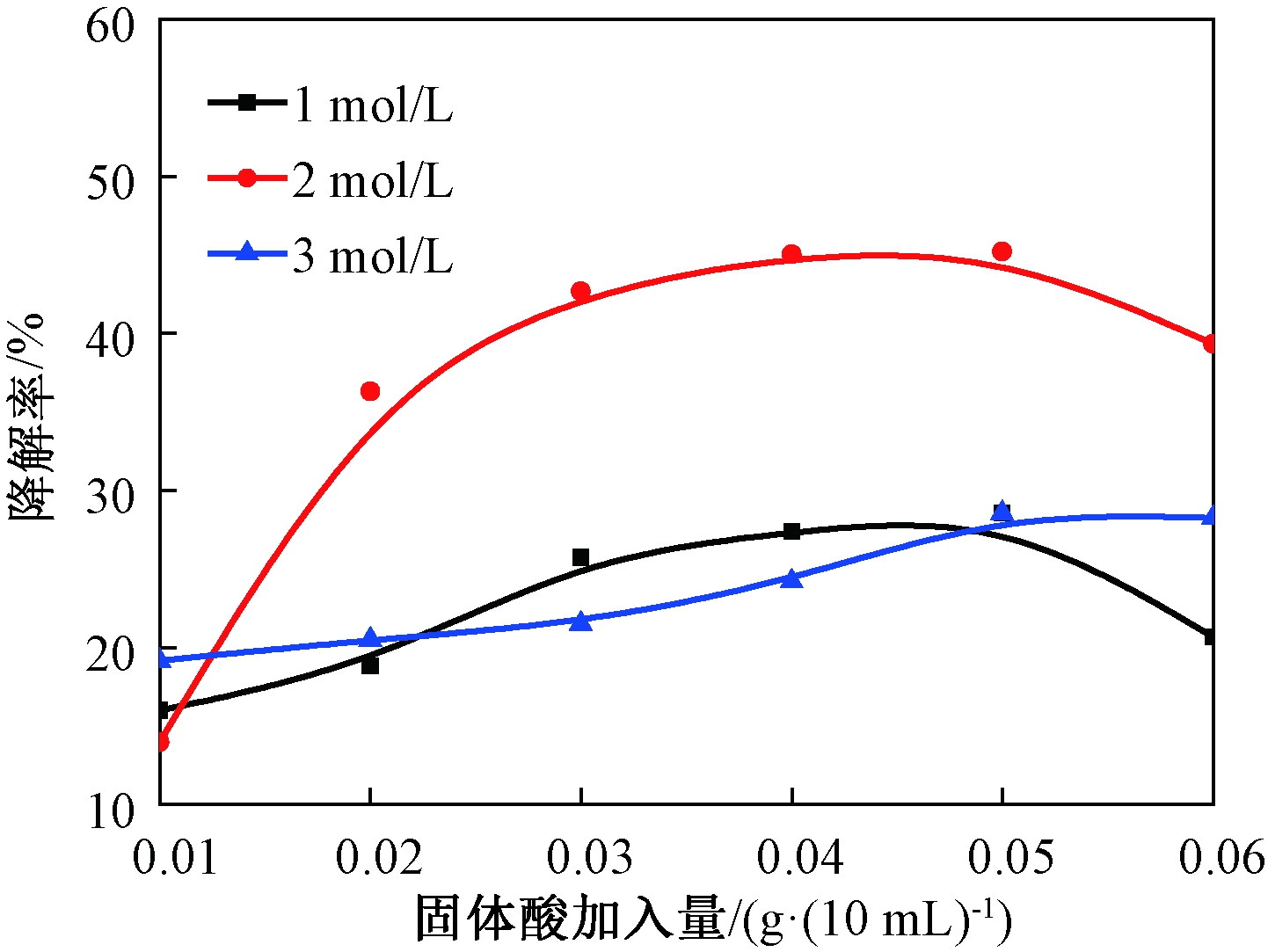
图3 固体酸加入量对降解率的影响
Fig.3 Solid acid addition impacts on degradation rate
由图2、图3可以看出:一定范围内,随着固体酸加入量的增加,聚合度先降低后升高,降解率先升高后下降.1、2、3 mol/L的SO42-/TiO2固体酸均有降解作用,但是其中2 mol/L SO42-/TiO2固体酸的降解效果最佳.当硫酸浓度为2 mol/L时,固体酸的加入量为0.04 g·(10 mL)-1,聚合度从5.95降为3.26,降解率达到45.21%.故考虑温度和时间对降解反应的影响时,只对2 mol/L硫酸制得的固体酸做讨论.
(3)温度对降解反应的影响.保持固体酸加入量0.04 g、时间60 min的条件不变,采用不同的反应温度,即50、60、70、80、90 ℃,所得结果见图4.
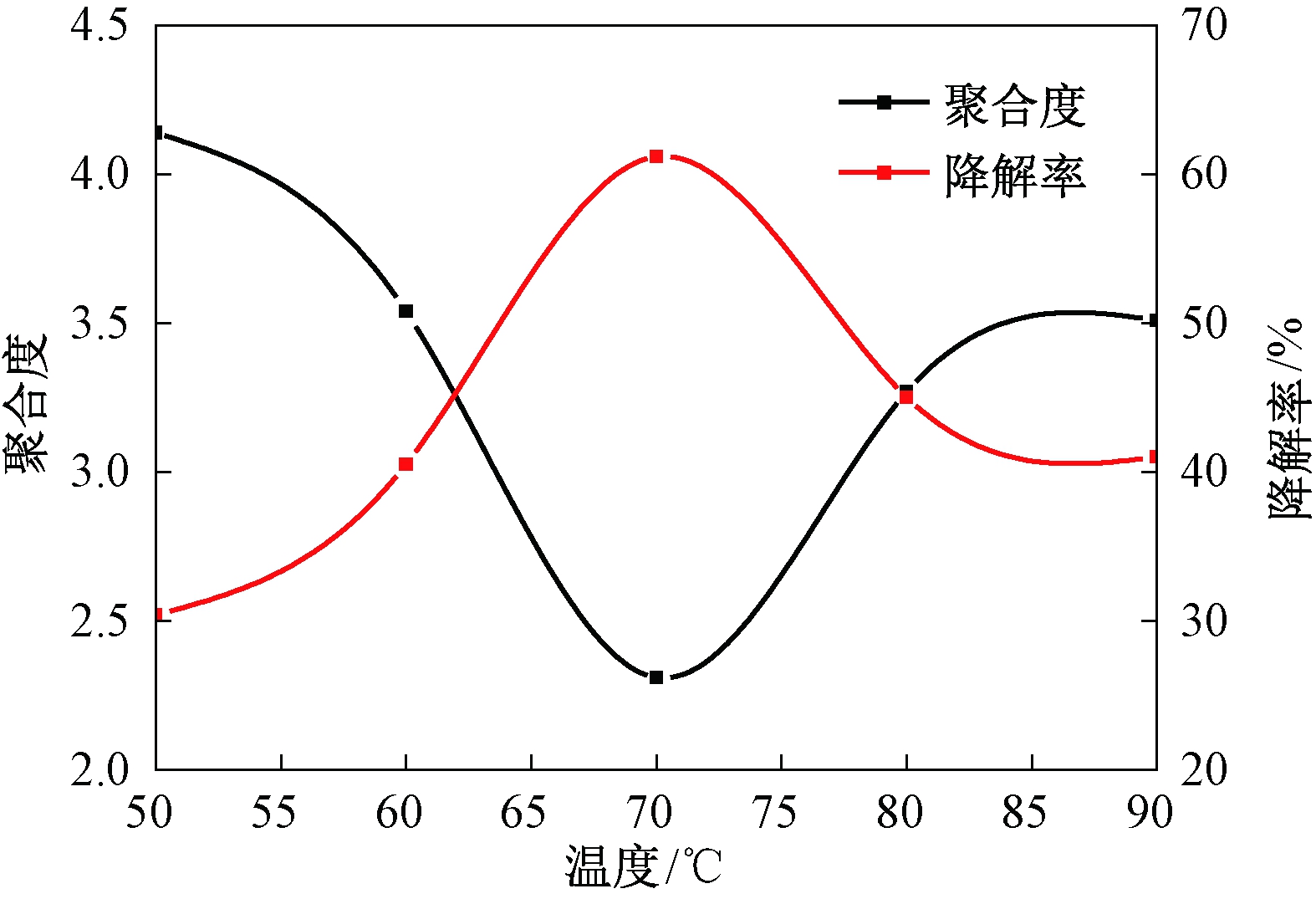
图4 温度对聚合度及降解率的影响
Fig.4 Temperature impacts on polymeric degree and rate
反应温度的高低直接影响反应活化能的大小,进而影响降解反应效果.由图4可以看出:一定范围内,随着温度的不断升高,聚合度先减小后增大,降解率先增加后减小.温度为70 ℃时,聚合度降为2.31,降解率达到61.18%.温度较低时,高聚体很难将C4—C8键断开,故聚合度较高,降解率较低;温度过高时,低聚体的羟基基团很容易被氧化,从而失去原有的活性,这与上述的实验结果是相符的.
(4)时间对降解反应的影响.保持固体酸加入量为0.04 g·(10 mL)-1,温度为70 ℃的条件不变,采取不同的反应时间,即40、50、60、70、80 min,所得结果如图5.
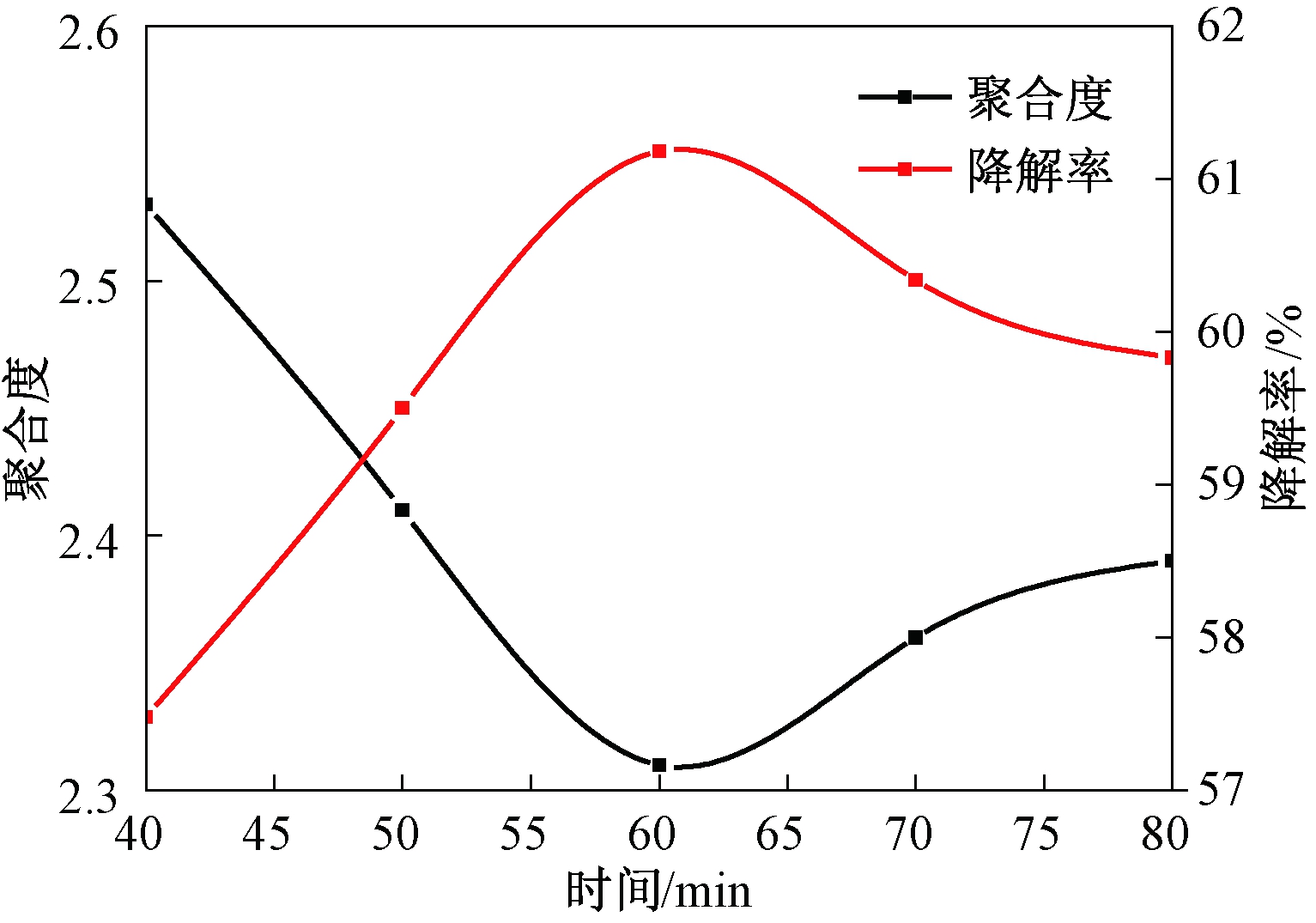
图5 时间对聚合度及降解率的影响
Fig.5 Time impacts on polymeric degree and rate
由图5可以看出:当时间为40~60 min时,聚合度明显减小;当时间为60~80 min时,聚合度增大,但较为缓慢.反应时间过长,聚合度反而升高,降解率反而降低.原因可能是降解后的低聚体原花青素随时间增加又发生了裂解,生成了别的产物.当时间为60 min时,聚合度降为2.31,降解率达到61.18%.
2.1.2 正交实验
依据单因素实验的结果,以SO42-/TiO2固体酸加入量、降解温度及降解时间为变量因素,设计正交实验,以考察上述条件对莲房原花青素降解反应的综合影响.设计的正交实验水平因素表见表1,正交实验结果表见表2.
表1 正交实验L9(34)水平因素表
Tab.1 Horizontal factor table of orthogonal experiment

水平ABC酸用量/(g·(10 mL)-1)温度T/℃时间t/min10.04605020.05706030.068070
表2 正交实验L9(34)结果
Tab.2 Results of orthogonal experiment
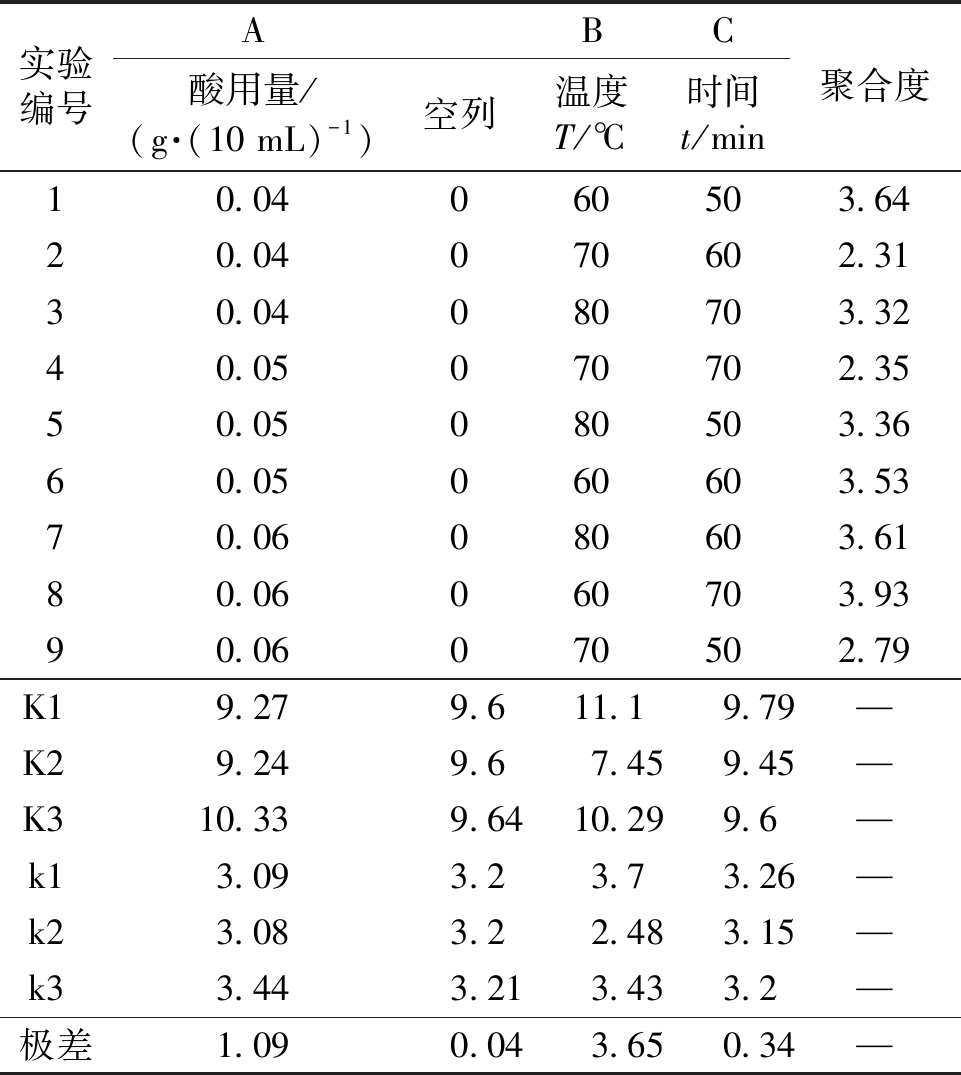
实验编号ABC酸用量/(g·(10 mL)-1)空列温度T/℃时间t/min聚合度10.04060503.6420.04070602.3130.04080703.3240.05070702.3550.05080503.3660.05060603.5370.06080603.6180.06060703.9390.06070502.79K19.279.611.19.79—K29.249.67.459.45—K310.339.6410.299.6—k13.093.23.73.26—k23.083.22.483.15—k33.443.213.433.2—极差1.090.043.650.34—
由正交实验结果的极差分析可得因素的影响大小顺序为:B>A>C,即温度>酸用量>时间.其中,最佳方案为A1B2C2,即固体酸用量为0.04 g·(10 mL)-1,温度为70 ℃,时间为60 min.在该反应条件下,高聚体聚合度可以从5.95降为2.31.由于空白列的极差较小,所以表明本次正交实验没有遗漏掉其他主要参考因素.
2.1.3 验证试验
固体酸用量0.04 g·(10 mL)-1为边界条件,故需做验证试验.设计酸用量0.03 g·(10 mL)-1,温度70 ℃,时间60 min的实验方案进行降解实验,结果见表3.由表3可知:酸用量0.04 g·(10 mL)-1时,降解效果最佳.综上所述,固体酸降解莲房高聚体原花青素的最佳工艺条件为:催化剂选择2号TiO2负载2 mol/L H2SO4制备SO42-/TiO2,酸用量0.04 g·(10 mL)-1,温度70 ℃,时间60 min,原花青素聚合度从5.95降为2.31,降解反应效果最好.
表3 验证试验结果
Tab.3 Results of verification test
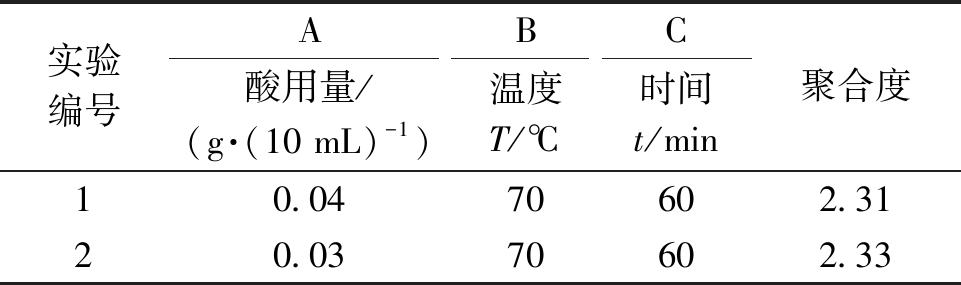
实验编号ABC酸用量/(g·(10 mL)-1)温度T/℃时间t/min聚合度10.0470602.3120.0370602.33
2.2 固体催化剂的表征
2.2.1 FT-IR分析
SO42-负载在TiO2上面,结合力有无机螯合状双配位、共价硫酸盐、桥式配位.红外光谱如图6所示.由图6看出:1、2、3 mol/L SO42-/TiO2固体酸的1 413.57、1 413.57、1 552.42 cm-1处的反对称伸缩振动吸收峰属于共价键性质的S—O键,即共价硫酸盐吸附.而对于对称伸缩振动吸收峰,941.09、985.45、987.38 cm-1的吸收带属于共价硫酸盐吸附,889.02、881.31 cm-1的吸收带属于螯合式吸附.与纯TiO2红外图对比,SO42-已负载在TiO2上面.
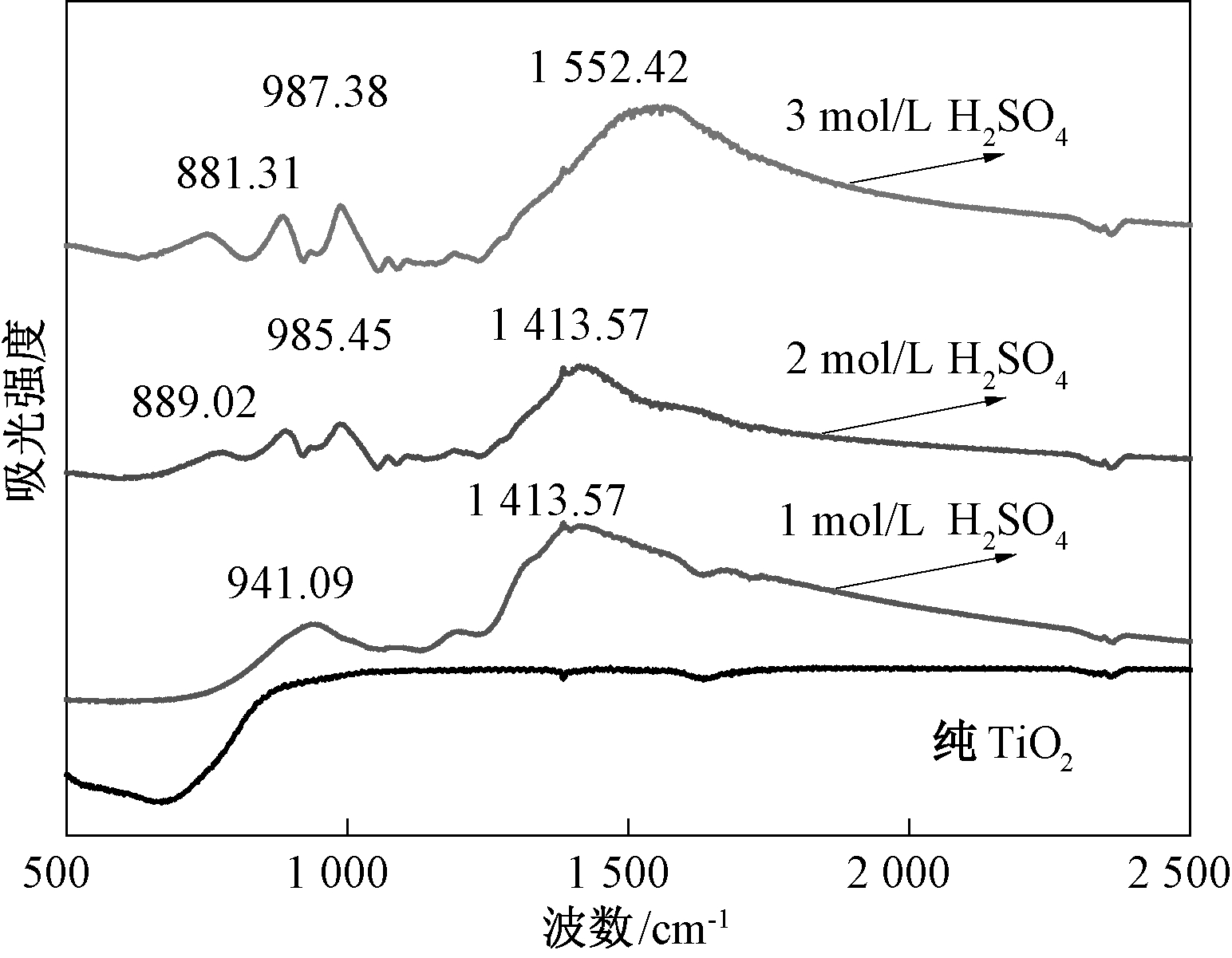
图6 纯TiO2及不同浓度硫酸处理得到SO42-/TiO2 固体酸的红外光谱
Fig.6 Infrared Spectrum of pure TiO2 and SO42-/TiO2
2.2.2 SO42-/TiO2固体酸的BET分析
SO42-/TiO2的BET见表4.由表4可知:改性TiO2与未处理TiO2相比,H2SO4浓度为1 mol/L和2 mol/L时,比表面积均增大;H2SO4浓度为3 mol/L时,比表面积大幅度减小,故H2SO4浓度不是越大越好.硫酸浓度小时,比表面积增大可能是TiO2与SO42-结合产生多孔结构造成的;硫酸浓度增大时,比表面积减小可能是硫酸盐覆盖在多孔上造成的.
2.2.3 原料与降解产物的紫外光谱分析
由图7可知,降解前原花青素与降解后产物的最大吸收波长均为500 nm,且两者的紫外吸收光谱相近,故降解产物具有原花青素分子中黄烷醇单元的特征吸收峰,也证实固体酸降解主要断裂的是单体间的链接键,而并未破坏黄烷醇单元的结构.
表4 不同浓度硫酸制备的固体酸SO42-/TiO2的比表面积
Tab.4 Specific surface area of solid acid SO42-/TiO2 m2·g-1

TiO2的比表面积SO42-/TiO2比表面积1 mol·L-1硫酸2 mol·L-1硫酸3 mol·L-1硫酸74.847104.393159.23821.736
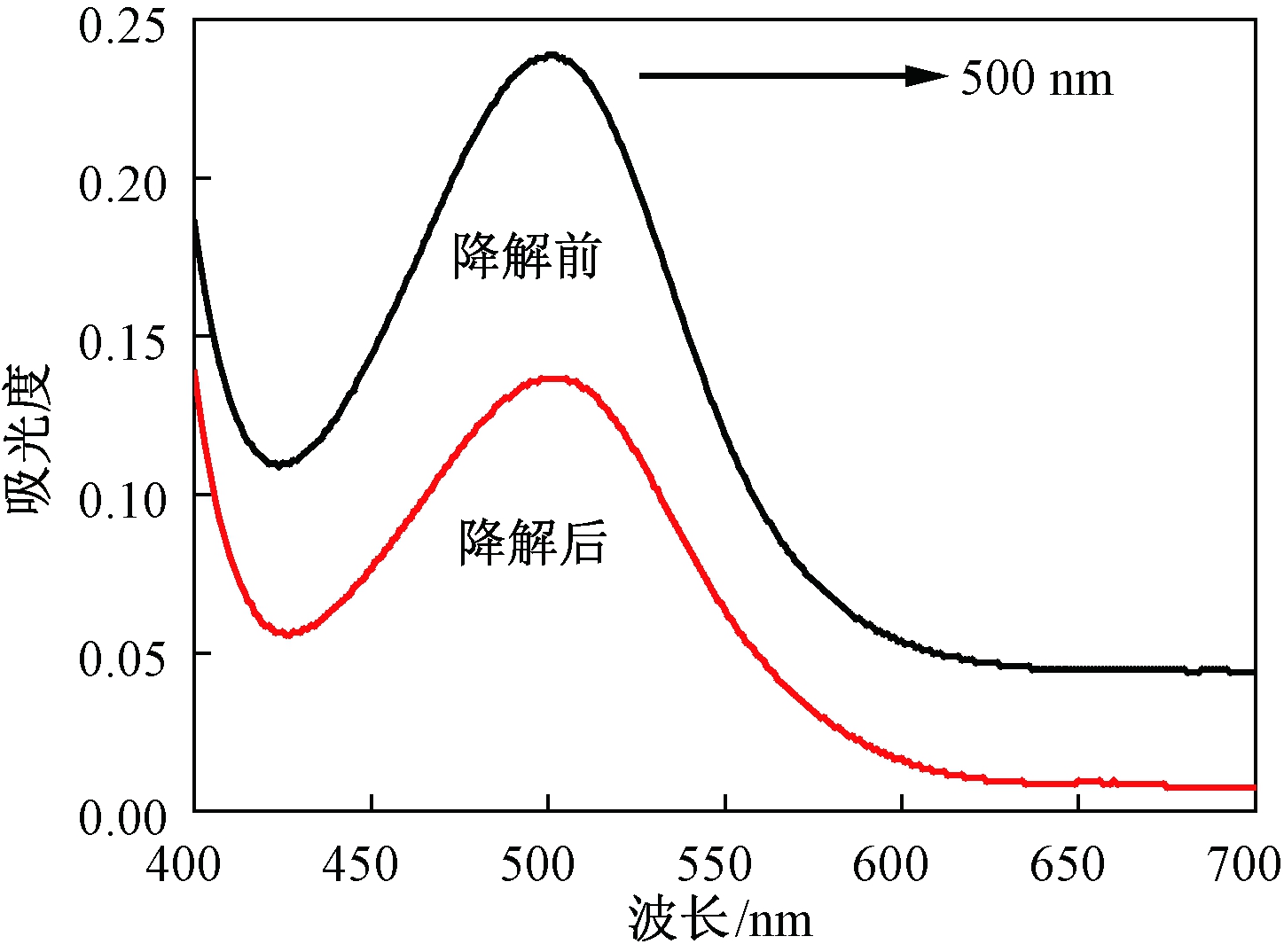
图7 降解前后物质的最大吸收波长
Fig.7 Maximum absorption wavelength of the material
2.2.4 原料与降解产物的GPC分析
凝胶色谱的工作原理为:分子量大的物质先出峰,分子量小的物质后出峰.图8表明:降解反应前,原花青素主要以高聚物存在;降解反应后,高聚体含量大大减少,低聚体含量增加.所以说,固体酸降解反应达到了目的.
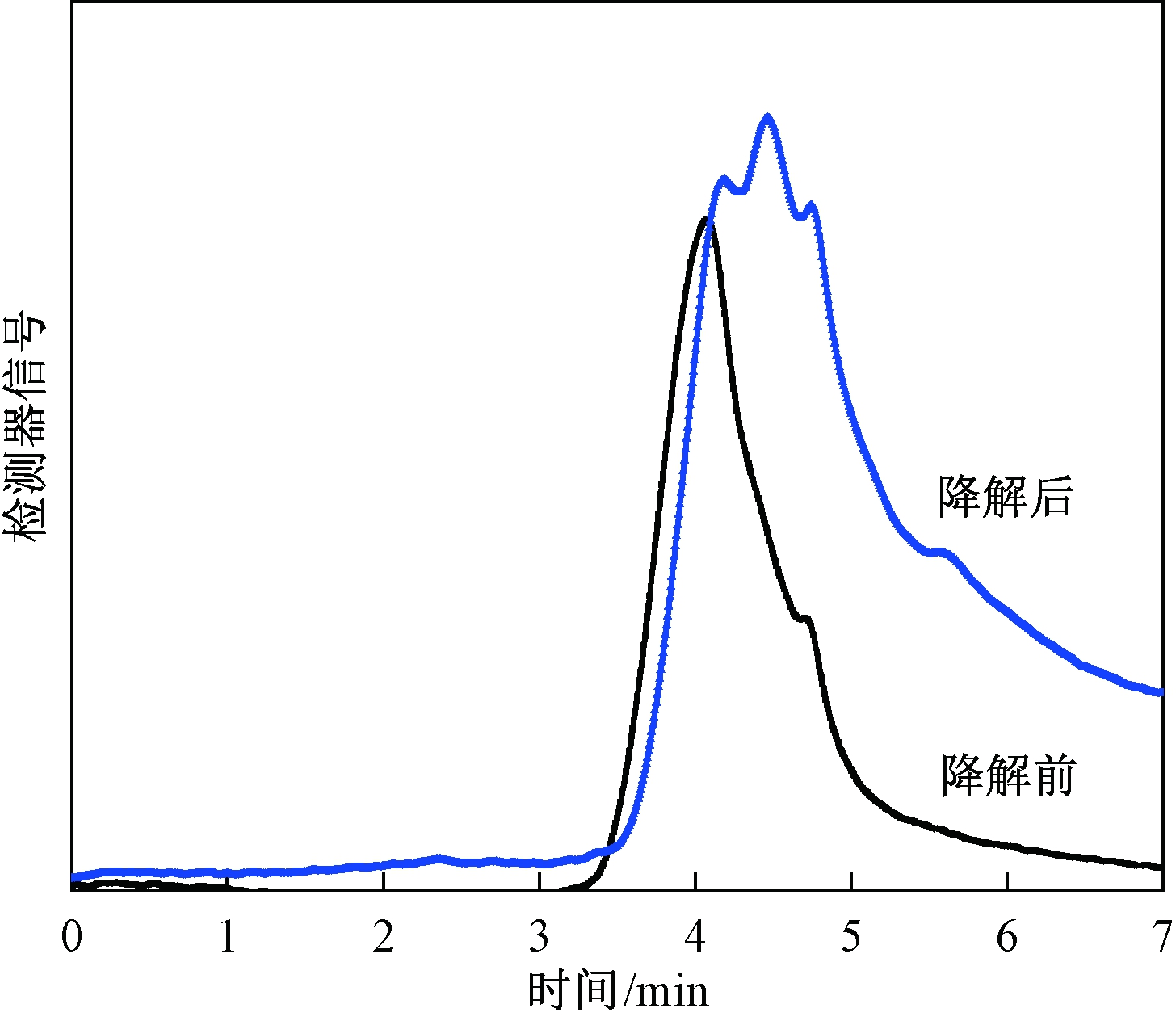
图8 降解前后物质的凝胶色谱
Fig.8 Gel chromatography of substances
3 结论
笔者制备出性能良好的SO42-/TiO2固体酸催化剂,可以有效地降解高聚体原花青素,以实现生物活性最高的二聚体原花青素的制备.实验确定了固体酸降解高聚体原花青素的最佳工艺条件,采用2#纳米级TiO2制备出的含H2SO4浓度为2 mol/L的SO42-/TiO2固体酸,固体酸加入量0.04 g·(10 mL)-1,反应温度70 ℃,反应时间60 min.此条件下高聚体的平均聚合度从5.95降为2.31,降解率可达到61.18%.紫外光谱表明,固体酸降解反应没有破坏原花青素应有的分子结构.凝胶色谱表明,降解产物低聚体含量显著增多.这说明降解反应得以实现.此研究所确定的工艺条件及实验结果为莲房原花青素的充分和高效利用提供了有效的途径.
[1] BAGCHI D, BAGCHI M, STOHS S, et al. Free radicals and grape seed proanthocyanidin extract: importance in human health and disease prevention[J]. Toxicology, 2000, 148(213): 187-197.
[2] 陈卫航,谭美亭,张婕. 响应曲面法优化莲房原花青素提取工艺研究[J]. 郑州大学学报(工学版), 2012, 33(2): 31-35.
[3] OU K Q, GU L W. Absorption and metabolism of proanthocyanidins[J]. Journal of functional foods, 2014, 7(1): 43-53.
[4] LUO L X, CUI Y, CHENG J H, et al. An approach for degradation of grape seed and skin proanthoc-yanidin polymers into oligomers by sulphu-rous acid[J]. Food chemistry, 2018, 256: 203-211.
[5] 赵平,刘俊英,张月萍. 原花青素高聚体水解工艺[J]. 食品科技, 2011, 36(2): 174-178.
[6] 刘超英,杨晓瑞,束艳方,等. 固体酸降解木质纤维素的研究进展[J]. 食品工业科技, 2016, 37(7): 387-391.
[7] 梁润娟. 离子液体环境下固体酸催化纤维素降解的研究[D]. 金华: 浙江师范大学物理化学研究所, 2013.
[8] LI B G. Extraction and purification of oligomeric proanthocyanidins from pine bark and its hypolipidemic effects[J]. Medicinal plant, 2011, 2(12): 4-6.
[9] 于荟,于清跃. SO42-/TiO2型固体酸催化剂的催化及稳定性能研究[J]. 硅酸盐通报, 2014, 33(3): 502-510.
[10] 郭慧. SO42-/TiO2固体超强酸催化剂的制备与改性和评价[D]. 哈尔滨: 哈尔滨工业大学应用化学系, 2006.
[11] 魏冠红,魏作君,苏宝根,等. 测定原花青素平均聚合度的一种新方法[J]. 中国食品学报, 2006, 6 (6): 112-116.