0 引言
随着重金属废水的排放标准越加严格,广泛使用的氢氧化物或硫化物沉淀法难以满足废水的排放要求.其缺点在于:药剂用量大;需严格控制pH;易造成二次污染[1].而二硫代氨基甲酸盐类(DTC)因其具有极强的络合重金属能力,能与废水中重金属离子螯合形成稳定沉淀物,成为研究较多的一类重金属捕集剂.
DTC重金属捕集剂可以分为高分子和小分子捕集剂.高分子捕集剂如刘立华等[2]制备的高分子螯合絮凝剂ACPF,分子中含有大量螯合基团,沉淀效果好,但由于存在空间位阻,部分螯合基团不能与重金属配位.小分子捕集剂的螯合基团利用率高,但大多数小分子DTC捕集剂如二乙基二硫代甲酸钠[3]、N,N-双(二硫代羧基)乙二胺[4]、N,N-哌嗪二硫代氨基甲酸钠[5]等,分子中螯合基团含量少,造成单分子捕集剂螯合重金属离子数量少,形成的螯合物体积小,不易于沉淀,需维持适当过量才能达到较好的沉降效果.而黄兰等[6]制备的二硫代氨基三聚氰酸钠(TDC)及Fu等[7]制备的六氢三嗪二硫代氨基甲酸钠(HTDC),其分子中含有3个螯合基团,提高了单分子螯合重金属离子的数量,并且重金属离子可以与分子内不同位点或分子间的螯合基团进行配位,使得螯合沉淀物体积不断增大,有助于絮凝沉降.在此基础上,笔者进一步提高了分子中螯合基团数量来加强沉降效果,采用二并哌嗪和二硫化碳为原料合成了一种分子中含有4个二硫代羧基基团的化合物——N,N,N,N-4(二硫代羧基)二并哌嗪(简称为TDDP),并考察了其对废水中Cu、Pb、Zn离子的去除性能.
1 实验部分
1.1 实验试剂
二并哌嗪(实验自制)[8];二硫化碳;氢氧化钠;盐酸;硝酸铜;硝酸铅;硫酸锌;硝酸镉;聚丙烯酰胺(PAM);以上均为分析纯.
1.2 分析仪器和检测方法
Elementar Vario ELⅢ进行元素分析(CNSH);红外光谱仪Nicolet Model 400D(KBr压片)对产物结构表征;火焰原子吸收分光光度计(TAS-990)测定溶液中重金属的浓度;PHS-3C型精密PH计调节溶液酸碱度.
1.3 TDDP的合成
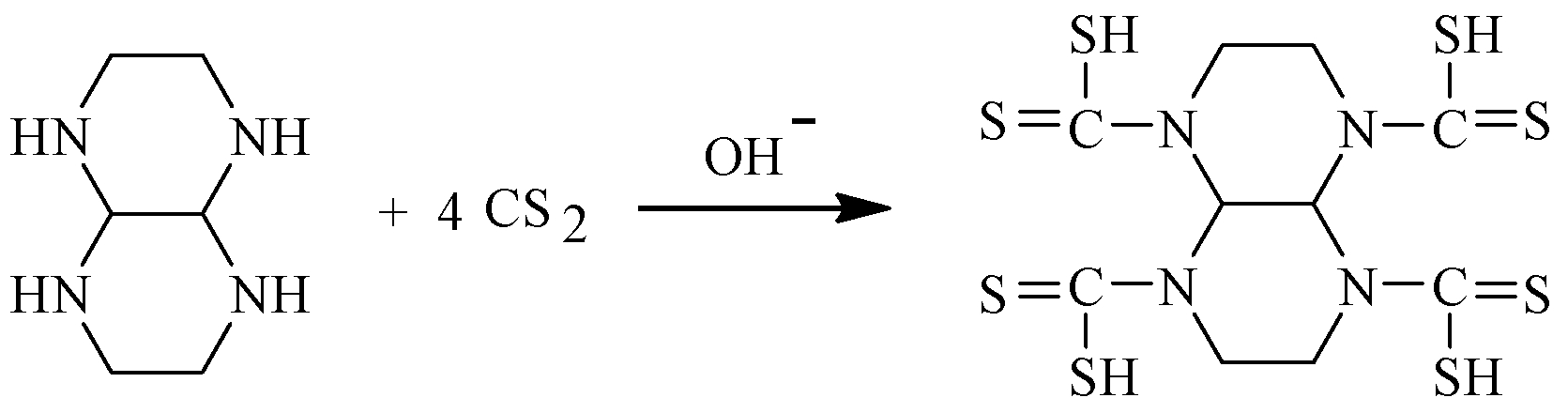
反应物的摩尔比是n(二并哌嗪)∶n(CS2)=1∶4,先将1.5 g二并哌嗪溶于15 mL水中倒入三口烧瓶,加入少许NaOH溶解并搅拌冷却,然后在冰水浴下滴加CS2和乙醇混合溶液,保持温度在10 ℃以下.30 min滴加完毕后,将水浴升温至30 ℃,冷凝回流3~4 h.出现黄色沉淀物,抽滤水洗.在真空干燥箱中40 ℃干燥24 h,得到黄色固体粉末TDDP.反应式如下:
1.4 单一重金属离子去除实验
将TDDP溶于氢氧化钠溶液中,调节pH=8,在室温条件下分别配制浓度为10 mg/L的Cu2+、Pb2+、Zn2+溶液,调节溶液pH,取50 mL于锥形瓶中作为水样.加入不同剂量的TDDP,搅拌一定时间,然后再加入质量分数1‰ PAM搅拌5 min.静置一段时间,取上层清液测重金属含量.实验研究了TDDP的用量、溶液的pH值、反应时间对单一重金属去除的影响.
1.5 混合离子去除实验
配制浓度为0.1 mmol/L的Cu2+、Pb2+、Zn2+、Cd2+溶液,调节pH为5.5.分别加入不同剂量的TDDP,反应5 min后加入质量分数1‰的PAM,搅拌5 min后静置.取上层清液测量重金属含量,研究TDDP对重金属离子螯合能力的大小.
2 实验结果与讨论
2.1 TDDP的结构表征
TDDP的红外光谱见图1.从图1可以看出,在TDDP的光谱中原料二并哌嗪在3 183.9 cm-1处的N—H伸缩振动峰消失,并在1 467 cm-1和1 014 cm-1出现新的吸收峰,分别是—NCS2的伸缩振动吸收峰和C—S的吸收峰,说明产物分子中确实含有二硫代氨基甲酸基团.
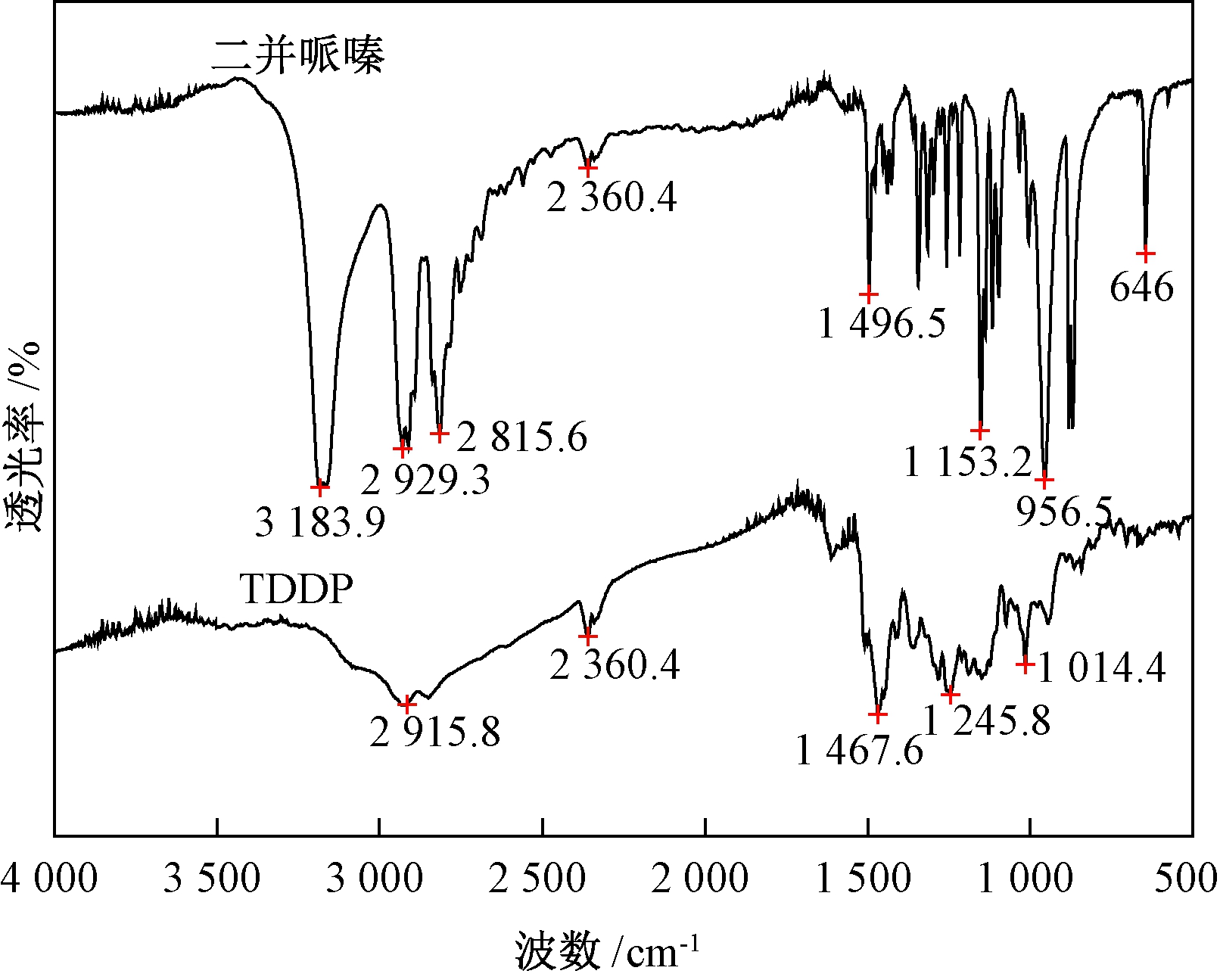
图1 TDDP和二并哌嗪的红外光谱图
Fig.1 FT IR spectra of TDDP and dipiperazine
TDDP产物提纯后进行元素分析(表1).根据分子结构可知,C、N、S和H的原子比为2.5∶1∶2∶3.5,与TDDP的理论值非常接近,因此可推断产物结构与目标结构相同.
表1 TDDP的元素分析
Tab.1 Elemental analyses of TDDP
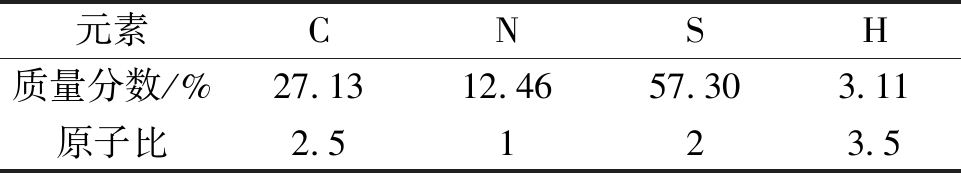
元素CNSH质量分数/%27.1312.4657.303.11原子比2.5123.5
2.2 TDDP与重金属螯合产物结构
为了确定TDDP与重金属的螯合产物的结构,研究了产物与重金属离子最佳去除效果时的比例关系(图2).从图2可以看出,溶液中剩余的Cu2+浓度随着n(TDDP)/n(Cu2+)增大而逐渐减小,当n(TDDP)/n(Cu2+)达到0.5时,Cu2+浓度几乎不再变化,这说明一个TDDP分子可以与两个Cu2+进行配位.
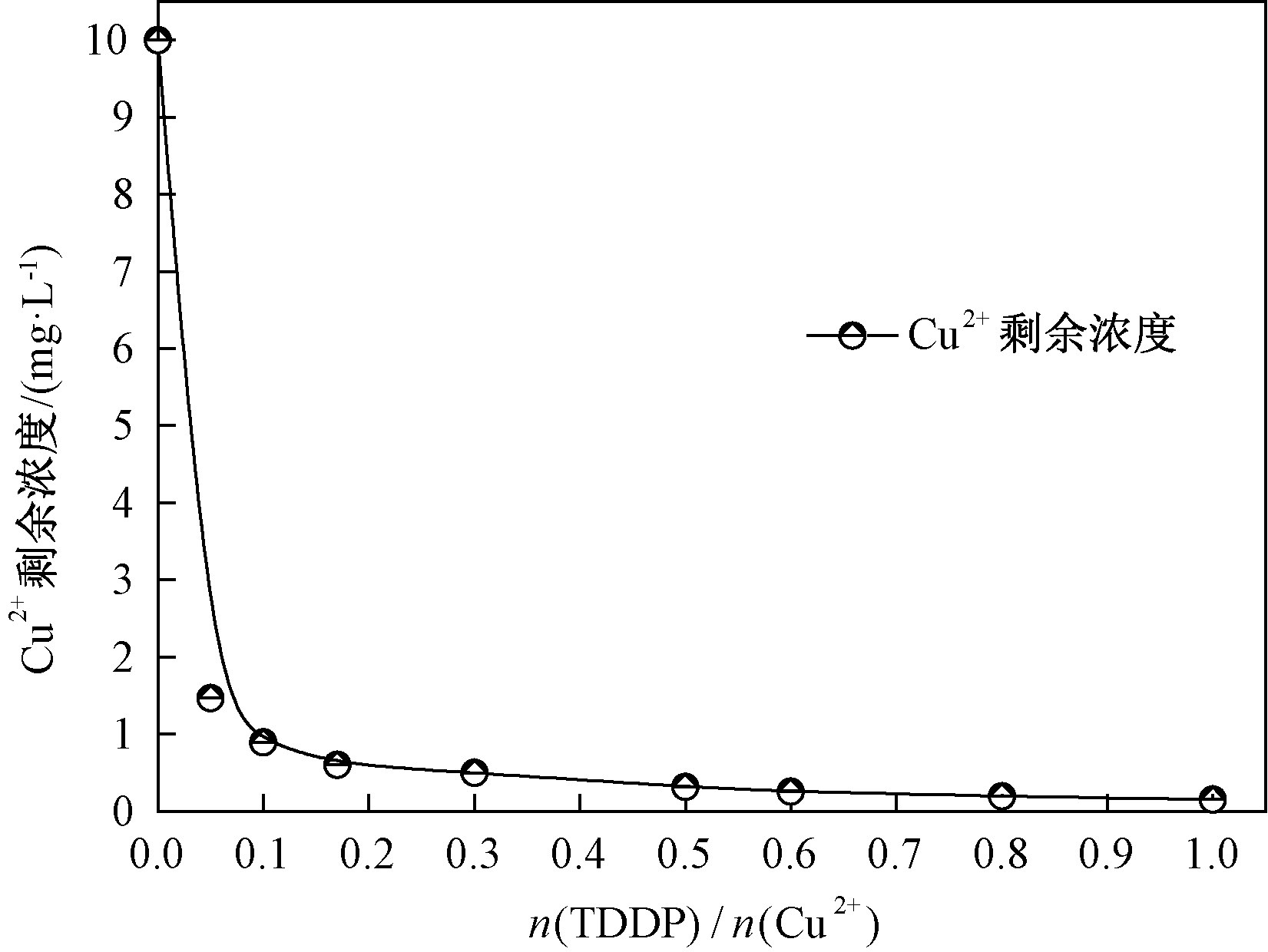
图2 n(TDDP)/n(Cu2+)对剩余Cu2+浓度的影响 (pH=5.5)
Fig.2 The effect of residual Cu2+ concentration by molar ratio of TDDP and Cu2+(pH=5.5)
2.3 TDDP用量对重金属离子去除率的影响
各取50 mL浓度为10 mg/L的Cu2+、Pb2+、Zn2+溶液,在室温环境和pH=5.5的条件下,加入不同剂量的TDDP,搅拌5 min,然后加入一定量1‰ PAM继续搅拌5 min.静置15 min,取上层清液滤纸过滤后测量.观察TDDP用量对重金属离子处理效果的影响,结果如图3所示.图中TDDP用量换算成与废水中重金属离子(Cu2+、Pb2+、Zn2+)的摩尔比.
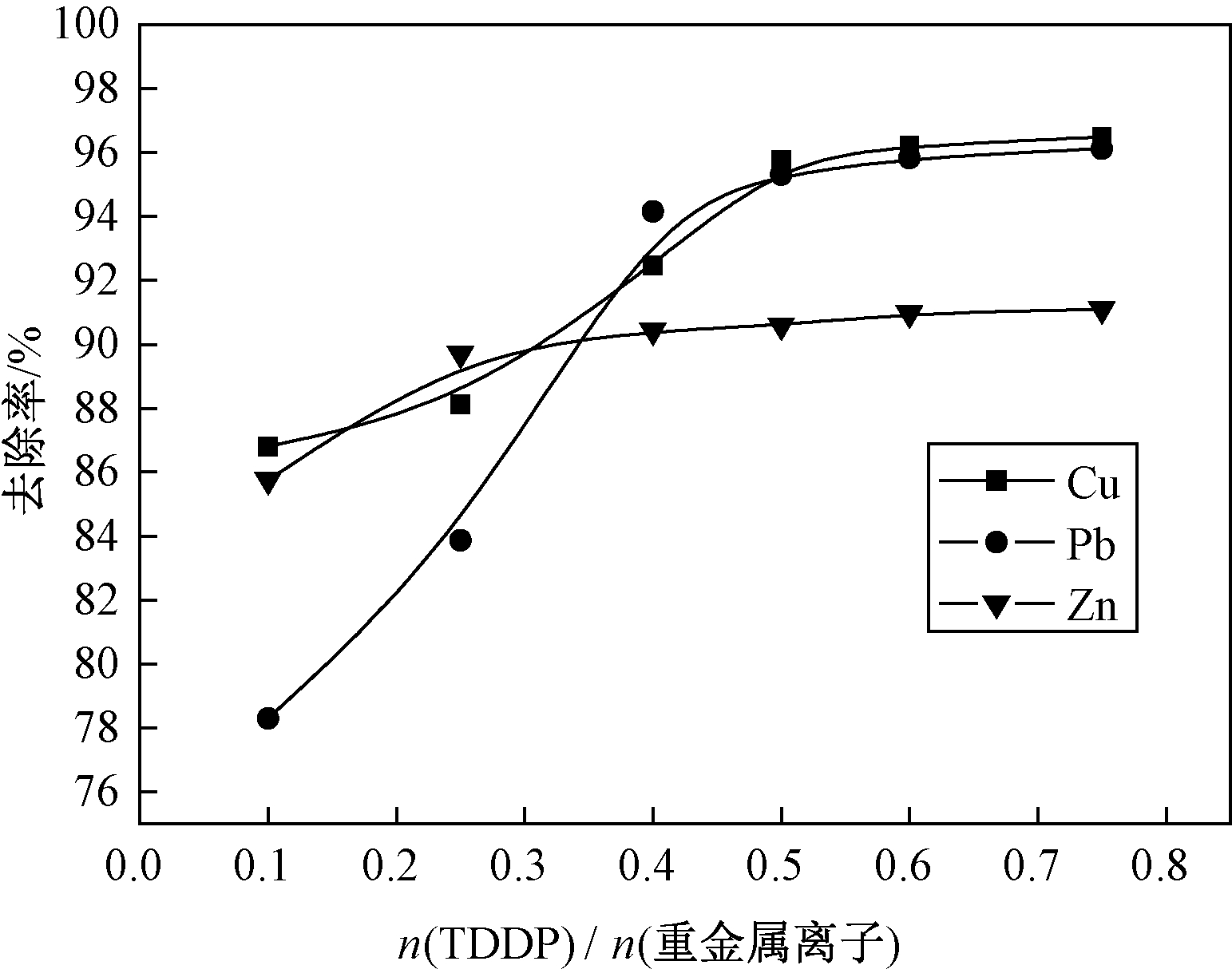
图3 TDDP用量对重金属离子的去除影响(pH=5.5)
Fig.3 Effect of TDDP dosage on removal efficiency(pH=5.5)
从图3可知,各重金属离子的去除率随着TDDP用量的增加而增大,在n(TDDP)/n(重金属离子)=0.5处趋于平缓.当n(TDDP)/n(重金属离子)=0.6时,Cu2+、Pb2+的去除率可达96%以上,Zn2+的去除率达到91%以上,剩余浓度分别为0.35 mg/L、0.39 mg/L、0.89 mg/L,均达到国家排放标准[c(Cu2+)≤0.5 mg/L,c(Pb2+)≤0.5 mg/L,c(Zn2+)≤1.5 mg/L].故本实验TDDP最佳用量为0.6倍废水中各重金属离子摩尔量,即n(TDDP)/n(重金属离子)=0.6.
2.4 溶液pH对重金属离子去除率的影响
在n(TDDP)/n(重金属离子)=0.6和反应时间为5 min的条件下,调节各溶液的pH值为3~11,观察pH值对去除效果的影响.
从图4可以看出,在pH值为4~11内TDDP对Cu2+、Pb2+、Zn2+都有良好的去除效果,其中Zn2+的去除率在pH=3就能达到85%,剩余浓度小于国家排放标准1.5 mg/L.因此,TDDP可以直接用于处理酸性废水,弥补中和沉淀法pH适用范围窄的不足.
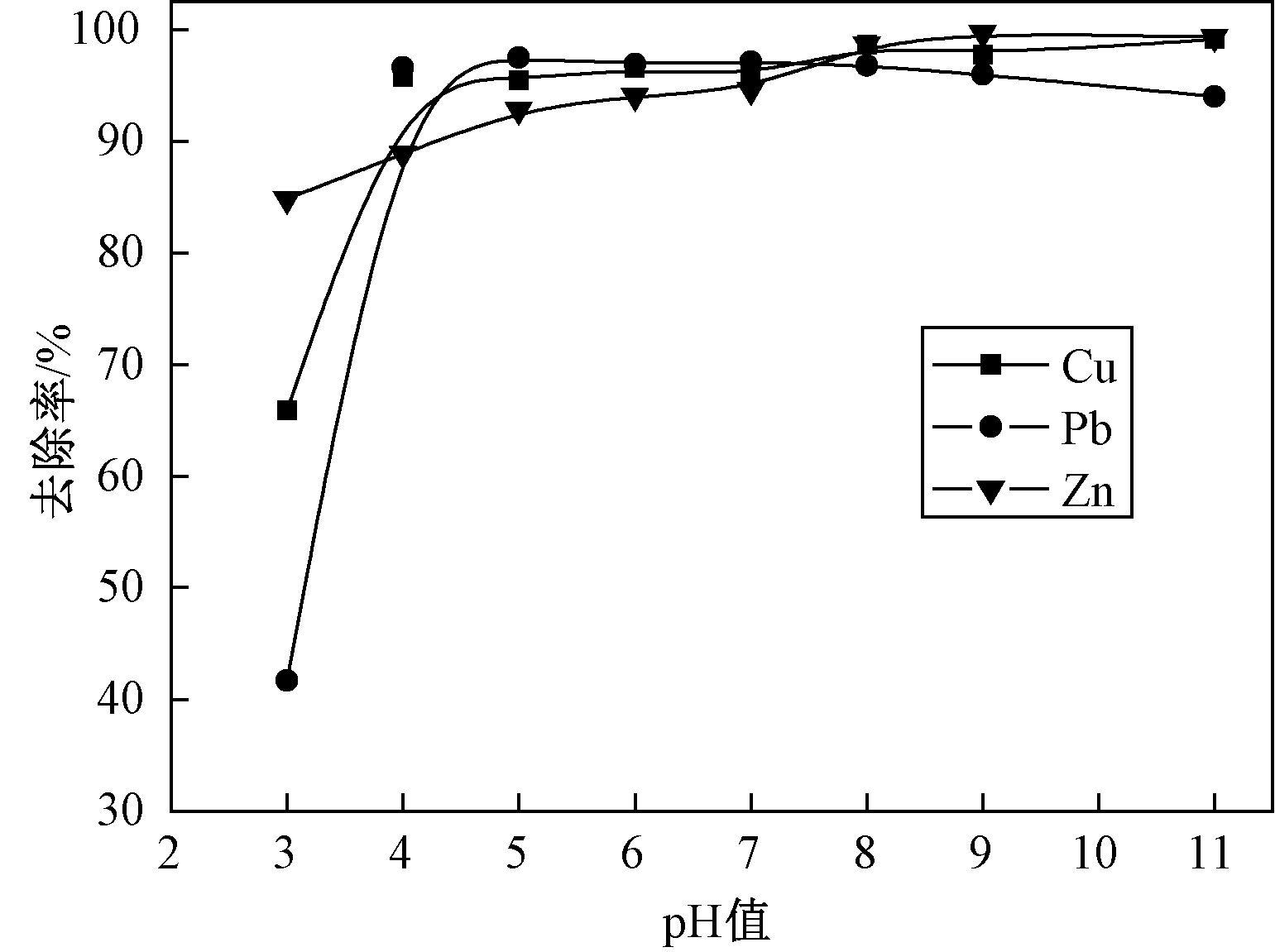
图4 pH对重金属离子去除率的影响
Fig.4 Effect of pH on removal efficiency
2.5 反应时间对去除效果的影响
各取50 mL浓度为10 mg/L的Cu2+、Pb2+、Zn2+溶液,n(TDDP)/n(重金属离子)=0.6,搅拌反应不同时间,观察反应时间对重金属离子处理效果的影响.由图5得出,随着时间的增加,去除率先增大而后趋于平缓.不同的重金属离子趋于平缓的时间也不同,Cu2+、Pb2+基本在1 min后就可以达到较高的去除率,3 min后去除率基本不变.Zn2+在5 min后去除率稳定.因此TDDP可以快速去除废水中的重金属,且螯合速率大小排序为:Cu2+>Pb2+>Zn2+.
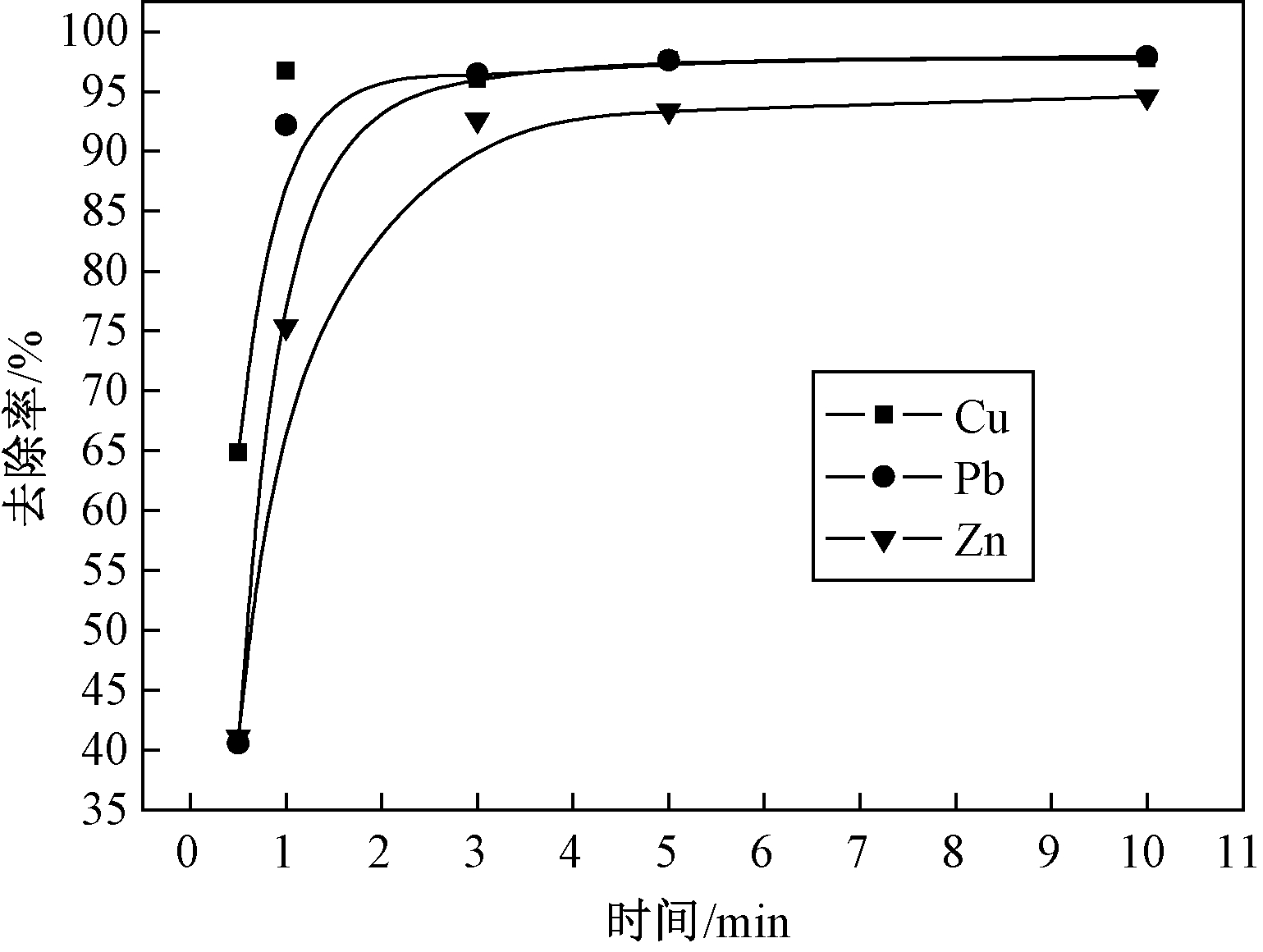
图5 反应时间对重金属离子去除率的影响(pH=5.5)
Fig.5 Effect of reaction time on removal efficiency(pH=5.5)
2.6 TDDP对混合离子溶液的去除效果
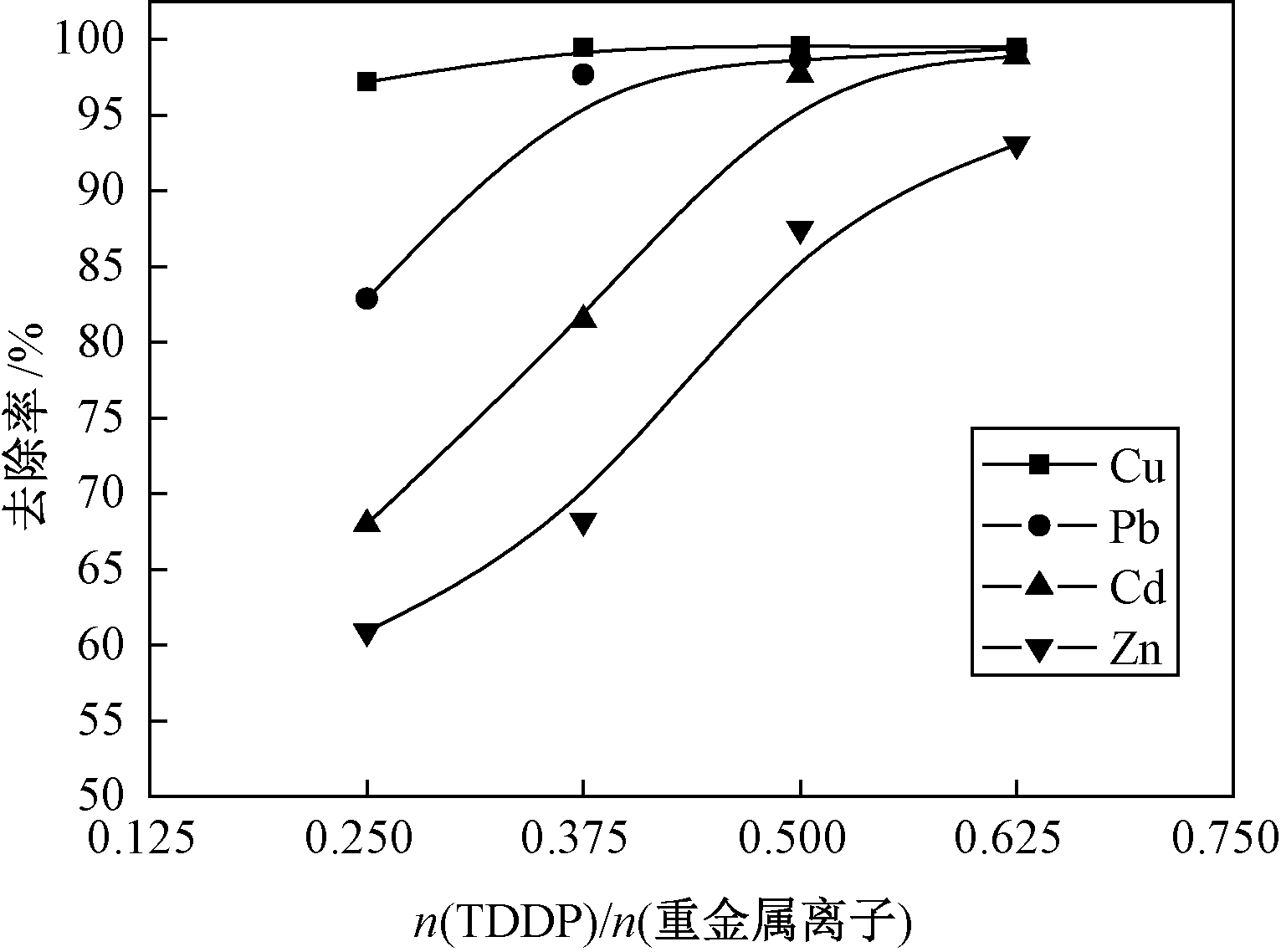
图6 TDDP对混合离子溶液的去除效果
Fig.6 Effect of TDDP on removal of mixed heavy-metal ions
为了考察TDDP对多种重金属离子的螯合性顺序,配置等摩尔浓度的混合溶液进行实验.取50 mL浓度为0.1 mmol/L的Cu2+、Pb2+、Zn2+、Cd2+的混合溶液,调节pH=5.5,加入不同剂量的TDDP,观察对多种重金属离子去除的效果,结果如图6所示.从图6可以看出,随着TDDP用量的增加,各金重属离子的去除率变大;当n(TDDP)/n(重金属离子)=0.5时,Cu2+、Pb2+、Cd2+、Zn2+的去除率分别为99.6%、98.7%、97.7%、87.5%,剩余浓度除Cd2+外均可达到排放标准.因此TDDP可以共同去除混合重金属离子.
在摩尔浓度相同的混合体系中,重金属离子间存在复杂的竞争关系,根据软硬酸碱理论可知:TDDP为软碱,Cu2+、Pb2+、Zn2+属于交界酸,Cd2+属于软酸,理论上优先去除Cd2+;但根据配位场理论,d轨道全空的Pb2+形成的螯合物比d轨道全满的Cd2+和Zn2+稳定,综合考虑TDDP对4种重金属离子的选择性顺序为:Cu2+>Pb2+>Cd2+>Zn2+,与实验结果一致.相似的结论在王刚制备的聚乙烯亚胺基黄原酸钠(PEX)文献[9]中也有报道,PEX去除各种重金属离子的选择性为:Cu2+>Pb2+>Cd2+>Ni2+>Zn2+;而在LI的文献[10]中,其制备的CDTC对多种金属的选择性为:Cu2+>Zn2+>Pb2+>Cd2+.这与重金属捕集剂官能团连接的基体结构有关,不同的基体结构对重金属离子的螯合性存在差异.
3 结论
(1)以二并哌嗪和CS2制备了一种DTC类重金属捕集剂TDDP,产物是黄色固体粉末.TDDP分子中含有4个单键—CS2基团,能高效螯合重金属离子,有利于处理含重金属离子的废水.
(2)处理10 mg/L的Cu2+、Pb2+、Zn2+的废水,当n(TDDP)/n(重金属离子)=0.6时,Cu2+、Pb2+的去除率可达96%以上,Zn2+的去除率达到91%以上.TDDP处理重金属废水时适应的pH值范围较宽,pH为4~11都有较高的去除效果;并且沉淀快,5 min内处理后的溶液可达国家标准.
(3)TDDP可以共同去除混合重金属离子,且对4种重金属离子的选择性顺序为:Cu2+>Pb2+>Cd2+>Zn2+.
[1] 张浩勤,黄满满,张晓飞,等. 新型重金属捕集DTC-U处理含铅废水的研究[J]. 郑州大学学报(工学版),2013,34(6):44-47.
[2] 刘立华,周智华,吴俊,等. 两性高分子螯合絮凝剂与Cu(Ⅱ)、Pb(Ⅱ)、Cd(Ⅱ)、Ni(Ⅱ)的螯合稳定性[J]. 环境科学学报,2013,33(1):79-87.
[3] ABU R, ZABIN S A. Removal efficiency of Pb, Cd, Cu and Zn from polluted water using dithiocarbamate ligands[J]. Journal of taibah university for science, 2017,11(1):57-65.
[4] 肖晓,孙水裕,严苹方,等. 高效重金属捕集剂EDTC的结构表征及对酸性络合铜的去除特性研究[J]. 环境科学学报,2016,36(2):537-543.
[5] FU F, CHEN R, XIONG Y. Application of a novel strategy-coordination polymerization precipitation to the treatment of Cu2+-containing wastewaters[J]. Separation and purification technology,2006,52(2):388-393.
[6] 黄兰,付丰莲,陈润铭,等. 沉淀剂TDC的合成及其性能研究[J]. 广州化工,2006,34(4):1-4.
[7] FU F, ZENG H, CAI Q, et al. Effective removal of coordinated copper from wastewater using a new dithiocarbamate-type supramolecular heavy metal precipitant[J]. Chemosphere,2007,69(11):1783-1789.
[8] 陈静. 二并哌嗪合成工艺和反应动力学及热力学性质的研究[D].上海: 华东理工大学化工学院,2012.
[9] 王刚. 重金属絮凝剂聚乙烯亚胺基黄原酸钠的制备及性能研究[D].兰州: 兰州交通大学环境与市政工程学院,2013:142-163.
[10] LI Z L. Synthesis of a carbamide-based dithiocar-bamate chelator for the removal of heavy metal ions from aqueous solutions[J]. Journal of industrial and engineering chemistry, 2014,20(2): 586-590.