0 引言
钽酸盐、铌酸盐和钛酸盐[1]是具有 ABO3钙钛矿结构的半导体材料,在利用太阳能光解水及光降解污染物方面具有广阔的应用前景,尤其是钽酸盐结构容忍度大,能有效地进行部分离子的交换,结构和性能调变的范围较大,在可见光催化剂领域具有广阔的应用前景.NaTaO3具有高度的稳定性,反应中不发生光腐蚀和化学腐蚀,且安全无毒,其光生电子、空穴具有足够的还原和氧化能力,同时 NaTaO3半导体材料独特的晶体结构及能带结构使其在光催化降解有机污染物及光催化制备氢气等领域有应用前景[2].NaTaO3负载 NiO后具有较高的光量子产率,也明显提高了太阳光的利用率[3].
目前NaTaO3的合成方法主要有固相法[4-6]、水 热 法[7-11],溶 胶-凝 胶 法[12,13].Kato 等[4] 以Ta2O5为钽源,分别以(Li、Na、K)2CO3为原料,采用固相法合成一系列钽酸盐.Li等[8]采用水热法合成了具有钙钛矿结构的NaTaO3,并测试了粉体光催化性能.Hu等[12]采用溶胶-凝胶法合成了高活性的NaTaO3粉体.现有合成NaTaO3粉体存在着如下缺点,如:固相法的合成温度高、粉体尺寸大;水热法产率低;溶胶-凝胶法生产成本高等,限制了NaTaO3粉体的开发与应用.
熔盐法具有合成温度低、反应时间短、产物粒径细小、纯度高、结构可控、过程简单等优点[14],近年来在无机粉体材料的制备中被广泛应用.如Katayama[15]等以 BaCO3、TiO2 和氧化铷为初始原料,LiCl、KCl、NaCl为熔盐,在 1 000 ~1 200 ℃ 合成了单相 BaNd2Ti4O12粉体,降低了合成温度.Tian 等[16]以 MgO、Nd2O5、BaCO3为原料,以 KCl为熔盐,900℃ 保温 2h制备了单相Ba(Mg1/3Nb2/3)O3陶瓷粉体,粉体粒径约 1 μm,比用固相反应法合成温度降低了约400℃.Xie等[17]以LiNO3为熔盐,熔盐与反应物的质量比为1∶8,350℃合成了片状 Bi2MoO6粉体,加入熔盐并能够控制粉体的显微形貌.Arney等[18]以 TiO2和 La2O3为前驱体,Na2SO4/K2SO4为熔盐,1 100℃保温1~10 h合成了La2Ti2O7粉体,并且熔盐加入量和保温时间对粉体的形貌、催化活性有较大影响.
笔者以Ta2O5和NaCO3为原料,以NaCl-KCl-NaF和NaCl-KCl为熔盐介质合成 NaTaO3粉体,借助X射线衍射仪、扫描电子显微镜研究了熔盐种类、反应温度对粉体物相组成和显微形貌的影响规律,并测试了部分粉体的光催化性能.
1 试验方案
1.1 试验原材料
以 Ta2O5(99.5%,粒度 500 nm)、Na2CO3(99.5%)为 原 料,以 NaCl(99.5%)、KCl(99.5%)和 NaF(>98.5%)为熔盐.按照 Ta2O5和 Na2CO3摩尔比 1∶1.1(Na2CO3过量 10%)称取后充分混合;分别将 NaCl/KCl/NaF和NaCl/KCl按摩尔比为 1∶1∶0.4 和 1∶1称取混合均匀得到混合盐,110℃干燥4 h备用.
1.2 试验配比及试验方法
按照反应物(Ta2O5与 Na2CO3的混合粉料)与NaCl-KCl-NaF或NaCl-KCl复合盐质量比1∶0.5、1∶1、1∶3、1∶5、1∶7称取适量的反应物和盐,混合 均 匀 后 分 别 于 500、600、700、800、900、1 000℃保温2 h,随炉自然冷却至室温,取出样品.将煅烧产物用热的去离子水洗涤数次以除去多余的熔盐,经离心分离后得到的粉体,再经110℃干燥6 h得到产物粉体.
用X射线粉末衍射仪(XRD,Philips X'Pert Pro型,Cu Kα)分析样品的物相组成;用扫描电子显微镜(SEM,Zeiss EVO HD15型)分析样品的显微形貌.
采用液相评价法,以10 mg/L亚甲基蓝为降解物,将40 mg NaTaO3粉体加入到60 mL亚甲基蓝溶液中,避光搅拌30 min使染料在样品表面达到吸附-脱附平衡,以氙灯(Abet Technologies Inc.,~150 mW/cm2)作为光源.降解过程中,每间隔20 min取4 mL亚甲基蓝溶液,离心后取上清液,利用紫外-可见分光光度计(UV-1800PC)测定其吸光度,计算亚甲基蓝溶液浓度随降解时间的变化情况.
2 分析与讨论
按照反应物与熔盐的质量比1∶1称取适量的反应物(Ta2O5和 Na2CO3的混合粉料)和 NaCl-KCl-NaF、NaCl-KCl复合盐(设置对照试验),分别在不同温度下煅烧2 h,产物粉体的XRD图谱如图1所示.
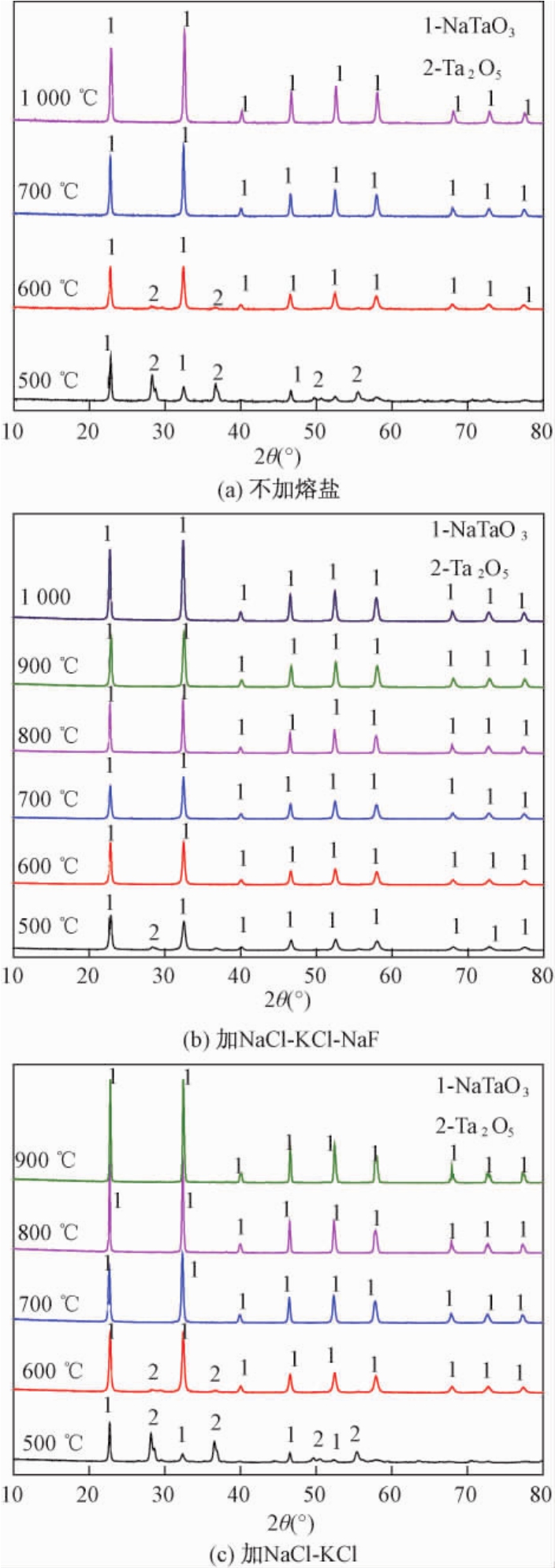
图1 合成产物粉体的XRD图谱
Fig.1 XRD patterns of as-achieved samples
由图1(a)可知,不同温度烧后产物中均出现了NaTaO3特征衍射峰.500、600℃烧后残留有斜方相Ta2O5的衍射峰;当温度升高到700℃时Ta2O5的衍射峰消失,只有斜方 NaTaO3的衍射峰,表明此时Ta2O5已经完全转化为NaTaO3.
由图 1(b)可知,添加 NaCl-KCl-NaF时,500℃烧后粉体物相组成主要为NaTaO3和少量未完全反应的 Ta2O5;当温度升高到600℃及以上时,XRD图谱中只有NaTaO3的衍射峰.由图1(c)可知,添加NaCl-KCl复合盐时,500℃烧后粉体中存留有较多未完全反应的Ta2O5,600℃时仍有少量未完全反应的 Ta2O5;温度升高到700℃时,物相为纯相的 NaTaO3.随处理温度升高,NaTaO3的衍射峰强度逐渐增强,NaTaO3的晶体发育趋于完善.以上结果表明,添加 NaCl-KCl-NaF熔盐能够使NaTaO3的初始合成温度降低约100℃,主要因为三元复合熔盐的熔点较低(约为619℃),在较低温度下形成液相环境,其次可能是Ta2O5在NaF中溶解度大,促进了反应的进行,因此600℃时反应基本完成;而NaCl-KCl复合盐的熔点约为673℃,600℃体系形成的液相较少,因而样品中残留有未反应的Ta2O5.
进一步分析了部分产物粉体的显微形貌,结果如图2所示.由图2(a)~(b)可知,当不添加熔盐时,700、1 000℃保温2 h合成粉体的粒径大多在500 nm以下,形貌为类似球形颗粒,粉体有不同程度的团聚.加入 NaCl-KCl-NaF熔盐,900℃烧后大部分NaTaO3粉体已发育为长方体状;继续升高温度到1 000℃时NaTaO3晶体发育长大,颗粒形貌为长方体[图2(c),(d)],粉体粒径在1 μm以下.由图2(e)~(f)可知加入 NaCl-KCl熔盐后,800℃时大部分NaTaO3粉体已发育为长方体;当温度升高到900℃时,NaTaO3粉体全部发育成为1 μm左右的长方体状小颗粒,且合成的粉体不团聚,分散性较好.以上结果表明:熔盐能够促进 NaTaO3晶体发育长大,并可在较低温度下发育长大成规则的长方体,比传统固相法温度降低约200℃[19].

图2 合成粉体的SEM图像
Fig.2 SEM images of obtained powers
图3为不同熔盐、不同温度下合成的NaTaO3粉体的紫外-可见漫反射(UV-vis)光谱.从图3中可以看出不同条件下合成的样品UV-vis光谱图没有显著的差异,光吸收特性基本一致,晶体发育完整的粉体具有更高的可见光吸收.NaTaO3的吸收边在310 nm,计算出样品的禁带宽度Eg约为4.0 eV,与文献报道的一致[12],由此可知在熔盐介质中制备的粉体与水热法、固相法等方法合成的粉体具有相同的禁带宽度.NaTaO3晶体发育越好,更有利于提高其在可见光区的光吸收.
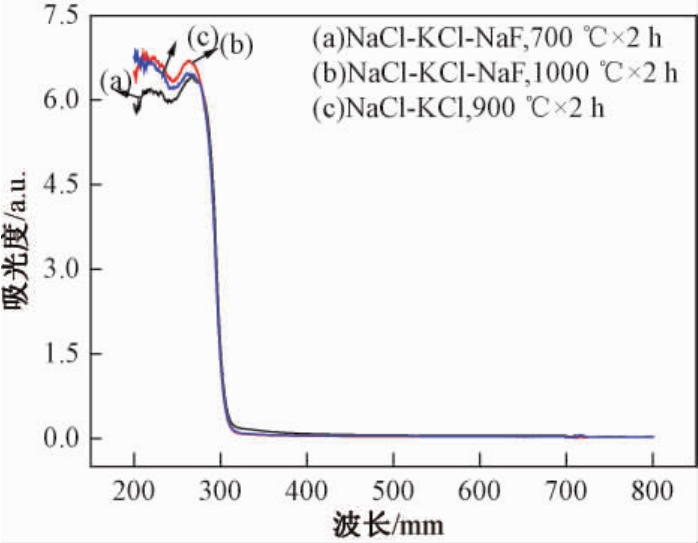
图3 样品的紫外-可见漫反射吸收光谱
Fig.3 UV-vis diffuse reflectance spectra of as-obtained samples
由 Lambert-Beer定律[20]得出
式中:C为亚甲基蓝溶液在t时刻的浓度;C0为亚甲基蓝溶液在t0时刻的浓度(黑暗条件下吸附平衡后);A为亚甲基蓝溶液在 t时刻的吸光度;A0为亚甲基蓝黑暗条件下吸附平衡后的吸光度;C/C0为亚甲基蓝在t时刻的降解率.
根据式(1)计算得到的NaTaO3粉体在紫外-可见光下对亚甲基蓝的降解曲线(C/C0)与降解时间(t)的关系如图4.由图4可以看出,经紫外-可见光照射2 h后,不同条件下合成的NaTaO3粉体均表现一定的光催化活性.NaCl-KCl-NaF熔盐中1 000℃合成的粉体光催化活性最高,2 h降解率为60%,其次是在NaCl-KCl熔盐中900℃合成的样品,2 h降解率为45%,而在NaCl-KCl-NaF熔盐中700℃保温2 h合成的样品,2 h降解率为32%.但亚甲基蓝没有完全降解,原因可能是钽酸钠的禁带较宽,只能响应紫外光.
不同温度和熔盐条件下合成的粉体的光催化性能有明显的差异,NaTaO3粉体的显微形貌为规则的长方体时具有较好的光催化性能,该结果与文献报道的结果一致[21];其次光催化性能也与粉体的粒度有关.由表1可知NaCl-KCl-NaF熔盐中经1 000℃ ×2 h合成的粉体平均粒径为0.8 μm,而在NaCl-KCl熔盐中经900℃ ×2 h合成的粉体平均粒径1.3 μm,在相同条件下粉体的粒径越小,其光催化活性相对较高.光催化结果表明NaTaO3粉体的光催化性能与晶体结晶程度和粉体粒度大小有关.
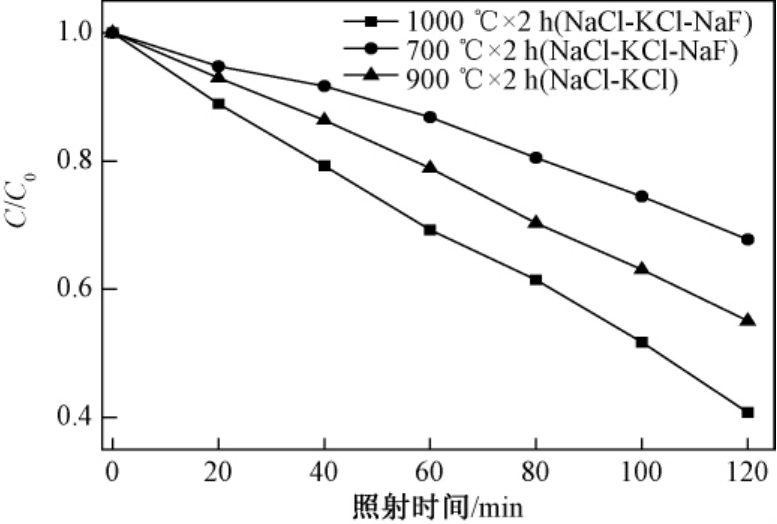
图4 不同条件下合成的样品对亚甲基蓝的降解曲线
Fig.4 Photocatalytic performance of samples synthesized at different condition for degradation of MB
表1 不同条件下合成NaTaO3粉体的平均粒径
Tab.1 Particle size of as-synthesized NaTaO3 powder at different conditions

所用熔盐 热处理条件 平均粒径/μm NaCl-KCl-NaF 1 000℃ ×2 h 0.8 NaCl-KCl-NaF 700℃ ×2 h 0.6 NaCl-KCl 900℃ ×2 h 1.3
与文献[22]对比可知,采用NaCl-KCl-NaF熔盐1 000℃合成的NaTaO3粉体的60 min降解率为37%,比水热法合成的粉体有所提高,其降解率为20%,表明其光催化性能更好.
3 结论
(1)以 Ta2O5、NaCO3为原料,分别以 NaCl-KCl和NaCl-KCl-NaF为熔盐,通过调整热处理温度、熔盐种类等工艺参数制备了形貌和尺寸不同的NaTaO3粉体.
(2)以NaTaO3粉体为熔盐时,600℃即可合成纯相的,与不加熔盐的固相反应法相比,其合成温度降低了约100℃,1 000℃烧后制备的粉体分散性好,粒径小于1 μm,其显微形貌为长方体状,并具有最好的光催化性能.
(3)NaTaO3超细粉体的晶体发育越好,粉体粒度越小,粉体的光催化性能越优.
[1]SHI J,LIU G,WANG N,et al.Microwave-assisted hydrothermal synthesis of perovskite NaTaO3nanocrystals and their photocatalytic properties[J].Journal of materials chemistry,2012,22(36):18808-18813.
[2]李霞,刘艳.NaTaO3光催化剂的水热合成与催化性能研究[J].功能材料,2009,40(3):407-409.
[3]HWANG D W,CHA K Y,KIM J,et al.Photocatalytic degradation of CH3Cl over a nickel-loaded layered perovskite[J].Industrial& engineering chemistry research,2003,42(6):1184-1189.
[4]KATO H,KUDO A.New tantalite photocatalysts for water decomposition into H2and O2[J].Chemical physics letters,1998,295(5):487-492.
[5]SKILLEN N,ADAMS M,MCCULLAGH C,et al.The application of a novel fluidised photo reactor under UV-Visible and natural solar irradiation in the photocatalytic generation of hydrogen[J].Chemical engineering journal,2016,286:610-621.
[6]KATO H,ASAKURA K,KUDO A.Highly efficient water splitting into H2and O2over lanthanum-doped NaTaO3photocatalysts with high crystallinity and surface nanostructure [J]. Journal of theAmerican chemical society,2003,125(10):3082-3089.
[7]RONG Y,TANG L,SONG Y,et al.A new visiblelight driving nanocomposite photocatalyst Er3+:Y3Al5O12/MoS2-NaTaO3-PdS for photocatalytic degradation of a refractory pollutant with potentially simultaneous hydrogen evolution [J].RSC advances,2016,6(84):80595-80603.
[8]LI X,ZANG J.Facile hydrothermal synthesis of sodium tantalite(NaTaO3)nanocubes and high photocata-lytic properties[J].The Journal of physical chemistry C,2009,113(45):19411-19418.
[9]HE Y,ZHU Y,WU N.Synthesis of nanosized Na-TaO3in low temperature and its photocatalytic performance[J].Journal of solid state chemistry,2004,177(11):3868-3872.
[10]LAN N T,PHAN L G,HOANG L H,et al.Hydrothermal synthesis,structure and photocatalytic properties of La/Bi Co-Doped NaTaO3[J].Materials transactions,2016,57(1):1-4.
[11]李文琪,李霞.可见光响应 S掺杂 NaTaO3的制备及其催化性能研究[J].硅酸盐通报,2017,36(11):3867-3872.
[12]HU C C,TENG H.Influence of structural features on the photocatalytic activity of NaTaO3powders from different synthesis methods[J].Applied catalysis A:general,2007,331:44-50.
[13]LIN W H,CHENG C,HU C C,et al.NaTaO3photocatalysts of different crystalline structures for water splitting into H2and O2[J].Applied physics letters,2006,89(21):211904.
[14]闫帅,贾全利,李韦,等.熔盐辅助碳热还原法合成碳化钽粉体 [J].人工晶体学报,2016,45(10):2383-2388.
[15]KATAYAMA K,AZUMA Y,TAKAHASHI Y.Molten salt synthesisofsingle-phase BaNd2Ti4O12powder[J].Journal of materials science,1999,34(2):301-305.
[16]TIAN Z Q,LIU H X,HONG-TAO Y U,et al.Molten salt synthesis of Ba(Mg1/3Nb2/3)O3powder[J].Journal of Wuhan university of technology-Mater.Sci.Ed.2004,19(2):17-19.
[17]XIE L,MA J,XU G.Preparation of a novel Bi2MoO6 flake-like nanophotocatalyst by molten salt method and evaluation for photocatalytic decomposition of rhodamine B [J].Materials chemistry and physics,2008,110(2):197-200.
[18]ARNEY D,PORTER B,GREVE B,et al.New molten-saltsynthesis and photocatalytic properties of La2Ti2O7particles[J].Journal of photochemistry and photobiology A:Chemistry,2008,199(2):230-235.
[19]SUN J,CHEN G,LI Y,et al.Novel(Na,K)TaO3 single crystal nanocubes:molten salt synthesis,invariable energy level doping and excellent photocatalytic performance[J].Energy & environmental science,2011,4(10):4052-4060.
[20]卢红霞,吕泽刚,程向前,等.利用废渣一次烧结制备微晶波动釉面砖的研究[J].郑州大学学报(工学版),2018,39(2):92-96.
[21]章薇,谈国强,夏傲,等.反应温度对水热法制备的NaTaO3粉体结构及光催化性能的影响[J].硅酸盐学报,2011,39(11):1724-1728.
[22]孔新刚,郭章林,黄剑锋,等.不同晶体结构钽酸钠的制备及光催化性能的研究[J].陕西科技大学学报(自然科学版),2014,32(6):61-66.