0 引言
糖化酶可将淀粉完全分解成葡萄糖[1-2],广泛用于酒精、葡萄糖、抗生素、有机酸等物质的发酵生产.在酶催化反应中,游离酶具有难与底物分离,不能重复利用,易失活等缺点;而固定化酶易与底物分离,可重复使用,可连续生产,稳定性好[3-4].酶的固定化通常分为载体结合法、交联法、包埋法及新型的定向固定法[5-9],包埋法制备的固定化酶具有条件温和、酶包埋率不受保护剂及稳定剂的影响等优点,因此,本试验采用包埋法制备固定化酶,并且选择纤维素作为载体材料.与其他载体[10-14]相比,纤维素是具有一定空间结构的天然有机高分子多糖物质.纤维素疏松的孔隙以及长链结构有利于渗透和吸附大分子,具有生物相容性好,无毒,可降解,价格低廉,适合作为固定化酶的载体材料.
1 材料与方法
1.1 原料与试剂
糖化酶由河南天冠企业集团提供,原液酶活力约为100 000 U/mL.
海藻酸钠为化学纯,3,5-二硝基水杨酸、微晶纤维素、氯化钙、酒石酸钾钠、苯酚、无水亚硫酸钠、乙酸、结晶乙酸钠、氢氧化钠均为分析纯.
1.2 试验仪器
LDZF-30KB-Ⅲ型立式压力蒸汽灭菌器,上海申安医疗器械厂;AL204电子分析天平,上海梅特勒-托利多仪器有限公司;NDJ-79型旋转式黏度计,同济大学机械厂;恒温水浴振荡器;WFZ UV-2012 PC型紫外可见分光光度计,上海尤尼柯仪器有限公司.
1.3 测定方法
黏度测定:用NDJ-79型旋转式黏度计.
酶活测定方法:3,5-二硝基水杨酸(DNS)比色法[15-16].
建立葡萄糖标准曲线y=3.395 3x+0.193 0,x为吸光度;y为葡萄糖浓度,mg/mL;得到的线性回归系数R2为0.999 2.
1.4 相关试剂与固定化酶的制备
(1)DNS试剂:准确称取3,5-二硝基水杨酸10 g,氢氧化钠10 g,酒石酸钾钠200 g,重蒸苯酚2 g,无水亚硫酸钠5 g.用500 mL水在45℃水浴中溶解至澄清后,放置冷却至室温.然后加水定容到1 000 mL,滤除杂质后移至棕色试剂瓶中避光干燥存放7 d后方可使用.
(2)葡萄糖溶液(10 mg/mL):称取一定质量的无水葡萄糖在103℃下烘干到质量恒定,精准测取1 g,用水溶解并定容至100 mL.
(3)葡萄糖标准溶液:分别吸取(2)中的葡萄糖溶液 0.0、1.0、1.5、2.0、2.5、3.0、3.5 mL 于10 mL容量瓶中,加蒸馏水定容,摇匀备用.
(4)2%的可溶性淀粉溶液(文中百分数不加特殊说明,均指质量百分数):称取淀粉20 g在蒸馏水中加热溶解,然后定容至1 000 mL.
(5)0.05 mol/L的乙酸-乙酸钠缓冲溶液(pH4.6):称取质量为 6.7 g的乙酸钠,吸取2.6 mL冰乙酸,用水溶解并定容至1 000 mL,再使用pH计校正至pH=4.6即可.
(6)包埋糖化酶的纤维素-海藻酸钙凝胶[17-20]:测定经过杀菌的纤维素和海藻酸钠混合液黏度后,加入2.0 mL糖化酶原液搅拌均匀,取注射器将混合溶液滴加至氯化钙溶液中,反应2 h.滤出纤维素-海藻酸钙凝胶颗粒后用水洗几次,再次移入到氯化钙溶液中,在4℃冰箱中平衡12 h.取出后用蒸馏水洗涤多次,放入冰箱中过夜.
1.5 糖化酶酶活的测定
(1)原酶液酶活力测定:在50 mL锥形瓶中分别加入25.0 mL当天配置的可溶性淀粉溶液和5.0 mL乙酸-乙酸钠缓冲溶液,先放入40℃的恒温槽预热5 min,后加入2.0 mL稀释500倍的酶液,准确反应1 h.反应结束后,加入0.2 mL 20%NaOH溶液终止反应,冷却至室温.将待测溶液稀释5倍后测定吸光度及葡萄糖含量.
(2)固定化糖化酶酶活力测定:测定方法同(1),其中加入的待测固定化糖化酶量为2 g,反应结束后,及时分离固定化酶颗粒与反应液,冷却至室温.
糖化酶活力(U/mL)计算:
式中:y为根据吸光度由回归方程计算的含糖量,mg/mL;5为待测液的稀释倍数;32.2为反应体系的总体积,mL;2为加入了2 mL的酶液参加反应,mL;500为待测酶液的总稀释倍数.
式中:30.0为反应体系总体积,mL;2为包埋制固定化酶加入的酶液体积,mL;m总为固定化酶颗粒总质量,g;m为参与反应固定化酶颗粒质量,g.
1.6 对固定化酶活力影响的单因素试验研究
(1)纤维素-海藻酸钠混合液质量浓度的影响
取氯化钙溶液的质量浓度为20.0 mg/mL,包埋酶量为2.0 mL,取最合适的纤维素-海藻酸钠用量比例,设定纤维素-海藻酸钠混合溶液质量浓度分别为 20.0、25.0、30.0、35.0、40.0 mg/mL,制备固定化酶,考察其对酶活的影响.
(2)氯化钙溶液质量浓度的影响
取包埋酶量为2.0 mL,按最佳纤维素-海藻酸钠用量比例,最适纤维素-海藻酸钠混合溶液质量浓度,设定氯化钙溶液质量浓度分别为20.0、30.0、40.0、50.0、60.0 mg/mL,制备固定化酶,考察其对酶活的影响.
(3)纤维素、海藻酸钠质量比例的影响
取纤维素-海藻酸钠混合溶液和氯化钙溶液的质量浓度均为 20.0 mg/mL,包埋酶量为2.0 mL,设定纤维素-海藻酸钠的质量比分别为3∶1、2∶1、1∶1、1∶2,按照上述方法制备固定化酶,测酶活,考察对酶活的影响.
1.7 响应面优化试验设计
本次试验采用Design-Expert.V8.0.6.1软件和BBD试验设计方法处理数据.根据单因素试验结果,试验因素选择纤维素-海藻酸钠用量比(A)、纤维素-海藻酸钠混合溶液质量浓度(B,%)、氯化钙溶液质量浓度(C,%),响应值用酶活力表示,设计三因素三水平的响应面优化试验,从而确定最优的固定化糖化酶条件.其中A取值为 3、2、1,B 取值为 2.0、2.5、3.0,C 取值为1.0、2.0、3.0.
2 结果与讨论
2.1 不同因素对固定化糖化酶活力的影响
2.1.1 纤维素-海藻酸钠混合溶液质量浓度对固定化糖化酶活力的影响
由图1纤维素-海藻酸钠混合溶液质量浓度对固定化糖化酶活力的影响可知,随着混合溶液质量浓度的增加,固定化酶活力呈现先增大后减小然后趋于平稳的趋势.质量浓度越大,形成的颗粒越大,而总的接触面变小;另外,混合溶液的质量浓度增大,海藻酸钠的含量也增加,使得颗粒结构紧凑,不利于活性位点的显现,造成酶活降低,但总的来说纤维素-海藻酸钠混合溶液质量浓度对固定化糖化酶整体活力的影响较小.
2.1.2 氯化钙溶液质量浓度对固定化糖化酶颗粒形状及活力的影响
试验中氯化钙溶液质量浓度越大,滴入的复合溶液进入氯化钙溶液内部的阻力就越大.在滴加过程中,颗粒会漂浮在表面,形成障碍面,阻碍后续滴入溶液接触氯化钙.由于障碍面的存在,凝胶颗粒形状不均匀,或大或小,或不成球形,在不同浓度氯化钙溶液中固定化酶颗粒形状如图2所示.图3为对酶活力的影响.
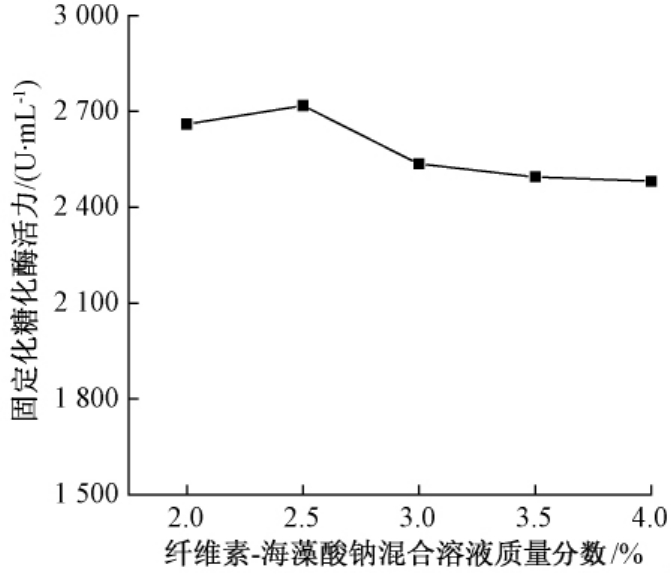
图1 纤维素-海藻酸钠混合溶液质量浓度对固定化糖化酶活力的影响
Fig.1 Effects of mass concentration of the mixed solution on enzyme activity of immobilized glucoamylase

图2 在不同浓度氯化钙溶液中固定化酶颗粒形状
Fig.2 The shapes of immobilized glucoamylase in the different concentrations of calcium chloride solution
由图3可知,随着氯化钙溶液质量浓度的增大,固定化后酶活力先增大后减小.氯化钙溶液质量浓度为2%时固定化糖化酶活力最好.海藻酸钠的分子结构会受离子浓度的影响,离子浓度越大,作用越大,在离子浓度过大时,酶活力受到影响而减小.
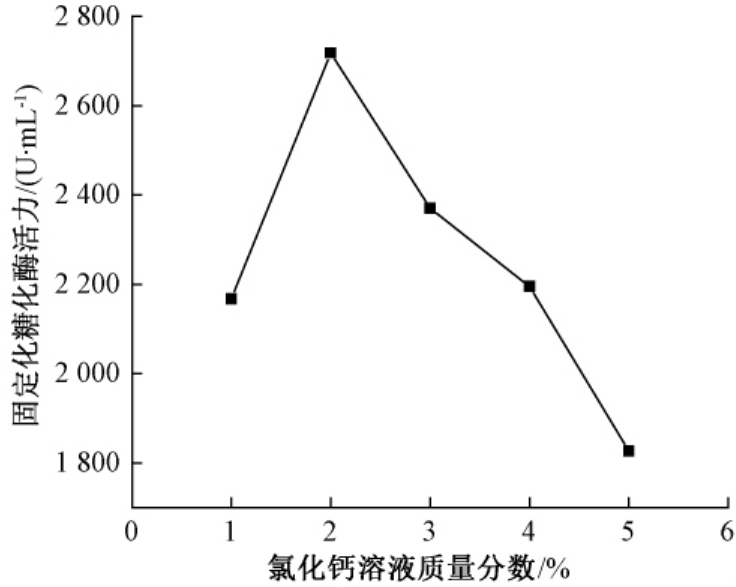
图3 氯化钙溶液质量浓度对固定化糖化酶活力的影响
Fig.3 Effects of mass concentration of calcium chloride solution on enzyme activity of immobilized glucoamylase
2.1.3 纤维素-海藻酸钠质量比对固定化糖化酶活力的影响
图4为纤维素-海藻酸钠质量比对固定化糖化酶活力的影响.一定范围内,随着纤维素用量的增加,固定化糖化酶活力逐渐升高,当纤维素-海藻酸钠质量比超过2∶1时,固定化酶活力有所降低.海藻酸钠具有低浓度高黏度的性质,海藻酸钠比例高会影响所包埋酶活性位点的暴露,以致固定化后的糖化酶活力减少.而当海藻酸钠量太少时,则影响固定化酶的成球性能,难以得到相似的规则颗粒,且酶颗粒的硬度低、机械强度弱,颗粒形状小.
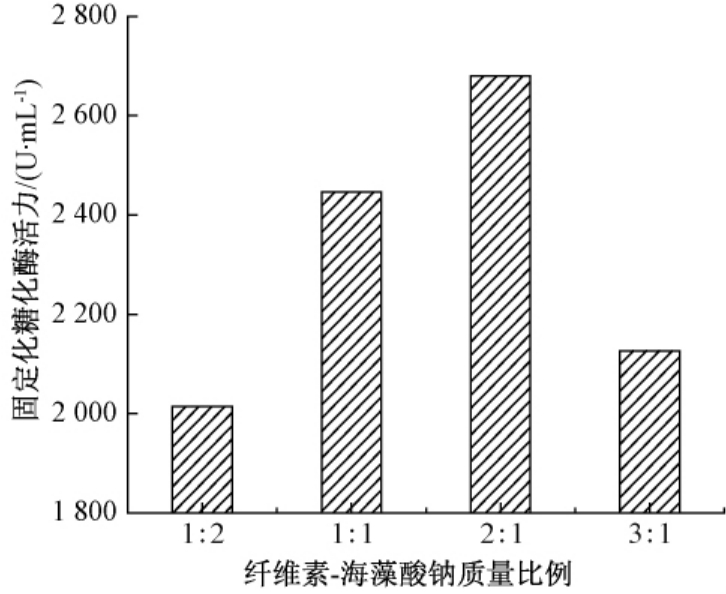
图4 纤维素-海藻酸钠质量比对固定化糖化酶活力的影响
Fig.4 Effects of mix proportion of cellulose and sodium alginate
2.2 固定化糖化酶制备条件优化
以固定化酶酶活为响应值,响应面的试验方案和结果如表1所示.
表1 响应面试验矩阵及结果
Tab.1 Results of response surface experiments
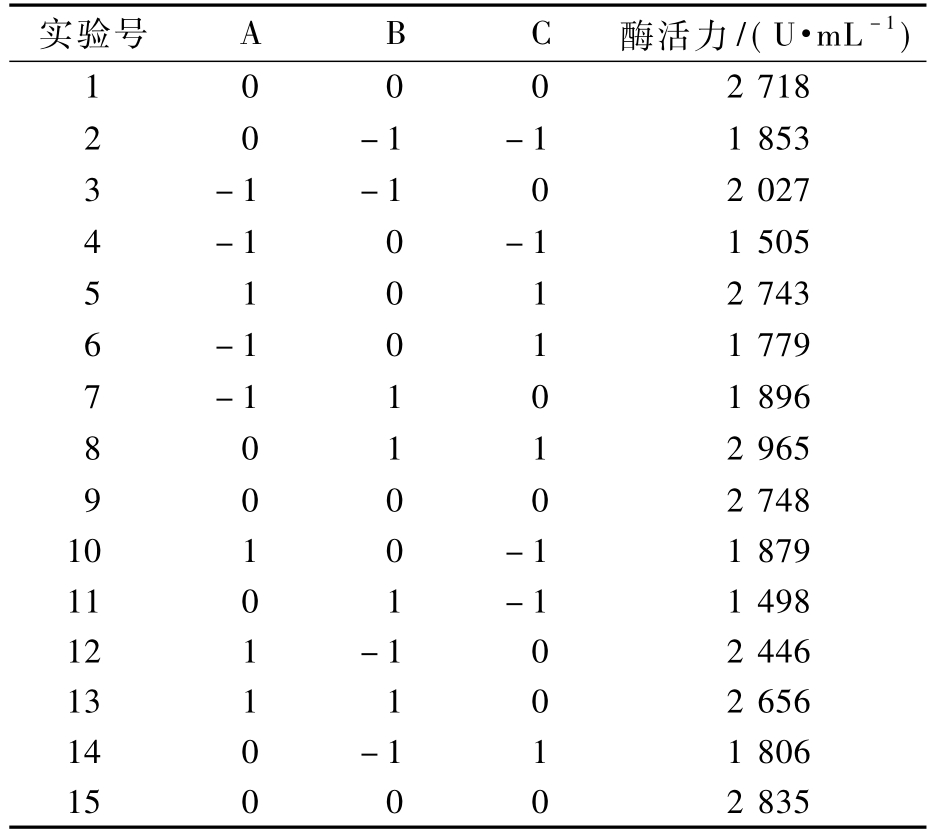
实验号 A B C 酶活力/(U·mL-1)1 0 0 0 2 718 2 0 -1 -1 1 853 3 -1 -1 0 2 027 4 -1 0 -1 1 505 5 1 0 1 2 743 6 -1 0 1 1 779 7 -1 1 0 1 896 8 0 1 1 2 965 9 0 0 0 2 748 10 1 0 -1 1 879 11 0 1 -1 1 498 12 1 -1 0 2 446 13 1 1 0 2 656 14 0 -1 1 1 806 15 0 0 0 2 835
应用Design Expert 8.0.6.1软件对所得试验数据进行了多元回归拟合,得到下面的回归方程:
酶活力=2 747.51+317.17A+110.38B+322.49C+62.78AB+174.74AC+346.00BC-286.44A2-295.30B2-512.18C2.
表2为回归模型及方差分析结果.由表2可知,模型的 P值为0.027 0,失拟项的值是0.054 0,模型拟合效果显著,且失拟项不显著说明模型拟合度好[21-22].从纤维素-海藻酸钠质量比例、纤维素-海藻酸钠混合溶液质量浓度、氯化钙溶液质量浓度的F值来看,影响酶活力值的强度由大到小依次为:氯化钙溶液质量浓度、纤维素-海藻酸钠质量比例、纤维素-海藻酸钠混合溶液质量浓度.由响应面试验得到的模型复相关系数 R2为0.920 6,校正后的复相关系数 R2为0.777 6,表明模型的相关性较好;变异系数表示的是试验数据的离散程度,变异系数的值越大表示试验的可信度越小,本试验的变异系数(C.V.%)的值为11.77,由此说明试验操作是可靠的;信噪比的值大于4则表示模型可用于预测,本试验的信噪比为6.643,大于4,所以由软件得出的模型可用来预测[23-25].
表2 回归模型及方差分析结果
Tab.2 Results of regression model and variance analysis
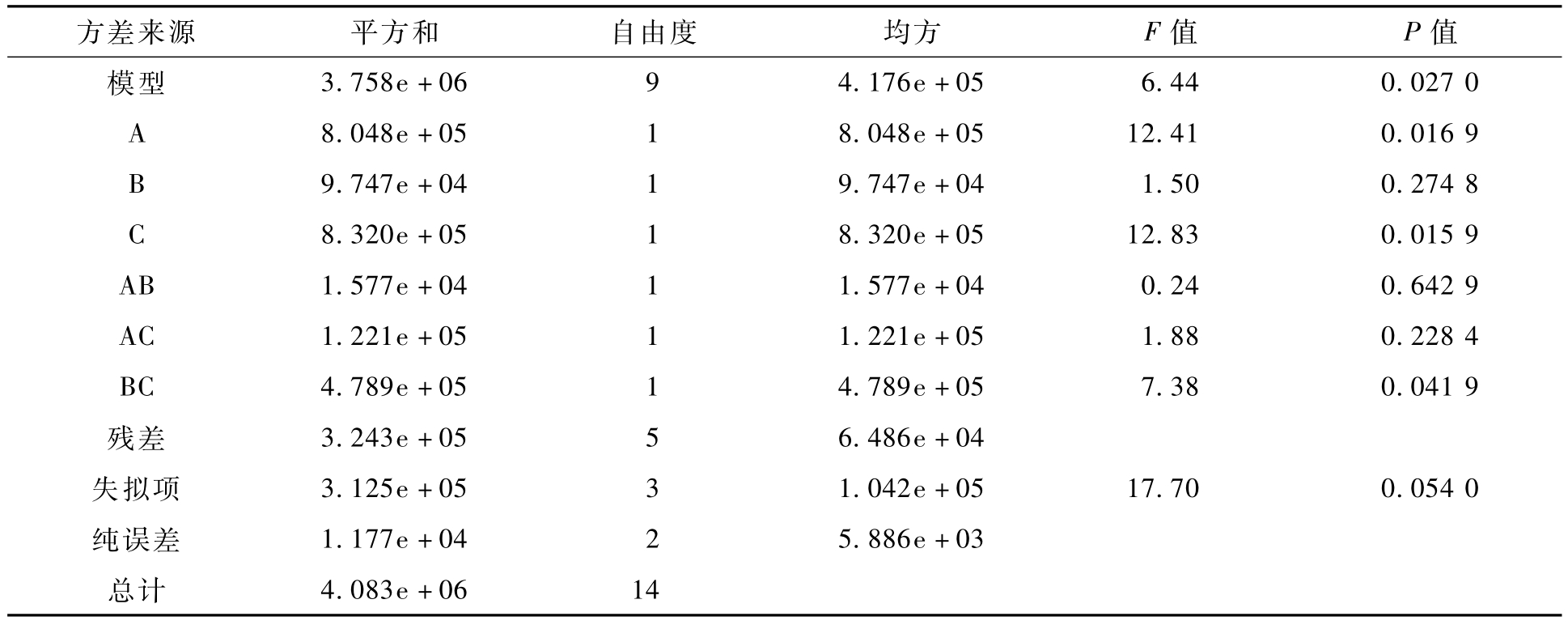
方差来源 平方和 自由度 均方 F值 P值3.758e+06 9 4.176e+05 6.44 0.027 0 A 8.048e+05 1 8.048e+05 12.41 0.016 9 B 9.747e+04 1 9.747e+04 1.50 0.274 8 C 8.320e+05 1 8.320e+05 12.83 0.015 9 AB 1.577e+04 1 1.577e+04 0.24 0.642 9 AC 1.221e+05 1 1.221e+05 1.88 0.228 4 BC 4.789e+05 1 4.789e+05 7.38 0.041 9残差 3.243e+05 5 6.486e+04失拟项 3.125e+05 3 1.042e+05 17.70 0.054 0纯误差 1.177e+04 2 5.886e+03总计模型4.083e+06 14
图5为各因素交互作用对固定化酶活力影响的响应曲面.固定化糖化酶的最佳工艺条件是:纤维素-海藻酸钠用量比例为1.5∶1,纤维素-海藻酸钠混合溶液质量浓度为2.80%,氯化钙溶液质量浓度为2.77%.
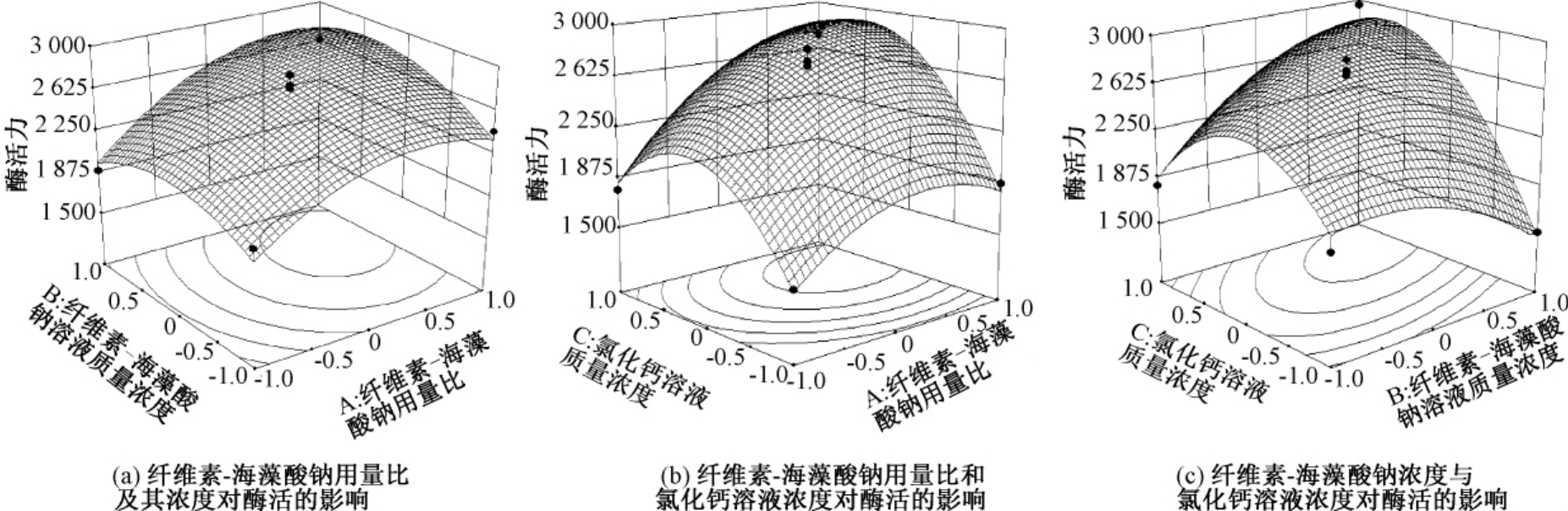
图5 各因素交互作用对固定化酶活力影响的响应曲面
Fig.5 The interactive influences of the parameters on enzyme activity of immobilized glucoamylase
2.3 优化工艺验证试验
模型预测最优条件下理论酶活力为2 984 U/mL.在由软件优化得出的最优条件下制备固定化糖化酶,进行了三组平行验证性试验,测得的平均酶活力为2 880 U/mL,与模型预测理论值相近,可以看出模型是可靠的.
2.4 不同吸附情况对比
吸附试验步骤:取一定量经晾干7 h后的固定化糖化酶小球于5.0 mL原酶液中进行吸附试验,吸附时间为1 h;分离吸附后的固定化酶颗粒与酶液,自然晾干吸附后固定化酶颗粒2 h,称其质量.
分别取在最优方案下制备的固定化糖化酶颗粒2 g,吸附试验最优条件下制备的固定化糖化酶0.999 8 g,做重复使用试验,用于可溶性淀粉溶液的分解,每次反应1 h,多次进行反应.后用分光光度计测反应液的吸光度,计算其含糖量,考察固定化糖化酶分解淀粉的能力.固定化糖化酶的重复使用性试验结果如图6所示.
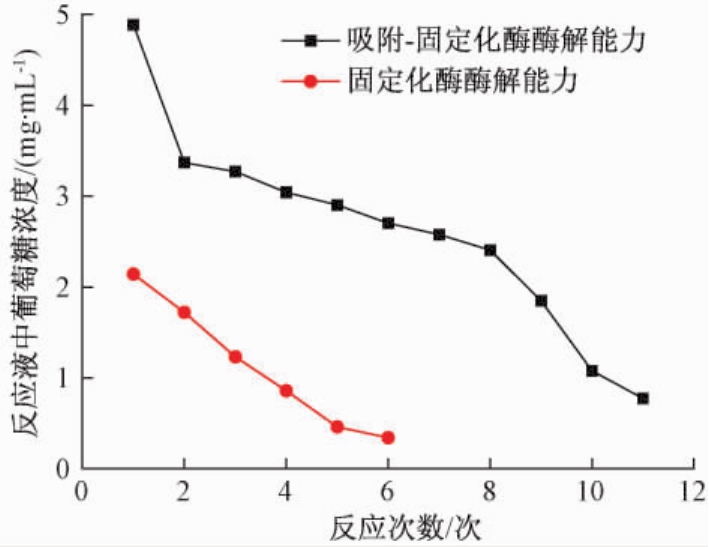
图6 固定化糖化酶重复性试验结果
Fig.6 Reusability of immobilized glucoamylase
由图6可知,未吸附的固定化酶重复使用性较差,吸附后的固定化酶重复使用性较好.随着反应次数的增加,未吸附的淀粉量减少,反应液含糖量也减少.随着反应次数的增加,未吸附的固定化酶分解淀粉的能力快速降低,使用3次后固定化酶分解淀粉的能力仅为原来的48%.吸附后的固定化糖化酶分解淀粉的能力降低得较缓慢,有一段较平稳期,如2~8次,反应8次后固定化糖化酶分解淀粉的能力仍有原来的50%.
3 结论
在单因素试验的基础上,利用响应面试验优化了固定化糖化酶的工艺条件,优化后的工艺条件为:纤维素-海藻酸钠用量比例为1.5∶1,纤维素-海藻酸钠混合溶液质量浓度为2.80%,氯化钙溶液质量浓度为2.77%.验证试验所得酶活力为2 880 U/mL,与理论值2 984 U/mL较接近,表明该模型可用于试验的设计和预测.
本研究还对固定化酶进行了吸附酶液试验,实验表明仅用包埋法制备的固定化糖化酶重复使用性较差,包埋并且吸附酶液的固定化糖化酶重复使用性较好.
[1]TALEKAR S,DESAI S,PILLAI M,et al.Carrier free co-immobilization of glucoamylase and pullulanase ascombi-crosslinked enzyme aggregates(combi-CLEAs)[J].Rsc advances,2013,3(7):2265-2271.
[2]BALDIKOVA E,POSPISKOVA K,LADAKIS D,et al.Magnetically modified bacterial cellulose:a promising carrier for immobilization of affinity ligands,enzymes,and cells[J].Materials science & engineering C,2017,127(11):214-221.
[3]AMIRBANDEH M,TAHERIKAFRANI A,SOOZANIP-OUR A,et al.Triazine-functionalized chitosan encapsul-ated super-paramagnetic nanoparticles as reusable and robust nanocarrier for glucoamylase immobilization[J].Biochemical engineering journal,2017,127(1):119-127.
[4]BRYJAK J,LIESIENE J,STEFUCA V.Man-tailored cellulose-based carriers for invertase immobilization[J].Cellulose,2008,15(4):631-640.
[5]HAMERSKA-DUDRA A,BRYJAK J,TROCHIMCZUK A W.Immobilization of glucoamylase and trypsin on crosslinked thermosensitive carriers[J].Enzyme &microbial technology,2007,41(3):197-204.
[6]ZHANG J,ZHANG F,YANG H,et al.Graphene oxide as a matrix for enzyme immobilization.[J].Langmuir the acs journal of surfaces& colloids,2010,26(9):6083-6085.
[7]李小东.交联淀粉酶聚集体的制备及其在淀粉酒精发酵中的应用研究[D].昆明:云南大学生物资源保护与利用重点实验室,2012.
[8]侯红萍,张萍,王如福.生物素-亲和素系统定向固定糖化酶的研究[J].中国食品学报,2014,14(3):106-114.
[9]王家东,张茜,侯红萍.介孔分子筛 MCM-41固定糖化酶的研究[J].中国酿造,2013,32(1):116-119.
[10]韩秀丽,赵浩浩,鲁峰,等.有机酸对纤维素酶解和纤维乙醇发酵的影响[J].郑州大学学报(工学版),2015,36(6):5-9.
[11]谈昭君.磁性载体的制备及其固定化纤维素酶的研究[D].兰州:兰州理工大学石油化工学院,2015.
[12]LEE D D,LEE Y Y,REILLY P J,et al.Pilot plant production of glucose with glucoamylase immobilized to porous silica.[J].Biotechnology & bioengineering,1976,18(2):253-267.
[13]左文刚,黄兵,侯红萍,等.铜金属螯合载体固定糖化酶[J].微生物学通报,2013,40(3):400-406.
[14]AMIRBANDEH M,TAHERIKAFRANI A.Immobilization of glucoamylase on triazine-functionalized Fe3O4/graphene oxide nanocomposite:Improved stability and reusability.[J].International journal of biological macro-molecules,2016,93(Pt A):1183-1191.
[15]齐香君,苟金霞,韩戌珺,等.3,5-二硝基水杨酸比色法测定溶液中还原糖的研究[J].纤维素科学与技术,2004,12(3):17-19.
[16]舒馨,刘雄民,梁秋霞.3,5-二硝基水杨酸吸光光度法测定八角残渣中总糖、还原糖含量[J].食品工业科技,2010,31(6):341-343.
[17]王冕,王如福,焦玉双.海藻酸钠-阿拉伯胶固定化糖化酶及其性质的研究[J].中国酿造,2015,34(3):24-29.
[18]董昭,周志明.海藻酸铝固定化糖化酶特性研究[J].应用化工,2010,39(6):886-888.
[19]夏烈文,李晓燕,王应红,等.凝胶组成和结构对淀粉糖化酶固定化效果的影响[J].内蒙古师范大学学报(自然科学汉文版),2013,42(1):59-63.
[20]张浩,杜立红,侯红萍.树脂-海藻酸钠混合凝胶共固定化糖化酶和酵母菌的研究[J].山西农业大学学报(自然科学版),2014,34(1):88-92.
[21]SHOJAEIMEHR T,RAHIMPOUR F,KHADIVI M A,et al.A modeling study by response surface methodology(RSM)and artificial neural network(ANN)on Cu2+,adsorption optimization using light expended clay aggregate(LECA) [J].Journal of industrial&engineering chemistry,2014,20(3):870-880.
[22]武秋颖,陈复生,时冬梅,等.响应面优化超声辅助碱法提取花生壳木聚糖的工艺研究[J].食品工业科技,2012,33(2):307-310.
[23]孙旸,努尔,林晓琼,等.纤维素酶处理玉米秸秆工艺条件的优化[J].吉林农业大学学报,2017,39(5):544-550.
[24]侯学敏,李林霞,张直峰,等.响应面法优化薄荷叶总黄酮提取工艺及抗氧化活性[J].食品科学,2013,34(6):124-128.
[25]刘新,李新生,吴三桥,等.响应面法优化橘汁糯米粉糖化醪液制备工艺[J].食品科学,2012,33(2):84-88.